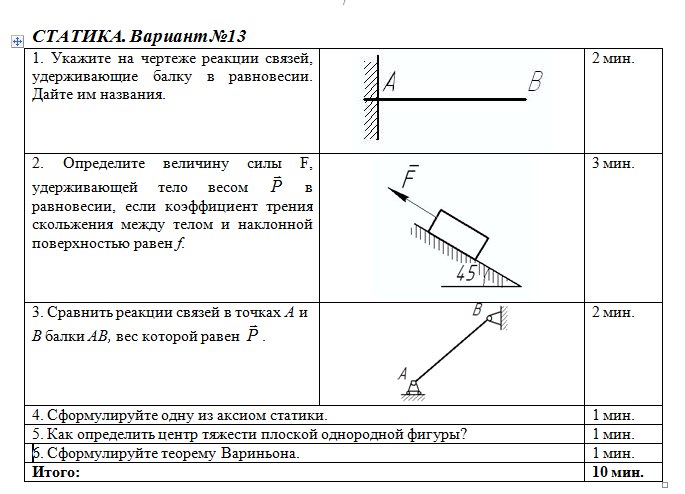
2. СВЯЗИ И РЕАКЦИИ СВЯЗЕЙ
13
2.1. Свободное и несвободное тело. Активные и реактивные силы
Тело называется свободным, если под действием приложенных к нему сил может перемещаться в любом направлении (рис. 2.1, а).
Тело, свобода перемещения которого ограничена другими телами, называется несвободным (рис. 2.1, б).
Тела, ограничивающие свободу перемещения данного тела, называются его связями.
При действии данного тела на связь с ее стороны возникает противодействие. Сила, с которой связь действует на данное тело, называется реакцией связи (R).
Таким образом, все силы, действующие на данное тело, можно подразделить на активные и реактивные силы.
Активными называются известные по модулю и направлению силы, с которыми на данное тело действуют другие тела, не являющиеся его связями.
Реактивные силы – это реакции связей данного тела. Реакции связей возникают только в том случае, когда тело под действием активных сил давит на связи. При этом направление реакции связи противоположно направлению, по которому связь препятствует перемещению данного тела, и зависит от типа связи.
При решении задач статики часто используется принцип освобождаемости тел от связей. Согласно этому принципу несвободное тело (рис. 2.1, б) можно рассматривать как свободное, если связи заменить их реакциями (рис. 2.1, в).
2.2. Основные типы связей
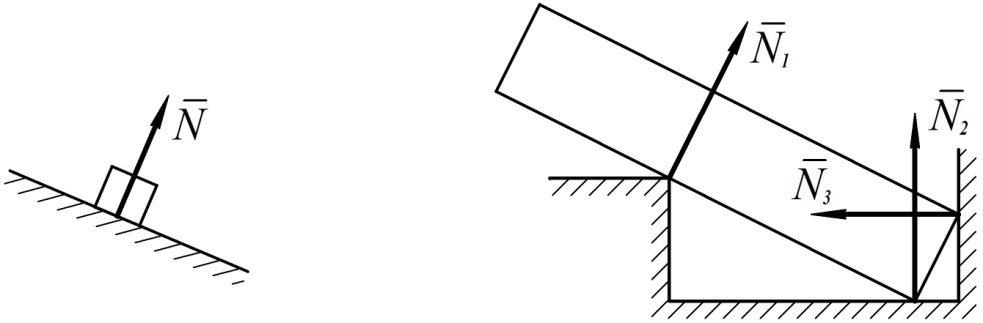
1.Абсолютно гладкая плоскость (или поверхность), где силы трения пренебрежимо малы. Реакция R гладкой плоскости (или поверхности) направлена по нормали к поверхности (рис. 2.2, а – 2.2, в).
2.Ребро. Реакция ребра R направлена по нормали к поверхности тела, опирающегося на это ребро (рис. 2.2, г).
3.Гибкая связь (трос, канат, нить). Реакция нити Т на данное тело направлена вдоль нити (рис. 2.2, д). Гибкая связь может испытывать только растяжение. При этом растягивающее усилие (натяжение) нити неизменно на всех ее участках и равно реакциям нити на соединяемые ей тела. При растяжении реакции направлены от тел, соединяемых нитью (рис. 2.2, е). Если пренебречь силами трения, то натяжение нити на всех ее участках равно величине подвешенного к ней груза (Т = Р).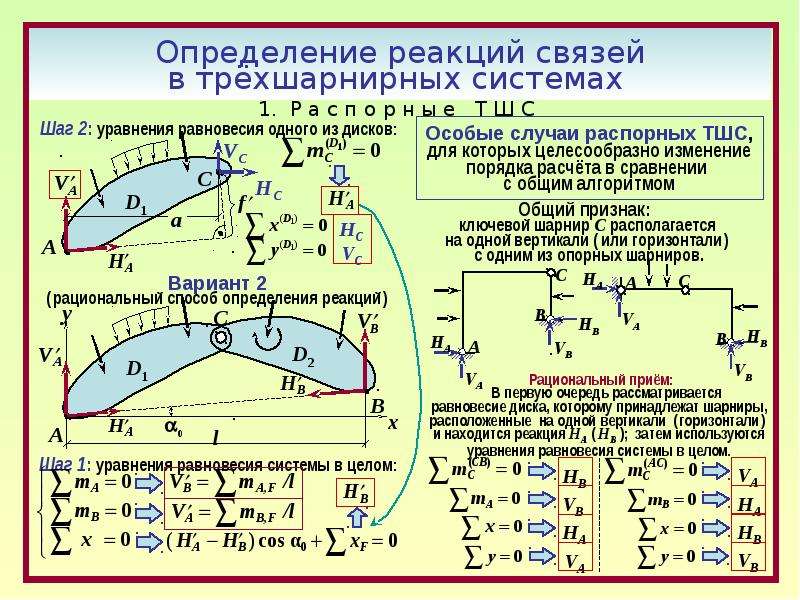
4.Тонкий невесомый (незагруженный) стержень с шарнирами по концам.
Шарнир – это устройство, допускающее поворот одного тела относительно другого. Реакция тонкого стержня N на данное тело направлена по прямой, соединяющей шарнирные концы стержня (рис. 2.3, а). В зависимости от направления сил, действующих со стороны шарниров, прямой невесомый
14
стержень АВ может испытывать растяжение или сжатие (рис. 2.3, б). Усилие стержня изображается его реакциями на шарниры: при растяжении – стрелками от шарниров, а при сжатии – стрелками к шарнирам.
5. Шарнирно-подвижная опора (рис. 2.4, а). Эта связь допускает поворот данного тела вокруг оси опорного шарнира и поступательное (линейное) перемещение тела параллельно опорной плоскости. Реакция связи R проходит через центр шарнира перпендикулярно опорной плоскости. Конструкция шарнира представляет собой подшипник (цилиндрический шарнир), наружная обойма которого крепится к опоре, а внутренний валик – к данному телу. Шарнирно-подвижная опора эквивалентна одной связи 4-го типа (рис.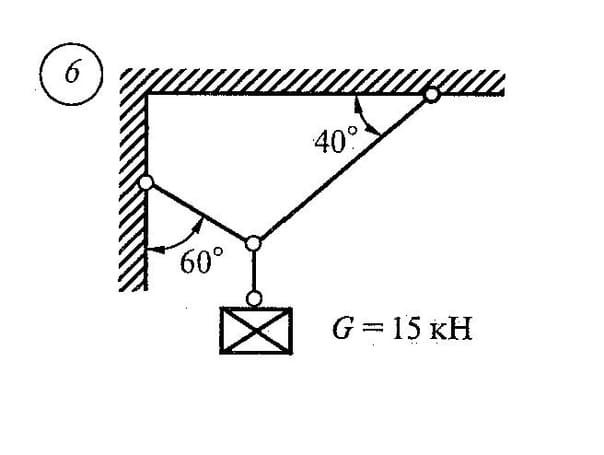
6. Шарнирно-неподвижная опора (рис. 2.4, в). Эта связь допускает только поворот данного тела вокруг оси опорного шарнира, препятствуя любому поступательному движению тела. Реакция связи R проходит через центр шарнира, но линия действия реакции может быть какой угодно в зависимости от сил, действующих на данное тело. Таким образом, определению подлежат как модуль R, так и угол α, определяющий направление реакции. Очень часто вместо R и α определяют составляющие Х и У реакции по взаимно перпендикулярным осям х и у, после чего, используя в условиях плоской задачи зависимости (1.1) и (1.2), определяют модуль и направление реакции
R = X + У = Хi + Уj
где Х, У – проекция R на оси х, у.
R = \/ Х2 + У2 , tg α = У / Х → α
Шарнирно-неподвижная опора эквивалентна двум связям 4-го типа (рис. 2.4, г).
7.Жестко защемляющая опора (заделка). Эта связь (рис. 2.4, д)
препятствует любому поступательному и вращательному движению данного
тела. Составляющими реакции заделки А являются горизонтальная Ха, вертикальная Уа составляющие и опорный момент Ма. Заделка эквивалентна трем связям 4-го типа, оси которых не должны пересекаться в данной точке
Заделка эквивалентна трем связям 4-го типа, оси которых не должны пересекаться в данной точке
(рис. 2.4, е).
8.Шаровой шарнир (рис. 2.4, ж). Эта связь представляет собой шар, который может вращаться внутри сферической полости. Линия действия реакции R проходит как угодно в пространстве через центр шара. Модуль и направление реакции R можно определить через ее составляющие Х, У и Z по зависимостям (1.2) и (1.3).
|
| 15 |
|
а. | б. |
| б. |
| Свободное тело | Несвободное тело | Свободное тело |
Р | Р |
| Связь |
Активная сила (сила тяжести)
| Р | |
Реакция | R | |
связи | ||
|
Рис. 2.1
2.1
а.
R
г.
90Е
RA
б.
9 0 Е
. 0Ес
9 ка
RB
A B
Е
R
д.
в. | 90 |
|
|
|
|
|
| Е |
к |
|
|
|
|
|
| ||
а |
|
|
|
|
|
|
|
|
с |
| Е |
|
|
|
|
|
|
. |
|
|
|
|
| 0 | ||
| RA |
|
|
|
| 9 |
| |
|
|
|
|
| RC |
| ||
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| C | |
|
| P |
|
|
|
| ||
A |
|
|
| B |
|
| ||
|
|
| Е | R |
|
| ||
|
|
|
|
|
|
| ||
|
| 0 |
|
|
|
|
| |
|
| 9 |
|
|
|
|
|
|
|
|
|
| B |
|
|
| |
е. |
|
|
|
|
| Т |
|
|
|
|
|
|
|
|
|
| |
Т |
| Т |
|
|
|
|
| Т |
Т |
|
|
|
|
|
| ||
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| Т | |
Т
РТ
Р
Т
Рис. 2.2
2.2
Связи и реакции связей – Telegraph
➡➡➡ ПОДРОБНЕЕ КЛИКАЙ ТУТ!
Связи и реакции связей Тело называется свободным , если его перемещение в пространстве ничем не ограничено. Силы, с которыми связи действуют на данное тело, называются реакциями связей . Основные виды связей и их реакции
Связи и реакции связей. Тело называется свободным , если его перемещение в пространстве ничем не ограничено. Очень важно правильно расставить реакции связей, иначе написанные окажутся неверными. Ниже приведены примеры замены связей их реакциями.
Связи и реакции связей. Все законы и теоремы статики справедливы для свободного твердого тела. Все связи можно разделить на несколько типов. Связь — гладкая опора (без трения). Рисунок 1. Реакция опоры приложена в точке опоры и всегда направлена перпендикулярно…
Определение реакции связей, наложенных на балку при ее равновесии, а также моменты силы F, реакции нити T и реакции стержня S относительно точек приложения остальных двух из этих сил. Анализ условий равновесия для плоской произвольной системы сил.
Анализ условий равновесия для плоской произвольной системы сил.
Эти силы называются реакциями связи. Числовые значения реакций связей, как правило, неизвестны, и они определяются Основные типы связей и их реакции представлены в табл. 2.1. В левом столбце показано рассматриваемое тело и наложенные на него связи, в правом…
Картинки по запросу «Реферат: Связи и реакции связей»
Деловые встречи и переговоры реферат. Демографическая проблема реферат. Детские дипломы и грамоты шаблоны скачать бесплатно. Реферат на тему культура и искусство древнего египта. Реферат на тему легкая атлетика краткое содержание.
Направлена реакция связи в сторону, противоположную той, куда связь не дает перемещаться телу. Когда связь одновременно препятствует перемещениям тела по нескольким направлениям, направление реакции связи также наперед неизвестно и должно определяться…
Связи и реакции связей. Тело называется свободным , если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным , а тела, ограничивающие перемещения данного тела, связями .
Связи и реакции связей. Преподаватель ГБУ КО ПОО «КИТиС». А.Н.Панина. Принцип освобождаемости от связей. Всякое несвободное тело можно рассматривать как свободное, если мысленно отбросить связи, учтя их действие введением соответствующих реакций связей.
Связи и их реакции. Тело, перемещению которого в пространстве препятствует какие-нибудь другие тела, скрепленные или соприкасающиеся с данным, называется несвободным. Все то, что ограничивает перемещение данного тела в пространстве, называется связями.
twidler.ru/referat/stroitelstvo/svyazi-i-reakcii-svyazey-322327
Связи и реакции связей. Раздел: Строительство. Тип: реферат. Дата добавления: 26.01.2014. Контакт тела со связью осуществляется по поверхности. Имеем распределенную систему сил реакции, которая, как будет показано, может быть заменена одной силой и парой…
Виды связей и их реакции. При решении технических задач возникает необходимость поиска реакций различных связей. Основные типы связей: 1. Гладкая поверхность или опора.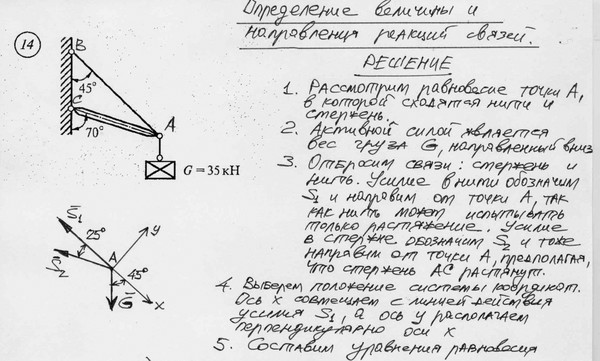 Гладкой считается поверхность, трением о которую можно пренебречь.
Гладкой считается поверхность, трением о которую можно пренебречь.
Связи и их реакции. Тема 2. Доклад-сообщение содержит 49 слайдов. Презентации для любого класса можно скачать бесплатно. Связи и их реакции Тело, которое может свободно перемещаться в пространстве называется свободным. (самолет, снаряд…)
Реакции связей относятся к разряду внешних сил. Реакции связей — силы, действующие на точки механической системы со стороны материальных тел, осуществляющих связи, наложенные на эту систему. В дальнейшем силы, не являющиеся реакциями связей…
Понятие связей и их реакций. Примеры реакций связей, определение их направления и величины. Примеры связей в различных опорах с иллюстрациями и подробными пояснениями.
Направлена реакция связи в сторону, противоположную той, куда связь не дает перемещаться телу. Когда связь одновременно препятствует перемещениям тела по нескольким направлениям, направление реакции связи также наперед неизвестно и должно определяться…
Связи и реакции связей. 1. Гладкая (без трения) плоскость или поверхность. Такие связи препятствуют перемещениям тела только в направлении общей нормали в точке касания, вдоль которой и будет направлена соответствующая реакция.
1. Гладкая (без трения) плоскость или поверхность. Такие связи препятствуют перемещениям тела только в направлении общей нормали в точке касания, вдоль которой и будет направлена соответствующая реакция.
k-a-t.ru/tex_mex/11-statika_svyazi/index.shtml
Принцип освобождаемости. Связи и реакции связей. Как уже упоминалось в предыдущих статьях, статика изучает условия Типичные связи тел и их реакции. Рассмотрим наиболее часто встречающиеся связи, а также возникающие в них реакции при приложении нагрузок.
Связи и их реакции. По определению, тело, которое не скреплено с другими телами и может совершать из данного положения любые перемещения в пространстве, называется свободным (например, воздушный шар в воздухе). Тело, перемещениям которого в пространстве…
fiziku5.ru/uchebnye-materialy-po-fizike/vidy-svyazej-statika
Виды связей — статика. 3. Связь — тело, ограничивающее свободу движения твёрдого тела. 4. Если приложенные силы стремятся 6. Направление реакции связи — противоположное тому, куда связь не даёт перемещаться телу.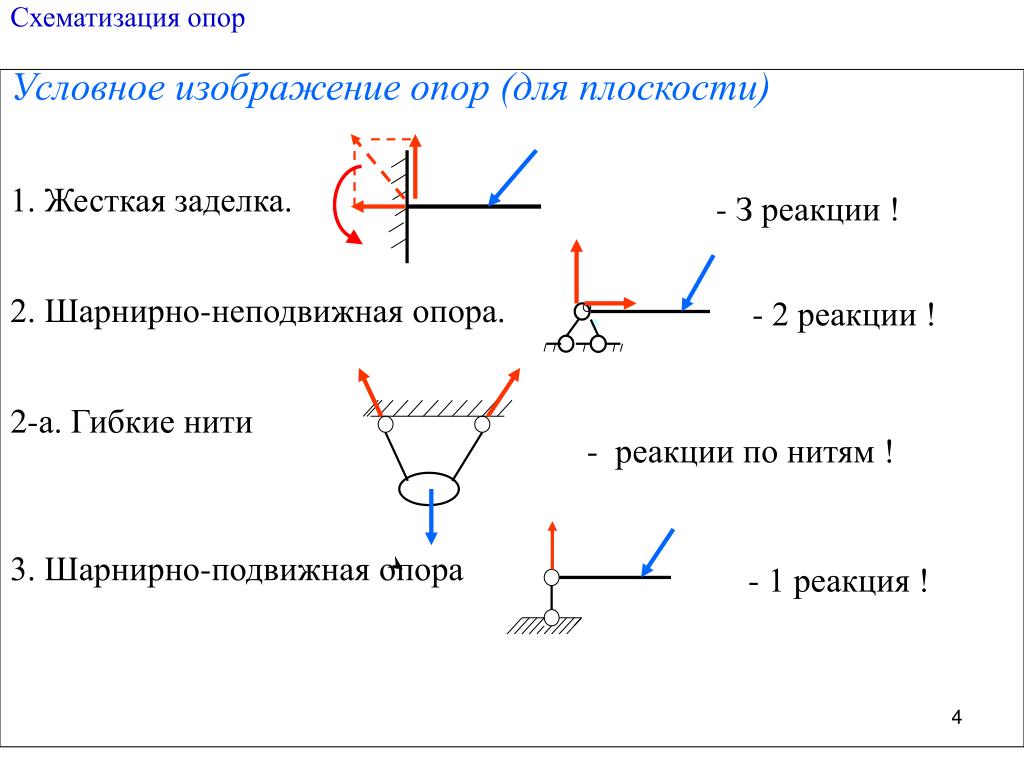 (связь не даёт перемещаться вниз, значит — реакция…
(связь не даёт перемещаться вниз, значит — реакция…
Связи и реакции связей. Тело называется свободным, если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным, а тела, ограничивающие перемещения данного тела, ¾ связями.
Связи и реакции связей. Автор работы: Пользователь скрыл имя, 13 Марта 2011 в 09:02, лекция. Связи и реакции связей. Тело называется свободным, если его перемещение в пространстве ничем не ограничено.
referatwork.ru/category/mekhanika/view/192620_svyazi_i_ih_reakcii
Неизвестные вектор реакции связи определяется в плоскости двумя составляющими и , то есть реакция связи с неподвижной осью вращения Связи — это тела, которые ограничивают движение рассматриваемого тела. Реакции связей — силы, действующие на тело со стороны…
Силы, с которыми связи действуют на данное тело, называются реакциями связей . Основные виды связей и их реакции Реакция связи направлена по стержню. Похожий материал — Реферат: Рынок ценных бумаг Японии (2003г. ) В отличие от нити стержень может работать и…
) В отличие от нити стержень может работать и…
РЕФЕРАТ. Глава 1 — Связь, реакция связи. Глава 2. Основные виды связей. Направлена реакция связи в сторону, противоположную той, куда связь не дает перемещаться телу. Когда связь может препятствовать перемещениям тела по нескольким направлениям, направление…
Связи и реакции связей. Тело называется свободным , если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным , а тела, ограничивающие перемещения данного тела, связями .
referat-4all.ru/2017/08/svyazi-i-ih-reakcii/
Связи и их реакции. По определению, тело, которое не скреплено с другими телами и может совершать из данного положения любые перемещения в пространстве, называется свободным (например, воздушный шар в воздухе).
Основные виды связей и их реакции: 1. Гладкая поверхность (без трения): Реакция гладкой поверхности направлена по нормали к этой поверхности (перпендикулярна общей касательной). Вам будет интересно — Реферат: Особенности внебюджетных фондов.
refy.ru/89/304694-svyazi-i-reakcii-svyazey.html
Рефераты по строительству » Связи и реакции связей. Тело называется свободным, если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным, а тела, ограничивающие перемещения данного тела, связями.
Связи и реакции связей Тело называется свободным , если его перемещение в пространстве ничем не ограничено. Силы, с которыми связи действуют на данное тело, называются реакциями связей . Основные виды связей и их реакции
Связи и реакции связей. Тело называется свободным , если его перемещение в пространстве ничем не ограничено. Очень важно правильно расставить реакции связей, иначе написанные окажутся неверными. Ниже приведены примеры замены связей их реакциями.
Связи и реакции связей. Все законы и теоремы статики справедливы для свободного твердого тела. Все связи можно разделить на несколько типов. Связь — гладкая опора (без трения). Рисунок 1. Реакция опоры приложена в точке опоры и всегда направлена перпендикулярно. ..
..
Определение реакции связей, наложенных на балку при ее равновесии, а также моменты силы F, реакции нити T и реакции стержня S относительно точек приложения остальных двух из этих сил. Анализ условий равновесия для плоской произвольной системы сил.
Эти силы называются реакциями связи. Числовые значения реакций связей, как правило, неизвестны, и они определяются Основные типы связей и их реакции представлены в табл. 2.1. В левом столбце показано рассматриваемое тело и наложенные на него связи, в правом…
Картинки по запросу «Реферат: Связи и реакции связей»
Деловые встречи и переговоры реферат. Демографическая проблема реферат. Детские дипломы и грамоты шаблоны скачать бесплатно. Реферат на тему культура и искусство древнего египта. Реферат на тему легкая атлетика краткое содержание.
Направлена реакция связи в сторону, противоположную той, куда связь не дает перемещаться телу. Когда связь одновременно препятствует перемещениям тела по нескольким направлениям, направление реакции связи также наперед неизвестно и должно определяться. ..
..
Связи и реакции связей. Тело называется свободным , если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным , а тела, ограничивающие перемещения данного тела, связями .
Связи и реакции связей. Преподаватель ГБУ КО ПОО «КИТиС». А.Н.Панина. Принцип освобождаемости от связей. Всякое несвободное тело можно рассматривать как свободное, если мысленно отбросить связи, учтя их действие введением соответствующих реакций связей.
Связи и их реакции. Тело, перемещению которого в пространстве препятствует какие-нибудь другие тела, скрепленные или соприкасающиеся с данным, называется несвободным. Все то, что ограничивает перемещение данного тела в пространстве, называется связями.
twidler.ru/referat/stroitelstvo/svyazi-i-reakcii-svyazey-322327
Связи и реакции связей. Раздел: Строительство. Тип: реферат. Дата добавления: 26.01.2014. Контакт тела со связью осуществляется по поверхности. Имеем распределенную систему сил реакции, которая, как будет показано, может быть заменена одной силой и парой.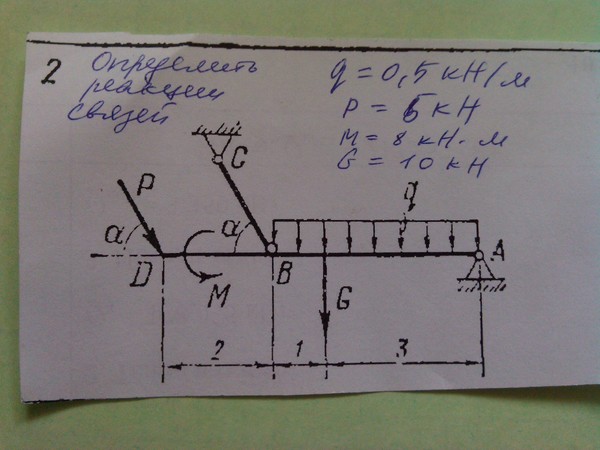 ..
..
Виды связей и их реакции. При решении технических задач возникает необходимость поиска реакций различных связей. Основные типы связей: 1. Гладкая поверхность или опора. Гладкой считается поверхность, трением о которую можно пренебречь.
Связи и их реакции. Тема 2. Доклад-сообщение содержит 49 слайдов. Презентации для любого класса можно скачать бесплатно. Связи и их реакции Тело, которое может свободно перемещаться в пространстве называется свободным. (самолет, снаряд…)
Реакции связей относятся к разряду внешних сил. Реакции связей — силы, действующие на точки механической системы со стороны материальных тел, осуществляющих связи, наложенные на эту систему. В дальнейшем силы, не являющиеся реакциями связей…
Понятие связей и их реакций. Примеры реакций связей, определение их направления и величины. Примеры связей в различных опорах с иллюстрациями и подробными пояснениями.
Направлена реакция связи в сторону, противоположную той, куда связь не дает перемещаться телу.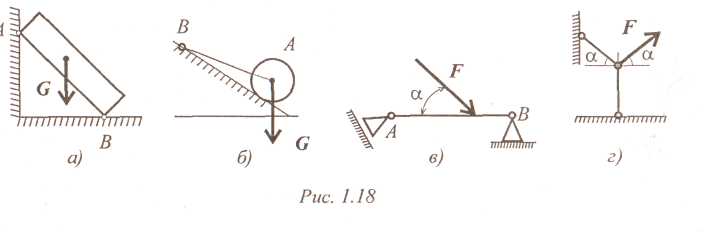 Когда связь одновременно препятствует перемещениям тела по нескольким направлениям, направление реакции связи также наперед неизвестно и должно определяться…
Когда связь одновременно препятствует перемещениям тела по нескольким направлениям, направление реакции связи также наперед неизвестно и должно определяться…
Связи и реакции связей. 1. Гладкая (без трения) плоскость или поверхность. Такие связи препятствуют перемещениям тела только в направлении общей нормали в точке касания, вдоль которой и будет направлена соответствующая реакция.
k-a-t.ru/tex_mex/11-statika_svyazi/index.shtml
Принцип освобождаемости. Связи и реакции связей. Как уже упоминалось в предыдущих статьях, статика изучает условия Типичные связи тел и их реакции. Рассмотрим наиболее часто встречающиеся связи, а также возникающие в них реакции при приложении нагрузок.
Связи и их реакции. По определению, тело, которое не скреплено с другими телами и может совершать из данного положения любые перемещения в пространстве, называется свободным (например, воздушный шар в воздухе). Тело, перемещениям которого в пространстве…
fiziku5.ru/uchebnye-materialy-po-fizike/vidy-svyazej-statika
Виды связей — статика. 3. Связь — тело, ограничивающее свободу движения твёрдого тела. 4. Если приложенные силы стремятся 6. Направление реакции связи — противоположное тому, куда связь не даёт перемещаться телу. (связь не даёт перемещаться вниз, значит — реакция…
3. Связь — тело, ограничивающее свободу движения твёрдого тела. 4. Если приложенные силы стремятся 6. Направление реакции связи — противоположное тому, куда связь не даёт перемещаться телу. (связь не даёт перемещаться вниз, значит — реакция…
Связи и реакции связей. Тело называется свободным, если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным, а тела, ограничивающие перемещения данного тела, ¾ связями.
Связи и реакции связей. Автор работы: Пользователь скрыл имя, 13 Марта 2011 в 09:02, лекция. Связи и реакции связей. Тело называется свободным, если его перемещение в пространстве ничем не ограничено.
referatwork.ru/category/mekhanika/view/192620_svyazi_i_ih_reakcii
Неизвестные вектор реакции связи определяется в плоскости двумя составляющими и , то есть реакция связи с неподвижной осью вращения Связи — это тела, которые ограничивают движение рассматриваемого тела. Реакции связей — силы, действующие на тело со стороны.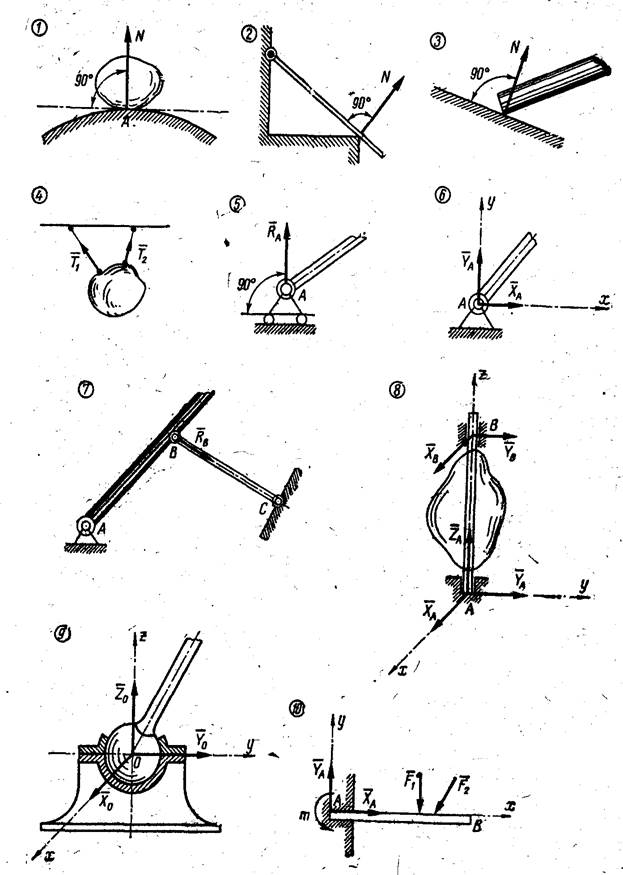 ..
..
Силы, с которыми связи действуют на данное тело, называются реакциями связей . Основные виды связей и их реакции Реакция связи направлена по стержню. Похожий материал — Реферат: Рынок ценных бумаг Японии (2003г.) В отличие от нити стержень может работать и…
РЕФЕРАТ. Глава 1 — Связь, реакция связи. Глава 2. Основные виды связей. Направлена реакция связи в сторону, противоположную той, куда связь не дает перемещаться телу. Когда связь может препятствовать перемещениям тела по нескольким направлениям, направление…
Связи и реакции связей. Тело называется свободным , если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным , а тела, ограничивающие перемещения данного тела, связями .
referat-4all.ru/2017/08/svyazi-i-ih-reakcii/
Связи и их реакции. По определению, тело, которое не скреплено с другими телами и может совершать из данного положения любые перемещения в пространстве, называется свободным (например, воздушный шар в воздухе).
Основные виды связей и их реакции: 1. Гладкая поверхность (без трения): Реакция гладкой поверхности направлена по нормали к этой поверхности (перпендикулярна общей касательной). Вам будет интересно — Реферат: Особенности внебюджетных фондов.
refy.ru/89/304694-svyazi-i-reakcii-svyazey.html
Рефераты по строительству » Связи и реакции связей. Тело называется свободным, если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным, а тела, ограничивающие перемещения данного тела, связями.
Реферат: IP-телефонія 2
Реферат: Пластики в автомобилестроении
Реферат: Online Interviews With Gwendolyn Brooks Essay Research
Курсовая работа: Цели фирмы. Построение дерева целей
Реферат: Устойчивость растений к недостатку влаги
Химические связи: определение, типы и примеры
- Определение: что такое химическая связь?
- Различные типы химических связей с примерами
- Часто задаваемые вопросы
Определение: что такое химическая связь?
Химические связи — это силы, которые удерживают атомы вместе в молекуле. Они являются результатом сильных внутримолекулярных взаимодействий между атомами молекулы. Валентные (самые внешние) электроны атомов участвуют в химических связях. Когда два атома приближаются друг к другу, эти внешние электроны начинают взаимодействовать. Хотя электроны отталкиваются друг от друга, они притягиваются к протонам внутри атомов. Взаимодействие сил приводит к образованию связей между атомами. Основными типами химических связей являются ионная связь, ковалентная связь, водородная связь и металлическая связь 9.0013 [1,2] .
Они являются результатом сильных внутримолекулярных взаимодействий между атомами молекулы. Валентные (самые внешние) электроны атомов участвуют в химических связях. Когда два атома приближаются друг к другу, эти внешние электроны начинают взаимодействовать. Хотя электроны отталкиваются друг от друга, они притягиваются к протонам внутри атомов. Взаимодействие сил приводит к образованию связей между атомами. Основными типами химических связей являются ионная связь, ковалентная связь, водородная связь и металлическая связь 9.0013 [1,2] .
Связь между двумя атомами зависит от разницы электроотрицательностей между атомами. Если разница электроотрицательностей значительно высока, атомы передают электроны, образуя ионы и тем самым образуя ионную связь. Если разность электроотрицательностей равна нулю или мала, то атомы объединяются, образуя ковалентные связи.
Различные типы химических связей с примерами
Типы химических связей1. Ионная связь
Как следует из названия, ионные связи возникают в результате притяжения между ионами.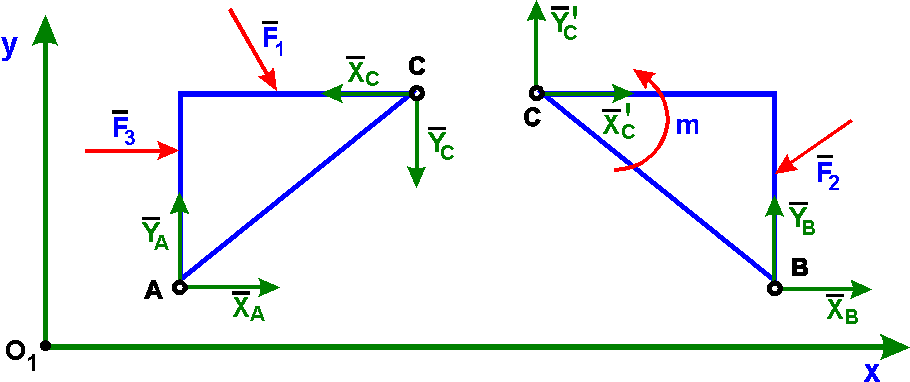 Ионы образуются, когда атом теряет или приобретает электрон. Эти типы связей обычно образуются между металлом и неметаллом 9.0013 [1-5] .
Ионы образуются, когда атом теряет или приобретает электрон. Эти типы связей обычно образуются между металлом и неметаллом 9.0013 [1-5] .
Примеры
- Натрий (Na) и хлор (Cl) объединяются с образованием устойчивых кристаллов хлорида натрия (NaCl), также известного как поваренная соль.
- Магний (Mg) и кислород (O) соединяются с образованием оксида магния (MgO).
- Калий (K) и хлор (Cl) объединяются с образованием хлорида калия (KCl)
- Кальций (Ca) и фтор (F) объединяются с образованием фторида кальция (CaF 2 )
2. Ковалентная связь
В случае ковалентной связи атом разделяет одну или несколько пар электронов с другим атомом и образует связь. Это совместное использование электронов происходит потому, что атомы должны удовлетворять правилу октета (конфигурации благородных газов) при соединении. Такой тип связи характерен для двух неметаллов. Ковалентная связь является самой прочной и наиболее распространенной формой химической связи в живых организмах. Вместе с ионной связью они образуют две наиболее важные химические связи [1-7] .
Вместе с ионной связью они образуют две наиболее важные химические связи [1-7] .
Ковалентную связь можно разделить на неполярную ковалентную связь и полярную ковалентную связь. В случае неполярной ковалентной связи электроны поровну распределяются между двумя атомами. Наоборот, в полярных ковалентных связях электроны распределены между атомами неравномерно.
Примеры
- Два атома йода (I) соединяются с образованием газа йода (I 2 ).
- Один атом углерода (C) соединяется с двумя атомами кислорода (O) с образованием двойной ковалентной связи в двуокиси углерода (CO 2 ).
- Два атома водорода (H) соединяются с одним атомом кислорода (O) с образованием полярной молекулы воды (H 2 O).
- Бор (B) и три атома водорода (H) объединяются, образуя полярный боран (BH 3 ).
3. Водородная связь
Водородная связь представляет собой химическую связь между атомом водорода и электроотрицательным атомом.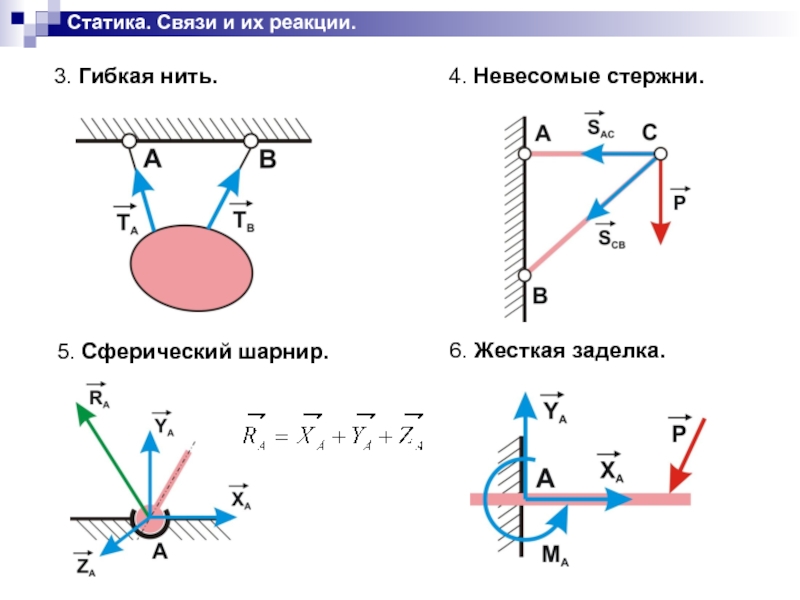 Однако это не ионная или ковалентная связь, а особый тип диполь-дипольного притяжения между молекулами. Во-первых, атом водорода ковалентно связан с очень электроотрицательным атомом, что приводит к положительному заряду, который затем притягивается к электроотрицательному атому, что приводит к водородной связи [1,4-6] .
Однако это не ионная или ковалентная связь, а особый тип диполь-дипольного притяжения между молекулами. Во-первых, атом водорода ковалентно связан с очень электроотрицательным атомом, что приводит к положительному заряду, который затем притягивается к электроотрицательному атому, что приводит к водородной связи [1,4-6] .
Примеры
- Атом водорода одной молекулы воды связывается с атомом кислорода другой молекулы. Эта связь весьма значительна во льду.
- В хлороформе (CH 3 Cl) и аммиаке (NH 3 ) водородная связь возникает между водородом одной молекулы и углеродом/азотом другой.
- Азотистые основания, присутствующие в ДНК, удерживаются вместе водородной связью.
4. Металлические связи
Металлическая связь представляет собой силу, удерживающую атомы вместе в металлическом веществе. Такое твердое тело состоит из плотно упакованных атомов, где самая внешняя электронная оболочка каждого атома металла перекрывается с большим количеством соседних атомов. Вследствие этого валентные электроны свободно перемещаются от одного атома к другому. Они не связаны с какой-либо конкретной парой атомов. Такое поведение называется нелокализацией [1,2,4] .
Вследствие этого валентные электроны свободно перемещаются от одного атома к другому. Они не связаны с какой-либо конкретной парой атомов. Такое поведение называется нелокализацией [1,2,4] .
Примеры
- Металлический натрий
- Алюминиевая фольга
- Медная проволока
Другие типы химических связей
Van der Wa als Bond
Нейтральные молекулы удерживаются вместе слабыми электрическими силами, известными как Ван-дер-Ваальс сил. Сила Ван-дер-Ваальса — это общий термин, используемый для определения притяжения межмолекулярных сил между молекулами. Этот тип химической связи является самым слабым из всех связей [4,5] .
Примеры включают водородную связь, лондонские дисперсионные силы и диполь-дипольные силы.
Пептидная связь
В белке несколько аминокислот соединены друг с другом пептидными связями, образуя таким образом длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, когда она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседних аминокислот. Помимо пептидных связей, в белках также распространены водородные связи, ионные связи и дисульфидные связи.0013 [8] .
Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, когда она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседних аминокислот. Помимо пептидных связей, в белках также распространены водородные связи, ионные связи и дисульфидные связи.0013 [8] .
Примеры включают полипептиды, такие как инсулин и гормон роста.
Часто задаваемые вопросы
Q.1. Что происходит с химическими связями в ходе химических реакций?Ответ. Во время химических реакций связи, удерживающие молекулы вместе, разрываются и образуют новые связи, превращая атомы в разные вещества.
Q.2. Почему атомы образуют химические связи?Ответ. Атомы образуют химические связи, чтобы сделать их внешние электронные оболочки более стабильными.
Q.3. Какие субатомные частицы участвуют в химической связи? Ответ. Среди субатомных частиц только электроны активно участвуют в химической связи.
Среди субатомных частиц только электроны активно участвуют в химической связи.
Ответ . Наше тело использует энергию, хранящуюся в химических связях, чтобы выполнять работу и поддерживать свою активность и функциональность.
Q.5. Какой вид энергии запасается в химической связи?Ответ. Потенциальная энергия хранится в ковалентных связях, удерживающих атомы вместе в молекуле.
В.6. Что вызывает разрыв химических связей во время реакции?Ответ. Для разрыва или образования каждой связи требуется определенное количество энергии. Без этой энергии реакция не может произойти. Эта энергия известна как энергия связи.
В.7. Почему благородные газы не образуют химических связей? Ответ.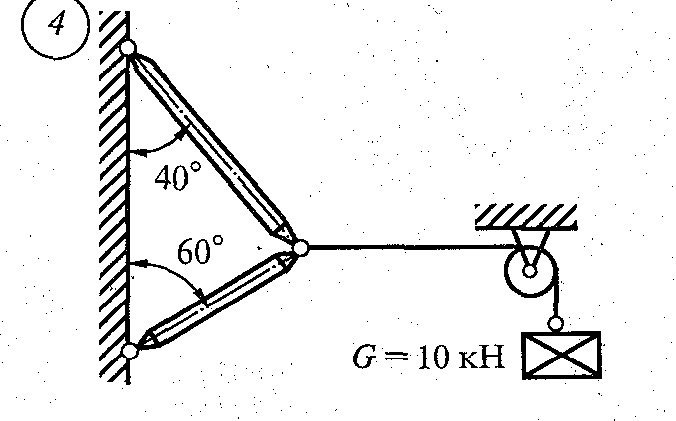 Электронные конфигурации благородных газов таковы, что их внешние оболочки полны. Полностью валентные электронные оболочки этих атомов делают благородные газы необычайно стабильными и маловероятными для образования химических связей, поскольку они не склонны приобретать или терять электроны.
Электронные конфигурации благородных газов таковы, что их внешние оболочки полны. Полностью валентные электронные оболочки этих атомов делают благородные газы необычайно стабильными и маловероятными для образования химических связей, поскольку они не склонны приобретать или терять электроны.
Ответ. Нет. Вещества, составляющие смесь, можно разделить физическими средствами, поскольку они обладают разными физическими свойствами и не связаны химически.
Ссылки
- Hyperphysics.phy-astr.gsu.edu
- Chem.libretexts.org
- Opentextbc.ca
- Insula.com.au
- Chem.ucla.edu
- Manoa.hawaii.edu
- Users.stlcc.edu
- Teaching.ncl.ac.uk
7.4: Энергия связи и химические реакции
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16108
- Анонимный
- LibreTexts
Цели обучения
Цели обучения этого модуля:
- Определить энергию связи .
- Рассчитать изменение энтальпии или теплоту реакции.
- Определите, является ли химический процесс экзотермическим или эндотермическим.
Что произойдет, если вы возьмете баскетбольный мяч, поставите его на полпути к детской горке, а затем отпустите? Баскетбольный мяч катится по горке. Что произойдет, если вы сделаете это снова? Баскетбольный мяч катится по горке? Должно.
Если бы вы повторяли этот эксперимент снова и снова, как вы думаете, выпал бы когда-нибудь баскетбольный мяч 9?0275 вверх
слайд? Возможно нет. Почему нет? Ну, для начала, по нашему опыту, баскетбол всегда перемещался на более низкую позицию, когда ему предоставлялась возможность. Гравитационное притяжение Земли воздействует на баскетбольный мяч, и, если есть шанс, баскетбольный мяч скатится вниз. Мы говорим, что баскетбольный мяч собирается с более низкой гравитационной потенциальной энергией . Баскетбольный мяч может двигаться вверх по горке, но только в том случае, если кто-то приложит к баскетбольному мячу некоторое усилие (то есть работу). Общее утверждение, основанное на бесчисленных наблюдениях за столетия исследований, заключается в том, что все объекты имеют тенденцию самопроизвольно перемещаться в положение с минимальной энергией, если на них не действует какая-либо другая сила или объект.
Общее утверждение, основанное на бесчисленных наблюдениях за столетия исследований, заключается в том, что все объекты имеют тенденцию самопроизвольно перемещаться в положение с минимальной энергией, если на них не действует какая-либо другая сила или объект.Bond Energy
Аналогичное утверждение можно сделать об атомах в соединениях. Атомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем те, которыми они обладают как отдельные атомы. Количество энергии, равное разности энергий связанных атомов и энергий разъединенных атомов, выделяется обычно в виде тепла. То есть связанные атомы имеют более низкую энергию, чем отдельные атомы.
Мы можем обратить процесс вспять, как и в случае с баскетбольным мячом. Если мы вложим энергию в молекулу, мы можем разорвать ее связи, разделив молекулу на отдельные атомы. Связи между определенными элементами обычно имеют характерную энергию, называемую энергией связи, которая необходима для разрыва связи. Такое же количество энергии было высвобождено, когда атомы образовали химическую связь. Срок энергия связи обычно используется для описания силы взаимодействия между атомами, образующими ковалентные связи. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Связь C=C прочнее, чем связь C-C (как обсуждалось относительно длины связи в разделе 4.4). Для атомов в ионных соединениях, притягиваемых противоположными зарядами, используется термин энергия решетки. Сейчас мы будем иметь дело с ковалентными связями в молекулах.
Если мы вложим энергию в молекулу, мы можем разорвать ее связи, разделив молекулу на отдельные атомы. Связи между определенными элементами обычно имеют характерную энергию, называемую энергией связи, которая необходима для разрыва связи. Такое же количество энергии было высвобождено, когда атомы образовали химическую связь. Срок энергия связи обычно используется для описания силы взаимодействия между атомами, образующими ковалентные связи. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Связь C=C прочнее, чем связь C-C (как обсуждалось относительно длины связи в разделе 4.4). Для атомов в ионных соединениях, притягиваемых противоположными зарядами, используется термин энергия решетки. Сейчас мы будем иметь дело с ковалентными связями в молекулах.
Хотя каждая молекула имеет свою характеристическую энергию связи, возможны некоторые обобщения. Например, хотя точное значение энергии связи С–Н зависит от конкретной молекулы, все связи С–Н имеют энергию связи примерно одинакового значения, поскольку все они являются связями С–Н. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. В таблице \(\PageIndex{1}\) приведены приблизительные энергии различных ковалентных связей.
Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. В таблице \(\PageIndex{1}\) приведены приблизительные энергии различных ковалентных связей.
| Бонд | Энергия связи (ккал/моль) |
|---|---|
| С–Н | 100 |
| С–О | 86 |
| С=О | 190 |
| C–N | 70 |
| С–С | 85 |
| С=С | 145 |
| К≡К | 200 |
| Н–Г | 93 |
| В–В | 105 |
| Бр-Бр | 46 |
| Cl–Cl | 58 |
| О–Н | 110 |
| О=О | 119 |
| H-Br | 87 |
| H–Cl | 103 |
Когда происходит химическая реакция, атомы в реагентах перестраивают свои химические связи с образованием продуктов. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Поэтому, когда происходят химические реакции, всегда будет сопутствующее изменение энергии . Изменение энтальпии для данной реакции можно рассчитать, используя значения энергии связи из таблицы \(\PageIndex{1}\).
Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Поэтому, когда происходят химические реакции, всегда будет сопутствующее изменение энергии . Изменение энтальпии для данной реакции можно рассчитать, используя значения энергии связи из таблицы \(\PageIndex{1}\).
Изменение энтальпии или теплоты реакции, Δ
HИзменения энергии в химических реакциях обычно измеряются как изменения энтальпии. В этом процессе к реакции добавляют энергию для разрыва связей и извлекают энергию для образующихся связей.
\[\text{изменение энтальпии} ≈ \sum (\text{разорванные связи}) — \sum (\text{образованные связи}) \nonumber \]
Знак ≈ используется, потому что мы суммируем средних энергий связи (т. е. по многим различным молекулам). Следовательно, этот подход не дает точных значений изменения энтальпии, Δ H .
Рассмотрим реакцию 2 молей газообразного водорода (H 2 ) с 1 моль газообразного кислорода (O 2 ) с образованием 2 молей воды:
\[\ce{2H_2(g) + O_2( g) \rightarrow 2H_2O(g)} \nonumber \]
или показано графически:
с этими средними энергиями связи:
- \(\ce{H–H}\) = 105 ккал/моль
- \(\ce{O=O}\) = 119 ккал/моль
- \(\ce{O–H}\) = 110 ккал/моль
В этой реакции разрываются 2 связи Н–Н и 1 связь О=О, при этом образуются 4 связи О–Н (по две на каждую Н 2 О). Изменения энергии можно свести в таблицу и рассчитать следующим образом:
Изменения энергии можно свести в таблицу и рассчитать следующим образом:
| Разорванные связи (ккал/моль) | Образовавшиеся связи (ккал/моль) | ||
|---|---|---|---|
| 2 H–H | 2 моль x 105 ккал/моль = 210 ккал | 4 О–Н | 4 моля x 110 ккал/моль = 440 ккал |
| 1 О=О | 1 моль x 119 ккал/моль = 119 ккал | ||
| Итого = 329 ккал | Итого = 440 ккал | ||
\[\begin{align*} \Delta H &≈ \sum (\text{разорванные связи}) — \sum (\text{образованные связи}) \\[4pt] &≈ 329 \: \text {ккал} — 440 \: \text{ккал} \\[4pt] &≈ −111 \: \text{ккал} \end{align*} \nonumber \]
Изменение энтальпии (ΔH) реакции равно приблизительно -111 ккал/моль. Это означает, что связи в продуктах (440 ккал) сильнее, чем связи в реагентах (329 ккал).ккал) примерно на 111 ккал/моль. Поскольку связи в продуктах сильнее, чем в реагентах, реакция высвобождает больше энергии, чем потребляет. Эта избыточная энергия высвобождается в виде тепла, поэтому реакция экзотермическая . Следовательно, мы можем переписать реакцию с выделением тепла (111 ккал) на стороне продукта уравнения следующим образом:
Это означает, что связи в продуктах (440 ккал) сильнее, чем связи в реагентах (329 ккал).ккал) примерно на 111 ккал/моль. Поскольку связи в продуктах сильнее, чем в реагентах, реакция высвобождает больше энергии, чем потребляет. Эта избыточная энергия высвобождается в виде тепла, поэтому реакция экзотермическая . Следовательно, мы можем переписать реакцию с выделением тепла (111 ккал) на стороне продукта уравнения следующим образом:
Мы также можем переписать уравнение реакции с информацией ΔH (см. ниже ). Обратите внимание, что экзотермическая реакция имеет отрицательное значение ΔH .
\[\ce{2H_2(g)+O_2(g) \rightarrow 2H_2O(g)} \ \: \: \: \: \: \Delta H = -111 \: \text{kcal} \nonumber \ ]
Пример \(\PageIndex{1}\)
Каково изменение энтальпии этой реакции? Является ли реакция экзотермической или эндотермической?
\[\ce{H_2(g) + Br_2(g) \rightarrow 2HBr(g)} \nonumber \]
Решение
Шаг 1- Сначала посмотрите на уравнение и определите, какие связи существуют в реагентах ( связи разорваны).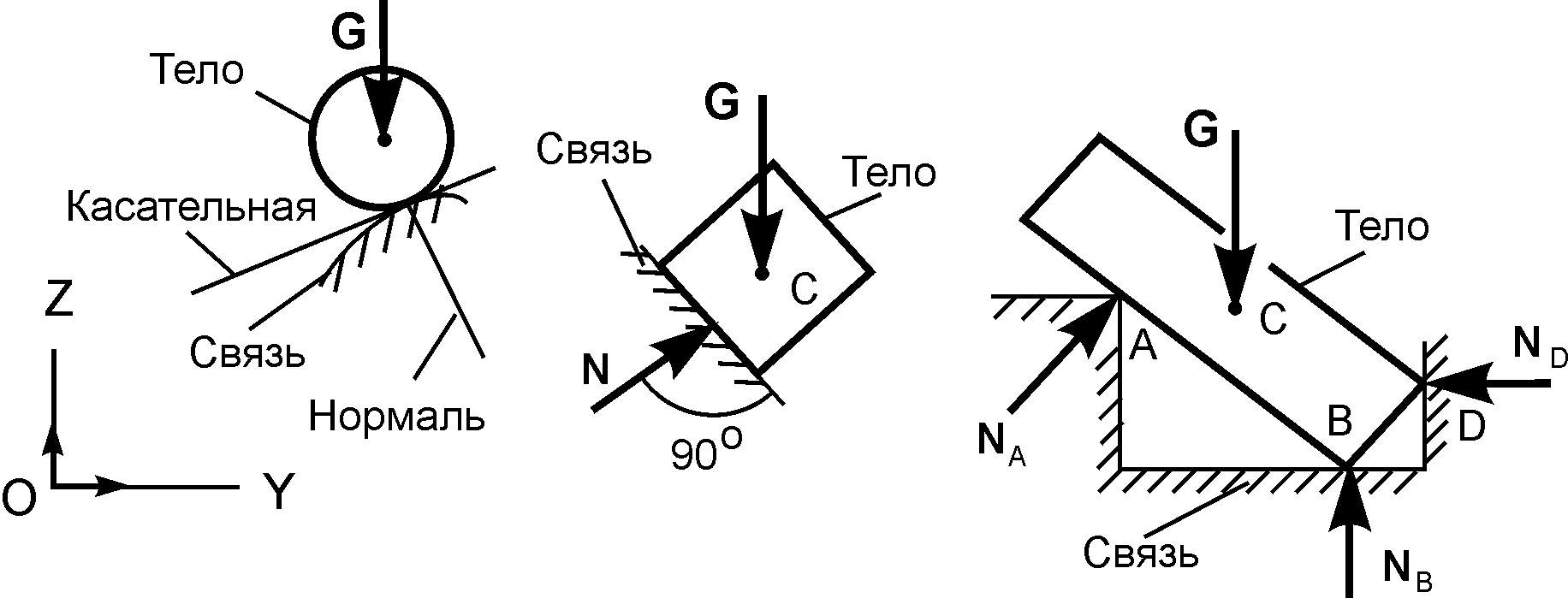
- одна связь H-H и
- одна связка Br-Br
Шаг 2. Сделайте то же самое для продуктов (образованных связей)
- две связи H-Br
Шаг 3. Определите энергии этих связей по таблице \(\PageIndex{1}\):
- H-H связи: 105 ккал/моль
- Связи Br-Br: 46 ккал/моль
Шаг 4. Составьте таблицу (см. ниже) и примените формулу изменения энтальпии.
| Разорванные связи (ккал/моль) | Образовавшиеся связи (ккал/моль) | ||
|---|---|---|---|
| 1 H–H | 1 моль x 105 ккал/моль = 105 ккал | 2 Н– Бр | 2 моля x 87 ккал/моль = 174 ккал |
| 1 Бр–Бр | 1 моль x 46 ккал/моль = 46 ккал | ||
| Итого = 151 ккал | Итого = 174 ккал | ||
\[\begin{align*} \Delta H &≈ 151 \: \text{ккал} — 174 \: \text{ккал} \\[4pt] &≈ −23 \: \text{ккал} \end{align*} \nonumber \]
Шаг 5. Поскольку \(ΔH\) отрицательное значение (-23 ккал), реакция экзотермическая .
Поскольку \(ΔH\) отрицательное значение (-23 ккал), реакция экзотермическая .
Упражнение \(\PageIndex{1}\)
Используя энергию связи, приведенную в таблице выше, найдите изменение энтальпии при термическом разложении воды:
\[\ce{H_2(g) + Cl_2(g) \rightarrow 2HCl(g)} \nonumber \]
Является ли описанная выше реакция экзотермической или эндотермической? Объяснять.
- Ответить
ΔH = −43 ккал
Поскольку ΔH отрицательно (-43 ккал), реакция является экзотермической .
Эндотермические и экзотермические реакции
Эндотермические и экзотермические реакции можно рассматривать как имеющие энергию либо в качестве реагента реакции, либо в качестве продукта. Эндотермические реакции требуют энергии, поэтому энергия является реагентом. Тепло из окружающей среды перетекает в систему (реакционную смесь), и энтальпия системы увеличивается (Δ H положительно). Как обсуждалось в предыдущем разделе, в экзотермической реакции выделяется тепло (которое считается продуктом) и энтальпия системы уменьшается (Δ H отрицательный).
Как обсуждалось в предыдущем разделе, в экзотермической реакции выделяется тепло (которое считается продуктом) и энтальпия системы уменьшается (Δ H отрицательный).
В ходе эндотермического процесса система получает тепло из окружающей среды, и поэтому температура окружающей среды снижается (остывает). Химическая реакция является экзотермической , если тепло выделяется системой в окружающую среду. Поскольку окружающая среда получает тепло от системы, температура окружающей среды повышается. См. рисунок \(\PageIndex{1}\).
Рисунок \(\PageIndex{1}\): (A) Эндотермическая реакция. (B) Экзотермическая реакция. Эндотермическая реакция: окружающая среда становится холоднее и дельта H больше 0. Экзотермическая реакция: окружающая среда нагревается и дельта H меньше 0,9.0012 Эндотермическая реакция : Когда \(1 \: \text{моль}\) карбоната кальция разлагается на \(1 \: \text{моль}\) оксида кальция и \(1 \: \text{моль} \) углекислого газа, поглощается \(177,8 \: \text{кДж}\) тепла. Поскольку тепло поглощается системой, \(177,8 \: \text{кДж}\) записывается как реагентов . Δ H является положительным для эндотермической реакции.
Поскольку тепло поглощается системой, \(177,8 \: \text{кДж}\) записывается как реагентов . Δ H является положительным для эндотермической реакции.\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \ : \: \: \Delta H = +177,8 \: \text{kJ} \nonumber \]
Экзотермическая реакция : При сгорании газообразного метана выделяется тепло, что делает реакцию экзотермической. В частности, при сгорании \(1 \: \text{моль}\) метана выделяется 890,4 кДж тепловой энергии. Эта информация может быть представлена как часть сбалансированного уравнения двумя способами. Во-первых, количество выделившейся теплоты может быть записано в сторону продукта реакции. Другой способ — записать теплоту реакции (Δ H ) информация с отрицательным знаком , \(-890,4 \: \text{kJ}\).
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce {H_2O} \left( l \right) \: \: \: \: \: \Delta H = -890,4 \: \text{kJ} \nonumber \]
Пример \(\PageIndex{2}\)
Является ли каждая химическая реакция экзотермической или эндотермической?
- CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O(ℓ) + 213 ккал
- N 2 (г) + O 2 (г) + 45 ккал → 2NO(г)
Раствор
- Поскольку энергия (213 ккал) является продуктом, энергия выделяется в результате реакции. Следовательно, эта реакция является экзотермической.
- Поскольку энергия (45 ккал) является реагентом, энергия поглощается реакцией. Следовательно, эта реакция эндотермическая.
Упражнение \(\PageIndex{2}\)
Является ли каждая химическая реакция экзотермической или эндотермической?
- H 2 (г) + F 2 (г) → 2HF (г) + 130 ккал
- 2C(т) + H 2 (г) + 5,3 ккал → C 2 H 2 (г)
- Ответить
а.
 Производится энергия (130 ккал), следовательно, реакция экзотермическая
Производится энергия (130 ккал), следовательно, реакция экзотермическаяб. Энергия (5,3 ккал) передается или поглощается для реакции, следовательно, реакция является эндотермической
Энергетические диаграммы
Эндотермические и экзотермические реакции могут быть визуально представлены с помощью диаграммы уровней энергии такие же, как в Рисунок \(\PageIndex{2}\) . В эндотермических реакциях реагенты имеют более высокую энергию связи (более прочные связи), чем продукты. Сильные связи имеют более низкую потенциальную энергию, чем слабые связи . Следовательно, энергия реагентов ниже, чем у продуктов . Этот тип реакции представлен восходящей диаграммой энергетических уровней, показанной на рисунке \(\PageIndex{2A}\). Чтобы протекала эндотермическая химическая реакция, реагенты должны поглощать энергию из окружающей среды, чтобы превратиться в продукты.
В экзотермической реакции связи в продукте имеют более высокую энергию связи (более прочные связи), чем реагенты. Другими словами, энергия продуктов ниже, чем энергия реагентов, следовательно, энергетически нисходящая, как показано на рисунке \(\PageIndex{2B}\). Энергия выделяется при превращении реагентов в продукты. Выделяемая энергия обычно имеет форму тепла (хотя в некоторых реакциях энергия выделяется в виде света). В ходе экзотермической реакции тепло переходит из системы в окружающую среду и, таким образом, нагревается.
Другими словами, энергия продуктов ниже, чем энергия реагентов, следовательно, энергетически нисходящая, как показано на рисунке \(\PageIndex{2B}\). Энергия выделяется при превращении реагентов в продукты. Выделяемая энергия обычно имеет форму тепла (хотя в некоторых реакциях энергия выделяется в виде света). В ходе экзотермической реакции тепло переходит из системы в окружающую среду и, таким образом, нагревается.
| Эндотермические реакции | Экзотермические реакции |
|---|---|
| Тепло поглощается реагентами с образованием продуктов. | Тепло выделяется. |
| Тепло поглощается из окружающей среды; в результате все вокруг становится холодным. | При реакции на окружающую среду выделяется тепло; вокруг жарко. |
| Δ H rxn положительный | Δ H rxn отрицательный |
| Связи, разорванные в реагентах, прочнее, чем связи, образованные в продуктах | Связи, образующиеся в продуктах, прочнее, чем связи, разорванные в реагентах |
| Энергия реагентов ниже, чем у продуктов | Энергетическая ценность продуктов ниже, чем у реагентов |
| Представлено энергетической диаграммой «в гору» | Представлено энергетической диаграммой «спуск» |
Ключевые выводы
- Атомы удерживаются вместе за счет определенного количества энергии, называемой энергией связи.

- Для разрыва связей требуется энергия. Энергия высвобождается при образовании химических связей, потому что атомы становятся более устойчивыми.
- Химические процессы обозначаются как экзотермические или эндотермические в зависимости от того, выделяют они энергию или поглощают ее соответственно.
Эта страница под названием 7.4: Энергии связи и химические реакции распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Anonymous с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами LibreTexts. Платформа; подробная история редактирования доступна по запросу.
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу Содержание
- нет на странице
- Теги
- энергия связи
- source@https://2012books.

