Поташ — это… Формула и применение поташа
Поташ — это… Формула и применение поташа
Калий — неофициальное название вещества, которое химики называют карбонатом калия. Эта соль была известна людям с древних времен, поскольку она содержится в золе. Раньше этим словом называли именно сухой остаток после испарения раствора продуктов сгорания растений. Итак, что сейчас известно о калии?
Содержание
- 1 Формула
- 2 История открытия и изучения
- 3 Химические и физические свойства
- 4 Разновидности и формы
- 5 Добыча
- 6 Обработка
- 7 Использование
- 8 Другие особенности
Формула
Другое название этого вещества — карбонат калия. И его химическая формула записывается так: K2CO3. Это средняя соль калия и угольной кислоты. Это означает, что раствор калия не является кислым или основным, он нейтрален. Его долгое время путали с бикарбонатом натрия — NaHCO3.
Это средняя соль калия и угольной кислоты. Это означает, что раствор калия не является кислым или основным, он нейтрален. Его долгое время путали с бикарбонатом натрия — NaHCO3.
История открытия и изучения
Конечно, мы не знаем наверняка, кто первым получил калий, потому что он был известен еще в Древней Греции и Риме. Затем его отделили от золы и использовали для промывки. Любопытно, что его долгое время путали с другим веществом — бикарбонатом калия. Есть знакомые бикарбонат натрия, калий — вместе их называли просто щелочными или щелочными солями. Они начали выделяться в 18-19 веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, а поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Первые известия о производстве калия относятся к XIV веку. Самое крупное из предприятий располагалось в Германии и Скандинавских странах. Карбонат калия использовался на мыловаренных заводах, в текстильной промышленности, в химчистках. В 15 веке к конкурсу присоединилась и Россия. До этого не умели отделить калий от золы, а просто вывозили продукты горения вместе, например, с мехами. Стекольная промышленность как внутри России, так и за рубежом тоже нуждалась в этом веществе. Спрос вырос, как и предложение.
В 15 веке к конкурсу присоединилась и Россия. До этого не умели отделить калий от золы, а просто вывозили продукты горения вместе, например, с мехами. Стекольная промышленность как внутри России, так и за рубежом тоже нуждалась в этом веществе. Спрос вырос, как и предложение.
Кстати, само название «поташ» буквально является ключом к разгадке того, как его получали в древности. Дело в том, что на латыни это звучит как поташ, который, в свою очередь, представляет собой сплав слов «ясень» и «горшок».
Химические и физические свойства
В ходе экспериментов с этим веществом ученые получили информацию о некоторых присущих ему качествах. Сегодня известно, что в нормальных условиях чистый калий представляет собой твердое вещество в виде бесцветных кристаллов или белого порошка. Его плотность 2,43 г / см3. Температура плавления карбоната калия составляет 891 градус Цельсия. Высокая гигроскопичность.
Это вещество не взрывоопасно и не воспламеняется. Вызывает раздражение при контакте с кожей или влажными слизистыми оболочками.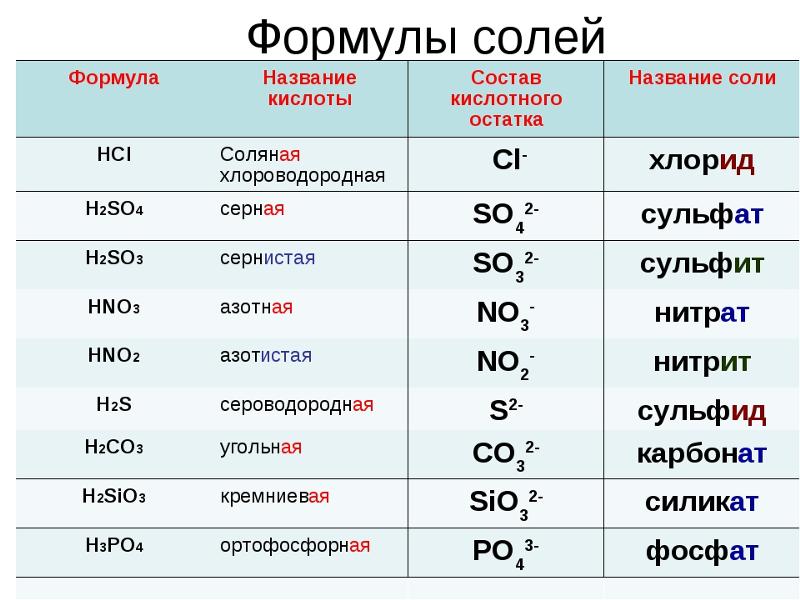 Поэтому его относят к третьему классу опасности.
Поэтому его относят к третьему классу опасности.
Разновидности и формы
Есть два типа калия: кальцинированный и полуторный водяной. В отличие от второй, первая форма не содержит воды — в процессе прокаливания она испаряется и удаляется органическое вещество, в результате чего раствор карбоната калия этого типа становится полностью бесцветным.
Кроме того, калий тоже различают разновидностями, их всего три. Качество конечного продукта зависит от содержания примесей, таких как железо, алюминий, хлориды, соли и сульфаты натрия. Кроме того, при присвоении марки учитывается массовая доля осадка, выпавшего в растворе, и потери при прокаливании.
Добыча
Хотя использование калия не происходит в таких масштабах, как в случае с содой, люди по-прежнему активно его используют. Но прежде всего его нужно получить. В небольших количествах это можно делать и в домашних условиях.
В первую очередь нужно сделать доступной вам золу растения. Затем нужно растворить его в определенном количестве горячей воды, хорошо перемешать и немного подождать. Далее нужно приступить к выпариванию раствора калия со смесью органических веществ, в результате чего выпадут кристаллы. Конечно, выделенный таким образом карбонат калия не будет высокого качества, и затраченные усилия будут слишком велики по отношению к количеству. Очевидно, что в промышленных масштабах все иначе.
Далее нужно приступить к выпариванию раствора калия со смесью органических веществ, в результате чего выпадут кристаллы. Конечно, выделенный таким образом карбонат калия не будет высокого качества, и затраченные усилия будут слишком велики по отношению к количеству. Очевидно, что в промышленных масштабах все иначе.
Следовательно, водный раствор карбоната калия взаимодействует с CO2, что приводит к образованию KHCO3. В свою очередь, он нагревается, и выделяются вода и углекислый газ, а остальное — оригинальный калий.
Есть много других способов получить это вещество, но самые простые и эффективные из них описаны выше.
Обработка
Как уже было сказано, существует два вида калия: кальцинированный и полуторный водный. Как карбонат калия обрабатывается для получения определенного сорта?
Во-первых, различаются и их формулы. Полувода выглядит так: K2CO3 + 1.5h3O, то есть изначально содержит воду. Однако он даже более гигроскопичен, чем обычно. Из этой формы можно получить и безводную форму — достаточно нагреть порошок до 130-160 градусов Цельсия.
Кальцинированная форма получается при переработке карбоната калия, полученного выпариванием зольного раствора в деревянных чанах. Такого вещества нет он отличается чистотой, поэтому его необходимо прокаливать или прокаливать. После выполнения одной из этих процедур порошок карбоната калия оказывается белого цвета, а его раствор совершенно бесцветным. В этом случае вещество не содержит воды.
Использование
На сегодняшний день калий в различных формах используется в огромном количестве отраслей и для самых разных целей. Например, его превосходная очищающая способность до сих пор используется при производстве жидкого мыла и другой бытовой химии.
Кроме того, калий является антифризной добавкой для строительных растворов. Таким образом, это позволяет смеси быть более устойчивыми к холоду, что позволяет продолжать строительство даже при довольно низких температурах. Его существенное преимущество перед аналогами в том, что он не вызывает коррозии конструкций, а также образования высолов, которые могли сказываются на прочности конструкции.
Карбонат калия по-прежнему используется в высококачественном хрустальном и оптическом стекле. В этом вопросе ему нет замены. Аналогов этому веществу нет, например, при производстве тугоплавкого стекла.
Калий часто входит в состав красок, а в химической промышленности он также используется для поглощения сероводорода из газовых смесей — он справляется с этим намного лучше, чем сода. Этому есть место в фармацевтике: карбонат калия участвует в некоторых реакциях, а местами проявляется как побочное действие. Еще одна область применения — пожаротушение. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Удивительно, но калий также является пищевой добавкой. Его код E501, поэтому он относится к классу E. Некоторое время его использовали в кондитерских изделиях, например, при производстве имбирных пряников. В легкой промышленности это вещество также участвует в процессе одевания кожи.
Наконец, есть большие перспективы использования калия в производстве безхлорных калийных удобрений.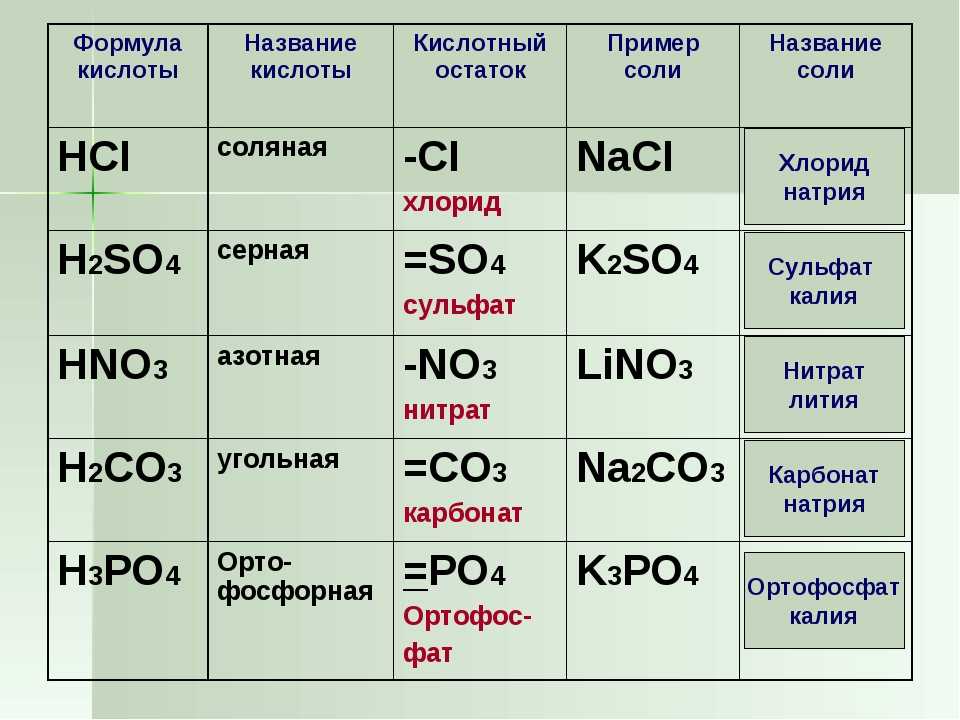 Зола использовалась в этом качестве долгое время, но в последние десятилетия ее вытеснили промышленные корма. Вероятно, в ближайшем будущем широко известный метод получит широкое распространение и будет наименее вредным по сравнению с используемыми сейчас минеральными удобрениями.
Зола использовалась в этом качестве долгое время, но в последние десятилетия ее вытеснили промышленные корма. Вероятно, в ближайшем будущем широко известный метод получит широкое распространение и будет наименее вредным по сравнению с используемыми сейчас минеральными удобрениями.
Другие особенности
Поскольку калий является чрезвычайно гигроскопичным веществом, его упаковка, хранение и транспортировка проходят в особых условиях. Обычно для упаковки карбоната калия используются пятислойные пакеты. Это единственный способ избежать нежелательного попадания воды в это вещество.
Также неожиданно, несмотря на отличную реакцию с h3O, карбонат калия полностью нерастворим в ацетоне и этаноле.
Поделиться:
- Предыдущая записьВал — это что такое? Значение, происхождение, синонимы
- Следующая записьСажень — это сколько? Сколько саженей в метре и версте
×
Рекомендуем посмотреть
Adblock
detector
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Калий углекислый (поташ, карбонат калия) — средняя соль калия и угольной кислоты. Представляет собой белый или светло-серый порошок, обладающий щелочными свойствами и хорошо растворимый в воде. Представляет собой белый или светло-серый порошок, обладающий щелочными свойствами и хорошо растворимый в воде.Температура плавления 891° C. Коэффициент растворимости (в г на 100г воды) равен 111,0 при 20 °C и 139,2 при 80 °C, плотность — 2,428 г/см³. Химическая формула: K2CO3 Применение поташа. Зарегистрирован в качестве пищевой добавки E501. Физико-химические показатели калия углекислого технического ГОСТ 10690-73:
 1-7 даны в пересчете на прокаленное вещество. 1-7 даны в пересчете на прокаленное вещество.Требования безопасности калия углекислого технического ГОСТ 10690-73:
Упаковка, транспортировка и хранение. Продукт, упакованный в мягкие специализированные контейнеры разового использования, транспортируют на открытом подвижном составе повагонными отправками без перегрузок в пути следования.  По согласованию с потребителем неупакованный углекислый калий допускается транспортировать в специальных вагонах типа «хоппер». Углекислый калий хранят в закрытых складских помещениях, предохраняя продукт от попадания влаги. Гарантийный срок хранения продукта — 3 месяца со дня изготовления. ООО “ФАСТЕХ” осуществляет поставки химической продукции со склада в Белгороде в сроки и по доступным ценам, на выгодных для Вас условиях. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
это… Формула и применение поташа
Поташ — это неофициальное название вещества, которое химики называют карбонатом калия. Эта соль известна людям с древнейших времен, поскольку она содержится в золе. Раньше этим словом называли именно сухой остаток после выпаривание раствора продуктов сгорания растений. Итак, что же сейчас известно про поташ?
Формула
Еще одно название этого вещества — углекислый калий. И его химическая формула записывается так — K2CO3. Он представляет собой среднюю соль калия и угольной кислоты. Это значит, что раствор поташа не является кислотным или основным, он нейтральный. Долгое время его путали с пищевой содой — NaHCO3.
Он представляет собой среднюю соль калия и угольной кислоты. Это значит, что раствор поташа не является кислотным или основным, он нейтральный. Долгое время его путали с пищевой содой — NaHCO3.
История открытия и изучения
Разумеется, доподлинно мы не знаем, кто первым получил поташ, ведь он был известен еще в Древней Греции и Риме. Тогда его выделяли из золы и использовали для стирки. Любопытно, что долгое время его путали с другим веществом — гидрокарбонатом калия. Знакомая нам пищевая сода, поташ — вместе их именовали просто алкалическими или щелочными солями. Различать их начали в XVIII-XIX веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, в то время как поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Первые упоминания о производстве поташа относятся к XIV веку. Наиболее крупные из предприятий находились в Германии и скандинавских странах. Карбонат калия использовался в мыловарнях, суконной промышленности, красильных предприятиях. В XV веке в конкуренцию включилась и Россия. До этого выделять поташ из золы не умели, а просто экспортировали продукты горения наряду с, например, мехами. Стекольная промышленность как внутри России, так и за границей тоже нуждалась в этом веществе. Спрос рос, а с ним росло и предложение.
Карбонат калия использовался в мыловарнях, суконной промышленности, красильных предприятиях. В XV веке в конкуренцию включилась и Россия. До этого выделять поташ из золы не умели, а просто экспортировали продукты горения наряду с, например, мехами. Стекольная промышленность как внутри России, так и за границей тоже нуждалась в этом веществе. Спрос рос, а с ним росло и предложение.
Кстати, само название «поташ» — это буквально подсказка способа его получения в древности. Дело в том, что в латыни оно звучит как potassa, что в свою очередь является слиянием слов «зола» и «горшок».
Химические и физические свойства
В ходе проведения экспериментов с этим веществом ученые получали информацию о тех или иных качествах, присущих ему. На сегодняшний день известно, что при нормальных условиях чистый поташ — это твердое вещество в виде бесцветных кристаллов или белого порошка. Его плотность — 2,43 г/см3. Температура плавления карбоната калия — 891 градус Цельсия. Обладает высокой гигроскопичностью.
Обладает высокой гигроскопичностью.
Это вещество не является взрыво- или пожароопасным. При попадании на влажную кожу или слизистую вызывает раздражение. Таким образом, его относят к третьему классу опасности.
Разновидности и формы
Различают два вида поташа: кальцинированный и полутораводный. В отличие от второго, первая форма не содержит воду — в процессе кальцинирования она
испаряется, а также удаляются органические вещества, в результате раствор карбоната калия такого вида становится совершенно бесцветным.
Кроме того, различают поташ и по сортам, выделяют всего три. Качество конечного продукта зависит от содержания таких примесей, как железо, алюминий, хлориды, натрий и сернокислые соли. Также при присвоении сорта учитывается массовая доля выпавшего в растворе осадка и потери при прокаливании.
Добыча
Хотя применение поташа происходит не в таких огромных масштабах, как в случае с содой, он до сих пор активно используется людьми. Но прежде всего его нужно получить. В небольших количествах сделать это можно даже дома.
Но прежде всего его нужно получить. В небольших количествах сделать это можно даже дома.
Прежде всего необходимо получить в свое распоряжение золу растительного происхождения. Затем нужно растворить ее в некотором количестве горячей воды, хорошенько размешав и подождав некоторое время. Далее нужно начать выпаривать раствор поташа со смесью органических веществ, что вызовет выпадение кристаллов. Разумеется, карбонат калия, выделенный подобным способом, не будет отличаться высоким качеством, да и потраченные усилия слишком велики в сравнении с количеством. Так что, разумеется, в промышленным масштабах все происходит иначе.
Итак, водный раствор карбоната калия взаимодействует с CO2, что приводит к образованию KHCO3. Его, в свою очередь, нагревают, и происходит выделение воды и диоксида углерода, в остатке же — изначальный поташ.
Существует еще несколько способов получения этого вещества, однако самыми простыми и эффективными являются те, что описаны ранее.
Обработка
Как уже было упомянуто, различают два вида поташа — кальцинированный и полутораводный. Каким же образом происходит обработка карбоната калия для получения той или иной разновидности?
Прежде всего, различаются даже их формулы. Полутораводный выглядит так: K2CO3+1,5H2O, то есть он содержит воду изначально. Тем не менее, он даже более гигроскопичен, чем обычный. Из этой формы можно получить и безводную форму — достаточно нагреть порошок до 130-160 градусов по Цельсию.
Кальцинированная форма получается при обработке карбоната калия, полученного с помощью выпаривания раствора золы в деревянных чанах. Такое вещество не
отличается чистотой, так что его приходится либо прокаливать, либо кальцинировать. После проведения одной из этих процедур порошок карбоната калия получается белым, а его раствор — совершенно бесцветным. В этом случае вещество не содержит воды.
Использование
С давних пор и по сей день карбонат калия в разных видах применяется в огромном количестве отраслей и с самыми разными целями. Например, его прекрасная способность к очищению до сих пор используется при изготовлении жидкого мыла и другой бытовой химии.
Например, его прекрасная способность к очищению до сих пор используется при изготовлении жидкого мыла и другой бытовой химии.
Кроме того, поташ — противоморозная добавка к строительным растворам. В этом качестве он позволяет смесям быть более устойчивыми к холоду, что дает возможность продолжать строительство даже при довольно низких температурах. Его значительное преимущество перед аналогами состоит в том, что он не вызывает коррозии конструкций, а также образования высолов, которые могли бы
повлиять на прочность сооружения.
Все еще используется карбонат калия при изготовлении хрусталя и стекла для высококачественной оптики. Замены ему в этом деле нет. Не существует и никаких аналогов этого вещества, например, при изготовлении тугоплавкого стекла.
Часто поташ — это компонент красок, также в химической промышленности он используется для поглощения сероводорода из газовых смесей — с этим он справляется гораздо лучше соды. Есть ему место и в фармацевтике: карбонат калия участвует в некоторых реакциях, а кое-где появляется в качестве побочного результата. Еще одна область применения — пожарное дело. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Еще одна область применения — пожарное дело. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Как ни удивительно, но поташ — это еще и пищевая добавка. Его код — Е501, так что он относится к классу Е. Какое-то время он использовался в кондитерском деле, например, при изготовлении пряников. В легкой промышленности это вещество также участвует в процессе выделки кож.
Наконец, высоки перспективы применения поташа в изготовлении бесхлорных калийных удобрений. Зола в этом качестве применялась издавна, но в последние десятилетия ее вытеснили подкормки промышленного изготовления. Вероятно, в ближайшее время в широких масштабах будет применяться способ, известный давно и являющийся наименее вредным в сравнении с минеральными удобрениями, применяемыми сейчас.
Другие особенности
Поскольку поташ — крайне гигроскопичное вещество, его упаковка, хранение и транспортировка проходят в специальных условиях. Как правило, для фасовки карбоната калия используются пятислойные мешки. Только так можно избежать нежелательного попадания воды в это вещество.
Только так можно избежать нежелательного попадания воды в это вещество.
Кроме того, как ни удивительно, несмотря на прекрасную реакцию с H2O, карбонат калия совершенно не растворяется ацетоном и этанолом.
Поташ. Формула и применение поташа
Поташ — это неофициальное название вещества, которое химики называют карбонатом калия. Эта соль известна людям с древнейших времен, поскольку она содержится в золе. Раньше этим словом называли именно сухой остаток после выпаривание раствора продуктов сгорания растений. Итак, что же сейчас известно про поташ?
Формула
Еще одно название этого вещества — углекислый калий. И его химическая формула записывается так — K2CO3. Он представляет собой среднюю соль калия и угольной кислоты. Это значит, что раствор поташа не является кислотным или основным, он нейтральный. Долгое время его путали с пищевой содой — NaHCO3.
История открытия и изучения
Разумеется, доподлинно мы не знаем, кто первым получил поташ, ведь он был известен еще в Древней Греции и Риме. Тогда его выделяли из золы и использовали для стирки. Любопытно, что долгое время его путали с другим веществом — гидрокарбонатом калия. Знакомая нам пищевая сода, поташ — вместе их именовали просто алкалическими или щелочными солями. Различать их начали в XVIII-XIX веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, в то время как поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Тогда его выделяли из золы и использовали для стирки. Любопытно, что долгое время его путали с другим веществом — гидрокарбонатом калия. Знакомая нам пищевая сода, поташ — вместе их именовали просто алкалическими или щелочными солями. Различать их начали в XVIII-XIX веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, в то время как поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Первые упоминания о производстве поташа относятся к XIV веку. Наиболее крупные из предприятий находились в Германии и скандинавских странах. Карбонат калия использовался в мыловарнях, суконной промышленности, красильных предприятиях. В XV веке в конкуренцию включилась и Россия. До этого выделять поташ из золы не умели, а просто экспортировали продукты горения наряду с, например, мехами. Стекольная промышленность как внутри России, так и за границей тоже нуждалась в этом веществе. Спрос рос, а с ним росло и предложение.
Кстати, само название «поташ» — это буквально подсказка способа его получения в древности. Дело в том, что в латыни оно звучит как potassa, что в свою очередь является слиянием слов «зола» и «горшок».
Противоморозные добавки в раствор для кладки. Виды, расход,…
Зима – не лучшее время для начала строительства. Особенно проблематичной задачей оказывается…
Химические и физические свойства
В ходе проведения экспериментов с этим веществом ученые получали информацию о тех или иных качествах, присущих ему. На сегодняшний день известно, что при нормальных условиях чистый поташ — это твердое вещество в виде бесцветных кристаллов или белого порошка. Его плотность — 2,43 г/см3. Температура плавления карбоната калия — 891 градус Цельсия. Обладает высокой гигроскопичностью.
Это вещество не является взрыво- или пожароопасным. При попадании на влажную кожу или слизистую вызывает раздражение. Таким образом, его относят к третьему классу опасности.
Разновидности и формы
Различают два вида поташа: кальцинированный и полутораводный. В отличие от второго, первая форма не содержит воду — в процессе кальцинирования она испаряется, а также удаляются органические вещества, в результате раствор карбоната калия такого вида становится совершенно бесцветным.
Кроме того, различают поташ и по сортам, выделяют всего три. Качество конечного продукта зависит от содержания таких примесей, как железо, алюминий, хлориды, натрий и сернокислые соли. Также при присвоении сорта учитывается массовая доля выпавшего в растворе осадка и потери при прокаливании.
Силикат калия и жидкое стекло — что общего?
Жидкое стекло, канцелярский клей – материалы, хорошо нам известные, так как в быту они имеют…
Добыча
Хотя применение поташа происходит не в таких огромных масштабах, как в случае с содой, он до сих пор активно используется людьми. Но прежде всего его нужно получить. В небольших количествах сделать это можно даже дома.
Прежде всего необходимо получить в свое распоряжение золу растительного происхождения. Затем нужно растворить ее в некотором количестве горячей воды, хорошенько размешав и подождав некоторое время. Далее нужно начать выпаривать раствор поташа со смесью органических веществ, что вызовет выпадение кристаллов. Разумеется, карбонат калия, выделенный подобным способом, не будет отличаться высоким качеством, да и потраченные усилия слишком велики в сравнении с количеством. Так что, разумеется, в промышленным масштабах все происходит иначе.
Итак, водный раствор карбоната калия взаимодействует с CO2, что приводит к образованию KHCO3. Его, в свою очередь, нагревают, и происходит выделение воды и диоксида углерода, в остатке же — изначальный поташ.
Существует еще несколько способов получения этого вещества, однако самыми простыми и эффективными являются те, что описаны ранее.
Обработка
Как уже было упомянуто, различают два вида поташа — кальцинированный и полутораводный. Каким же образом происходит обработка карбоната калия для получения той или иной разновидности?
Каким же образом происходит обработка карбоната калия для получения той или иной разновидности?
Прежде всего, различаются даже их формулы. Полутораводный выглядит так: K2CO3+1,5H2O, то есть он содержит воду изначально. Тем не менее, он даже более гигроскопичен, чем обычный. Из этой формы можно получить и безводную форму — достаточно нагреть порошок до 130-160 градусов по Цельсию.
Кальцинированная форма получается при обработке карбоната калия, полученного с помощью выпаривания раствора золы в деревянных чанах. Такое вещество не отличается чистотой, так что его приходится либо прокаливать, либо кальцинировать. После проведения одной из этих процедур порошок карбоната калия получается белым, а его раствор — совершенно бесцветным. В этом случае вещество не содержит воды.
Использование
С давних пор и по сей день карбонат калия в разных видах применяется в огромном количестве отраслей и с самыми разными целями. Например, его прекрасная способность к очищению до сих пор используется при изготовлении жидкого мыла и другой бытовой химии.
Кроме того, поташ — противоморозная добавка к строительным растворам. В этом качестве он позволяет смесям быть более устойчивыми к холоду, что дает возможность продолжать строительство даже при довольно низких температурах. Его значительное преимущество перед аналогами состоит в том, что он не вызывает коррозии конструкций, а также образования высолов, которые могли бы повлиять на прочность сооружения.
Все еще используется карбонат калия при изготовлении хрусталя и стекла для высококачественной оптики. Замены ему в этом деле нет. Не существует и никаких аналогов этого вещества, например, при изготовлении тугоплавкого стекла.
Часто поташ — это компонент красок, также в химической промышленности он используется для поглощения сероводорода из газовых смесей — с этим он справляется гораздо лучше соды. Есть ему место и в фармацевтике: карбонат калия участвует в некоторых реакциях, а кое-где появляется в качестве побочного результата. Еще одна область применения — пожарное дело. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Как ни удивительно, но поташ — это еще и пищевая добавка. Его код — Е501, так что он относится к классу Е. Какое-то время он использовался в кондитерском деле, например, при изготовлении пряников. В легкой промышленности это вещество также участвует в процессе выделки кож.
Наконец, высоки перспективы применения поташа в изготовлении бесхлорных калийных удобрений. Зола в этом качестве применялась издавна, но в последние десятилетия ее вытеснили подкормки промышленного изготовления. Вероятно, в ближайшее время в широких масштабах будет применяться способ, известный давно и являющийся наименее вредным в сравнении с минеральными удобрениями, применяемыми сейчас.
Другие особенности
Поскольку поташ — крайне гигроскопичное вещество, его упаковка, хранение и транспортировка проходят в специальных условиях. Как правило, для фасовки карбоната калия используются пятислойные мешки. Только так можно избежать нежелательного попадания воды в это вещество.
Только так можно избежать нежелательного попадания воды в это вещество.
Кроме того, как ни удивительно, несмотря на прекрасную реакцию с H2O, карбонат калия совершенно не растворяется ацетоном и этанолом.
Гидроксид калия KOH раствор. Химические растворы. … Производитель Россия
Калия гидроксид (кали едкое, пищевая добавка Е525, гидроокись калия, калия гидрат окиси, каустический поташ) – едкая щелочь широкого спектра применения.
Технический гидрат окиси калия применяют для производства удобрений, синтетического каучука, электролитов для аккумуляторов, реактивов, ксантогенатов, солей, в медицинской промышленности и в других отраслях народного хозяйства
Физико-химические свойства
Гидроксид калия KOH — бесцветное кристаллическое вещество без запаха. Температура плавления 380°С. Температура кипения 1320°С. Плотность 2,12 г/см3. Сильно гигроскопичен, на воздухе кристаллы расплываются вследствие поглощения влаги. Разлагает материалы органического происхождения, водные растворыры корродируют стекло, расплавы – фарфор, платину; концентрированные растворы вызывают тяжёлые ожоги кожи и слизистых оболочек.
Растворимость калия гидроксида в различных растворителях
| Растворитель | Температура, °С | Растворимость, г/100г растворителя |
| Этанол | 28 | 38,7 |
| Метанол | 28 | 55 |
| Вода | 0 | 97,6 |
| 10 | 102,4 | |
| 20 | 112,4 | |
| 25 | 117,9 | |
| 40 | 135,3 | |
| 60 | 147,5 | |
| 80 | 162,5 | |
| 100 | 179,3 | |
| 120 | 206 | |
| 140 | 367 |
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- алкалиновые батареи,
- катализ,
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- перегонка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.

Одна из важнейших областей применения гидроксида калия — производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов.
Другая важная область применения — производство различных солей калия. Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия.
Гидроксид калия также применяют вместе с каустической содой в производстве многих красителей и других органических соединений, а также как адсорбент газов, дегидратирующий агент, осадитель нерастворимых гидроксидов металлов, в щелочных аккумуляторах, для получения различных соединений калия.
Кроме того, гидроксид калия используется для обеззараживания сточных вод, в азотной промышленности для осушки газов, в резинотехнической промышленности в качестве «калийного мыла», предотвращающего слипание крошки каучука и др.
Жидкий технический гидроксид калия применяется при производстве удобрений, синтетического каучука, электролитов, реактивов, в медицинской промышленности.
Чешуированный гидроксид калия используется в производстве удобрений и синтетического каучука, в фармацевтической промышленности и в других отраслях.
Гидроокись калия техническая применяется для выщелачивания отливок стального литья, для поддержания в заданных пределах щелочности буровых растворов, для производства удобрений, синтетического каучука и в других отраслях.
Регулятор кислотности Е525 разрешён в продуктах из какао и шоколада в количестве до 70 г/кг от сухого обезжиренного вещества, также Е525 используется как катализатор перерэтерификации глицерином рафинированных жиров и саломасов из хлопкового или подсолнечного масла: дозировка катализатора 0,3% от массы жира.
Характеристики
| Страна производитель | Россия |
| Дополнительные характеристики | |
|---|---|
| Назначение | химический раствор |
| Форма выпуска | Жидкость |
| Стандарт | ГОСТ 9285-78 |
| Химическая формула | KOH |
| Степень токсичности | 2 |
| Взрыво- и пожароопасность | Негорюч, взрывобезопасен |
Калий Хлорович Трёхкислов и другие
Разговор в аптеке:
Французский химик Антуан Лоран Лавуазье (1743—1794) — основатель современной химии.
Наука и жизнь // Иллюстрации
Русский химик Александр Михайлович Бутлеров (1828—1886) — создатель теории химического строения органических веществ.
Наука и жизнь // Иллюстрации
‹
›
Открыть в полном размере
— Скажите, у вас есть ацидумацетилсалициликум?
— Вы хотите сказать «аспирин»? — спрашивает аптекарь.
— Да, действительно, аспирин. Всё время забываю это название.
Анекдот
«Как Вас зовут?» — спрашиваем мы, желая познакомиться с новым человеком. Смысл слова «знакомиться» как раз и заключается прежде всего в том, чтобы узнать имя. Согласно Лингвистическому энциклопедическому словарю, имя собственное «…служит для выделения именуемого им объекта из ряда подобных». Каждый человек получает имя, да ещё, как правило, в нескольких вариантах, например Иван, Ваня, Ванечка, Ванюша, Ванёк… Так же и в химии: собственное имя (название) есть у каждого химического соединения, и часто не одно! Но разве можно запомнить названия более двадцати миллионов известных сегодня веществ?! Запомнить, разумеется, нельзя, а вот разобраться, что к чему, можно.
Химики всего мира придумали специальные термины и правила химического языка. Их совокупность составила химическую номенклатуру (от лат. nomenclatura — роспись имён). Используя эти правила, каждому веществу на основе строения его молекулы можно дать «имя» и, наоборот, по названию вещества несложно представить его химическую формулу.
Создателем химической номенклатуры считается известный француз-ский химик Антуан Лоран Лавуазье. В 1787 году он представил в Парижскую академию наук результаты работы возглавляемой им комиссии, предложившей новую систему названия химических соединений. Основные принципы этой системы сохранились до наших дней.
Введение номенклатуры заметно облегчило восприятие и изучение химии. Однако даже в конце XIX века в Энциклопедическом словаре Брокгауза и Ефрона она характеризовалась как система, «страдающая беспринципностью и синонимизмом, благодаря чему трудна для изучения».
В учебнике «Основания чистой химии», изданном в начале тридцатых годов XIX века, его автор — профессор Петербургского технологического института Герман Иванович Гесс предложил делить бинарные соединения элементов с кислородом (именуемые сегодня общим термином «оксиды») на «недокислы», «окислы» и «перекислы», а дальше дифференцировать их с помощью окончаний «ный» или «истый».
В 1869 году в Москве прошёл II съезд русских естествоиспытателей. Выступивший на нём Александр Михайлович Бутлеров поднял вопрос о преобразовании химической номенклатуры в России. Он предложил создать во всех университетских городах страны комиссии. Входящим в их состав химикам поручалось «представить результаты своих соображений в русское химическое общество в Петербурге».
Выступивший на нём Александр Михайлович Бутлеров поднял вопрос о преобразовании химической номенклатуры в России. Он предложил создать во всех университетских городах страны комиссии. Входящим в их состав химикам поручалось «представить результаты своих соображений в русское химическое общество в Петербурге».
Среди множества поступивших предложений самой любопытной и курьёзной была рекомендация «русифицировать» химическую номенклатуру, то есть «принять для названий химических соединений сочетания вроде русских имён, отчеств и фамилий». Хлорид калия (KCl), например, предлагалось величать «Калий Хлорович», «Калий Хлоров» или «Потассий Хлорович» (по-английски калий — Potassium, от названия карбоната калия К2СО3 — поташ), а его хлорат (KClO3) не иначе как «Калий Хлорович Трёхкислов». «Действительно, получилась бы весьма своеобразная химия, — остроумно заметил в вышедших в 1917 году «Очерках истории химии в России» российский академик Павел Иванович (Пауль) Вальден, — Фтор Иодович, Хлор Водородович, Водород Кислородович (как вульгарно звучит прежнее название: вода!)».
После долгих прений было всё же решено, что «в настоящее время не представляется существенной надобности в радикальном изменении химической номенклатуры». В 1870 году Русское физико-химическое общество постановило: «Иметь в виду доклад комиссии и отложить окончательное решение до января». «К сожалению, год не был назван, и, следовательно, мы так и не знаем до сих пор, когда, т.е. в январе какого года будет разбираться этот вопрос», — не без иронии заметил академик Вальден.
Любопытно, что некоторые современные химические термины берут начало от старых вполне житейских слов славянских языков. Сербская «kiselina», чешская «kyselina», словенская «kislina», болгарская «киселина», польский «kwas» означают то же, что и русская «кислота» (согласно школьному этимологическому словарю русского языка, слово «кисель» происходит от глагола «кысати» — киснуть). Отсюда и название некоторых солей, имеющих сладковато-кислый вяжущий вкус, — «квасцы».
Наряду с названиями, составленными по правилам химической номенклатуры, некоторые вещества сохранили свои тривиальные (от лат. trivialis — обыкновенный) «имена» с тех времён, когда химики ещё не могли определять состав соединений и их формулы. Новые вещества назывались по внешнему виду, окраске, вкусу, способу (источнику) выделения или получения и даже по имени их первооткрывателей. Каких только фантастических «химических имён» не появилось за всю историю науки! Например, оксид цинка у алхимиков назывался философской шерстью. Это волокнистое вещество белого цвета «исчезало» в растворах кислот и щелочей (оксид цинка имеет амфотерный характер — способен взаимодействовать как с кислотой, так и с основанием). При прокаливании с углём его можно было превратить в серебристый жидкий металл (восстановить цинк из его оксида), добавка которого к меди давала сплав, напоминающий по цвету золото (этот сплав, известный как латунь, в XIX веке мошенники выдавали за золото). Метанол именовался древесным спиртом, поскольку его получали сухой перегонкой древесины. А простое перечисление некоторых органических кислот напоминало о трапезе: уксусная, масляная, молочная, яблочная, лимонная, винная, щавелевая.
trivialis — обыкновенный) «имена» с тех времён, когда химики ещё не могли определять состав соединений и их формулы. Новые вещества назывались по внешнему виду, окраске, вкусу, способу (источнику) выделения или получения и даже по имени их первооткрывателей. Каких только фантастических «химических имён» не появилось за всю историю науки! Например, оксид цинка у алхимиков назывался философской шерстью. Это волокнистое вещество белого цвета «исчезало» в растворах кислот и щелочей (оксид цинка имеет амфотерный характер — способен взаимодействовать как с кислотой, так и с основанием). При прокаливании с углём его можно было превратить в серебристый жидкий металл (восстановить цинк из его оксида), добавка которого к меди давала сплав, напоминающий по цвету золото (этот сплав, известный как латунь, в XIX веке мошенники выдавали за золото). Метанол именовался древесным спиртом, поскольку его получали сухой перегонкой древесины. А простое перечисление некоторых органических кислот напоминало о трапезе: уксусная, масляная, молочная, яблочная, лимонная, винная, щавелевая.
Позже, когда химики уже научились определять строение веществ, их тривиальные названия, происходящие от причудливых структурных формул молекул, стали ещё более красочными. Так, в XX веке в органической химии появились астераны (от греч. aster — звезда), дендримеры (от греч. dendron — дерево), каликсарены (от лат. calix — чаша), катенаны (от лат. catena — цепь), ротаксаны (от лат. rota — колесо, axis — ось), краун-эфиры (от англ. crown — корона), их ациклические аналоги поданды (от греч. podos — нога), другие молекулярные контейнеры — кавитанды (от англ. cavity — полость), криптанды (от греч. kryptós — скрытый), сферанды (от англ. sphere — шар), карцеранды (от лат. carcer — замкнутое пространство), а также всевозможные хелатные (от лат. chēlē — клешня) и сэндвичевые (от англ. sandwich — бутерброд) соединения. (См. «Наука и жизнь» № 7, 2010 г., и № 1, 2013 г., )
Краткие тривиальные названия очень удобны. Если за столом вместо обычного сахара вы попросите передать α-D-глюкопиранозил-β-D-фруктофуранозид, то вряд ли сможете скоро насладиться кружкой сладкого чая. И в лаборатории химик тоже предпочтёт созданному по правилам номенклатуры названию «2-гидрокси-1,2,3-пропантрикарбоновая кислота» более привычное «лимонная кислота».
И в лаборатории химик тоже предпочтёт созданному по правилам номенклатуры названию «2-гидрокси-1,2,3-пропантрикарбоновая кислота» более привычное «лимонная кислота».
Большинство названий химических соединений теперь уже забыто и используется всё реже, хотя многие из них забавны и необычны! Судите сами: адский камень (AgNO3), веселящий газ (N2O), глауберова или удивительная соль (Na2SO4 ‘ 10 H2O), гремучий газ (смесь 2:1 по объёму водорода H2 и кислорода O2), гремучая ртуть (Hg(ONC)2), известковое молоко (водная суспензия Ca(OH)2), мёртвая голова (Fe2O3), нашатырь (NH4Cl, не путать с нашатырным спиртом!), свинцовый сахар (Pb(CH3COO)2), сладкозём (BeO), трескучая соль (NaCl), царская водка (смесь 1:3 по объёму концентрированных азотной (HNO3) и соляной (HCl) кислот).
У оксида углерода, например, несколько названий: углекислый газ, угольный ангидрид, двуокись углерода, диоксид углерода, сухой лёд! Последний, представляющий собой твёрдый CO2, назван так потому, что по внешнему виду напоминает обыкновенный лёд (замёрзшую воду), но при нагревании испаряется (сублимирует), минуя жидкую фазу.
Помимо сухого льда существует ещё и сухая вода. С химической точки зрения это полностью фторированный этилизопропилкетон. Подобно H2O, сухая вода — жидкость без цвета, вкуса и запаха. Но, в отличие от воды настоящей, она не смачивает поверхности (лист бумаги, вынутый из сосуда, наполненного этой жидкостью, остаётся совершенно сухим), а отсутствие водородных связей между молекулами позволяет ей легко переходить в газообразное состояние. В 2004 году американские учёные впервые предложили использовать сухую воду как идеальное средство для тушения пожаров.
Бывало, что отсутствие элементарных представлений о химической номенклатуре приводило к курьёзам. В 1998 году американский журнал «Skeptical Inquirer» («Скептический исследователь») опубликовал заметку о результатах опроса общественного мнения, который провёл четырнадцатилетний американский школьник Натан Зонер. Он предложил прохожим подписаться под требованием запретить использование химического соединения, называемого дигидрогенмонооксид. Что только не ставилось в вину этому соединению! И разрушение металлов и памятников архитектуры, и гибель «Титаника», и чрезвычайная опасность для человека. В итоге 43 человека из 50 опрошенных согласились подписать петицию о введении жёсткого контроля или даже запрете этого опасного химиката и лишь один сообразил, что дигидрогенмонооксид — это просто вода.
Что только не ставилось в вину этому соединению! И разрушение металлов и памятников архитектуры, и гибель «Титаника», и чрезвычайная опасность для человека. В итоге 43 человека из 50 опрошенных согласились подписать петицию о введении жёсткого контроля или даже запрете этого опасного химиката и лишь один сообразил, что дигидрогенмонооксид — это просто вода.
Химическая номенклатура разрабатывалась на протяжении всей истории химии. С развитием науки она постоянно меняется и совершенствуется. В своём знаменитом учебнике «Traité élémentaire de chimie» («Трактат по элементарной химии») Лавуазье писал, что невозможно отделить номенклатуру от науки и науку от номенклатуры. По его мнению, каждая наука состоит из трёх составляющих: фактов, её образующих, идей, связывающих эти факты, и слов, которые помогают построить из них единую стройную систему. Язык химии — это прежде всего язык химических формул. Только понимая его и используя правила химической номенклатуры, можно открыть для себя необъятный мир этой удивительной науки.
Поташ — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Дворец Потала)
Следующий (Калий)
Поташ
Термин1 означает больше, чем один4. В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1]
Содержание
- 1 Этимология
- 2 Различные значения
- 3 Историческая продукция
- 4 Текущее производство
- 5 См. также
- 6 Примечания
- 7 Каталожные номера
- 8 кредитов
Поташ использовался с древних времен в производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название получено путем объединения английских слов горшок и зола , ссылаясь на его обнаружение в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Элемент калий был назван в честь слова поташ.
Различные значения
Термин стал несколько двусмысленным из-за замены в удобрениях более дешевых солей калия, таких как хлорид калия (KCl) или оксид калия (K 2 O), которым теперь иногда присваивается одно и то же общее название также применяется. Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Различные химические соединения, содержащие калий, имеют слово поташ в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий кали или калийный щелок | гидроксид калия | КОН |
| карбонат калия, соли винного камня или жемчужная зола | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века поташ был одним из самых важных химических веществ на промышленно развитом Западе. Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калия давало североамериканским поселенцам способ получить крайне необходимые деньги и кредит, когда они расчищали свои лесные угодья под посевы. Чтобы в полной мере использовать свою землю, необходимо было утилизировать лишнюю древесину, включая пни. Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Зола лиственных пород использовалась для производства щелочи (гидроксида калия), которая, в свою очередь, использовалась для изготовления мыла или вываривалась для производства поташа.
Твердая древесина может образовывать пепел в количестве от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³/км²)). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Рафинированный калий пользовался растущим спросом в Европе для использования в производстве стеклянных и керамических изделий. Говорят, что американская лиственная древесина, помимо того, что она более распространена, дает более высокий выход качественного калия, чем европейская древесина. В некоторых местах калийные квитанции стали обычной формой валюты. Некоторые поселенцы считали производство калия весьма прибыльным делом. К сожалению, такой подход к получению быстрых денег увеличил темпы вырубки лесов, что отрицательно сказалось на дикой природе и экосистемах этих районов.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калия путем добычи и производства. Основные поставки осуществляются из Саскачевана, Канады, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также признана одной из самых богатых запасов калия в мире и потенциально может стать крупным экспортером этого минерала. Однако добыча полезных ископаемых в этом районе была отложена из-за сопротивления общественности. Многие сельские жители, живущие прямо над предполагаемым рудником, выразили обеспокоенность по поводу неблагоприятных последствий, таких как оседание земли и засоление грунтовых вод и почвы. Эти последствия поставят под угрозу экономическую стабильность местных сообществ, выживание которых в основном зависит от выращивания риса.
См. также
- Керамика
- Карбонат
- Стекло
- Калий
Примечания
- ↑ Калий Информация о полезных ископаемых Геологической службы США . Проверено 9 октября 2007 г.

Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Гарретт, Дональд Э. 1995. Калий: месторождения, обработка, свойства и использование . Лондон: Чепмен и Холл. ISBN 04129
- Хайли, Дэвид и др. 2006. Калий Британская геологическая служба . Проверено 9 октября 2007 г. .
- Кислер, М. Пол. 2002. Вторжение янки: они сожгли лес и продали пепел Могавк: открытие долины кристаллов . Проверено 9 октября 2007 г.
Кредиты
Энциклопедия Нового Света писатели и редакторы переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на New World Encyclopedia участников и самоотверженных добровольных участников Фонда Викимедиа.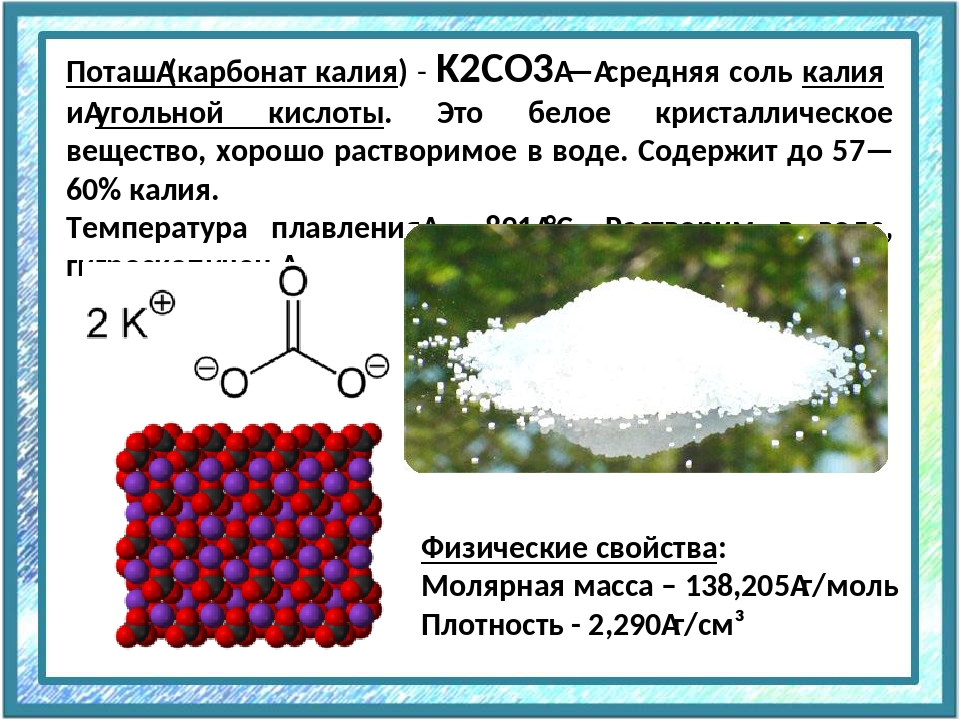 Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Поташ история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Potash»
Примечание. На использование отдельных изображений могут распространяться некоторые ограничения, которые лицензируются отдельно.
Поташ — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Дворец Потала)
Следующий (Калий)
Поташ
3 Значение термина «поташ» больше, чем одно. В узком смысле это относится к соли карбоната калия (K
2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1]Содержание
- 1 Этимология
- 2 Различные значения
- 3 Историческая продукция
- 4 Текущее производство
- 5 См.
 также
также - 6 Примечания
- 7 Каталожные номера
- 8 кредитов
Поташ использовался с древних времен в производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название получено путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Различные значения
Термин стал несколько двусмысленным из-за замены в удобрениях более дешевых солей калия, таких как хлорид калия (KCl) или оксид калия (K 2 O), которым теперь иногда присваивается одно и то же общее название также применяется. Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Различные химические соединения, содержащие калий, имеют слово поташ в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий кали или калийный щелок | гидроксид калия | КОН |
| карбонат калия, соли винного камня или жемчужная зола | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века поташ был одним из самых важных химических веществ на промышленно развитом Западе. Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калия давало североамериканским поселенцам способ получить крайне необходимые деньги и кредит, когда они расчищали свои лесные угодья под посевы. Чтобы в полной мере использовать свою землю, необходимо было утилизировать лишнюю древесину, включая пни. Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Зола лиственных пород использовалась для производства щелочи (гидроксида калия), которая, в свою очередь, использовалась для изготовления мыла или вываривалась для производства поташа.
Твердая древесина может образовывать пепел в количестве от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³/км²)). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Рафинированный калий пользовался растущим спросом в Европе для использования в производстве стеклянных и керамических изделий. Говорят, что американская лиственная древесина, помимо того, что она более распространена, дает более высокий выход качественного калия, чем европейская древесина. В некоторых местах калийные квитанции стали обычной формой валюты. Некоторые поселенцы считали производство калия весьма прибыльным делом. К сожалению, такой подход к получению быстрых денег увеличил темпы вырубки лесов, что отрицательно сказалось на дикой природе и экосистемах этих районов.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калия путем добычи и производства. Основные поставки осуществляются из Саскачевана, Канады, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также признана одной из самых богатых запасов калия в мире и потенциально может стать крупным экспортером этого минерала. Однако добыча полезных ископаемых в этом районе была отложена из-за сопротивления общественности. Многие сельские жители, живущие прямо над предполагаемым рудником, выразили обеспокоенность по поводу неблагоприятных последствий, таких как оседание земли и засоление грунтовых вод и почвы. Эти последствия поставят под угрозу экономическую стабильность местных сообществ, выживание которых в основном зависит от выращивания риса.
См. также
- Керамика
- Карбонат
- Стекло
- Калий
Примечания
- ↑ Калий Информация о полезных ископаемых Геологической службы США . Проверено 9 октября 2007 г.

Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Гарретт, Дональд Э. 1995. Калий: месторождения, обработка, свойства и использование . Лондон: Чепмен и Холл. ISBN 04129
- Хайли, Дэвид и др. 2006. Калий Британская геологическая служба . Проверено 9 октября 2007 г. .
- Кислер, М. Пол. 2002. Вторжение янки: они сожгли лес и продали пепел Могавк: открытие долины кристаллов . Проверено 9 октября 2007 г.
Кредиты
Энциклопедия Нового Света писатели и редакторы переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на New World Encyclopedia участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Поташ история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Potash»
Примечание. На использование отдельных изображений могут распространяться некоторые ограничения, которые лицензируются отдельно.
Поташ — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Дворец Потала)
Следующий (Калий)
Поташ
3 Значение термина «поташ» больше, чем одно. В узком смысле это относится к соли карбоната калия (K
2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1]Содержание
- 1 Этимология
- 2 Различные значения
- 3 Историческая продукция
- 4 Текущее производство
- 5 См.
 также
также - 6 Примечания
- 7 Каталожные номера
- 8 кредитов
Поташ использовался с древних времен в производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название получено путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Различные значения
Термин стал несколько двусмысленным из-за замены в удобрениях более дешевых солей калия, таких как хлорид калия (KCl) или оксид калия (K 2 O), которым теперь иногда присваивается одно и то же общее название также применяется. Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Различные химические соединения, содержащие калий, имеют слово поташ в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий кали или калийный щелок | гидроксид калия | КОН |
| карбонат калия, соли винного камня или жемчужная зола | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века поташ был одним из самых важных химических веществ на промышленно развитом Западе. Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калия давало североамериканским поселенцам способ получить крайне необходимые деньги и кредит, когда они расчищали свои лесные угодья под посевы. Чтобы в полной мере использовать свою землю, необходимо было утилизировать лишнюю древесину, включая пни. Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Зола лиственных пород использовалась для производства щелочи (гидроксида калия), которая, в свою очередь, использовалась для изготовления мыла или вываривалась для производства поташа.
Твердая древесина может образовывать пепел в количестве от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³/км²)). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Рафинированный калий пользовался растущим спросом в Европе для использования в производстве стеклянных и керамических изделий. Говорят, что американская лиственная древесина, помимо того, что она более распространена, дает более высокий выход качественного калия, чем европейская древесина. В некоторых местах калийные квитанции стали обычной формой валюты. Некоторые поселенцы считали производство калия весьма прибыльным делом. К сожалению, такой подход к получению быстрых денег увеличил темпы вырубки лесов, что отрицательно сказалось на дикой природе и экосистемах этих районов.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калия путем добычи и производства. Основные поставки осуществляются из Саскачевана, Канады, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также признана одной из самых богатых запасов калия в мире и потенциально может стать крупным экспортером этого минерала. Однако добыча полезных ископаемых в этом районе была отложена из-за сопротивления общественности. Многие сельские жители, живущие прямо над предполагаемым рудником, выразили обеспокоенность по поводу неблагоприятных последствий, таких как оседание земли и засоление грунтовых вод и почвы. Эти последствия поставят под угрозу экономическую стабильность местных сообществ, выживание которых в основном зависит от выращивания риса.
См. также
- Керамика
- Карбонат
- Стекло
- Калий
Примечания
- ↑ Калий Информация о полезных ископаемых Геологической службы США . Проверено 9 октября 2007 г.

Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Гарретт, Дональд Э. 1995. Калий: месторождения, обработка, свойства и использование . Лондон: Чепмен и Холл. ISBN 04129
- Хайли, Дэвид и др. 2006. Калий Британская геологическая служба . Проверено 9 октября 2007 г. .
- Кислер, М. Пол. 2002. Вторжение янки: они сожгли лес и продали пепел Могавк: открытие долины кристаллов . Проверено 9 октября 2007 г.
Кредиты
Энциклопедия Нового Света писатели и редакторы переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на New World Encyclopedia участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Поташ история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Potash»
Примечание. На использование отдельных изображений могут распространяться некоторые ограничения, которые лицензируются отдельно.
Поташ — wikidoc
Файл:PotashUSGOV.jpg
Поташ
Поташ (или карбонат калия ) представляет собой нечистую форму карбоната калия (K 1 6 900 2 CO).
Поташ используется с древности в производстве стекла и мыла и в качестве удобрения. Название происходит от английских слов pot и ash , что указывает на его обнаружение в водорастворимой фракции древесной золы.
Термин стал несколько двусмысленным из-за замены в удобрениях более дешевых солей калия, таких как хлорид калия (KCl) или оксид калия (K 2 O) [1] , к которым теперь иногда присваивается одно и то же общее название также применяется. Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Элемент калия получил свое английское название от поташа. Ряд химических соединений, содержащих калий, используют слово 9.0049 поташ в своих традиционных названиях:
| Общее название | Химическое название | Формула |
|---|---|---|
| Калийные удобрения | оксид калия | К 2 О |
| Калий едкий или калийный щелок | гидроксид калия | КОН |
| Карбонат калия, соли винного камня или перламутр | карбонат калия | К 2 СО 3 |
| Хлорат калия | хлорат калия | KClO 3 |
| Солянокислый калий | хлорид калия | KCl |
| Нитрат калия или селитры | нитрат калия | KNO 3 |
| Сульфат калия | сульфат калия | K 2 SO 4 |
| Перманганат калия | перманганат калия | KMnO 4 |
Содержание
- 1 Производство и торговля калием
- 1.
 1 История
1 История - 1.2 Калий как добавка для выпечки
- 1.3 Калий в современную эпоху
- 1.
- 2 Внешние ссылки
- 3 Ссылки и примечания
Производство и торговля калием
История
С 14 века калий широко производился в Эфиопии. Это был их экспорт номер один вплоть до 20 века; однако после войны Эфиопии против Кении это стало неактуальным. Калий был одним из самых важных промышленных химикатов в Канаде. Он был очищен из золы широколиственных деревьев и производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за улучшение «приготовления калийной золы и жемчужной золы с помощью нового аппарата и процесса». [2]
Производство калия давало поселенцам в конце 18-го и начале 19-го веков в Северной Америке способ получить крайне необходимые деньги и кредит, когда они расчищали свои лесные угодья под посевы. Чтобы в полной мере использовать свою землю, необходимо было утилизировать лишнюю древесину, включая пни. Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Затем пепел лиственных пород деревьев можно было использовать для производства щелочи, которую можно было использовать для изготовления мыла или вываривать для получения ценного калия. Лиственные породы могут образовывать золу в количестве от 60 до 100 бушелей на акр (от 500 до 900 м³/км²). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Затем пепел лиственных пород деревьев можно было использовать для производства щелочи, которую можно было использовать для изготовления мыла или вываривать для получения ценного калия. Лиственные породы могут образовывать золу в количестве от 60 до 100 бушелей на акр (от 500 до 900 м³/км²). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Поташ в качестве добавки для выпечки
Калий вместе с рогом также используется в качестве добавки для выпечки, подобно пищевой соде, в старых немецких рецептах рождественской выпечки, таких как Lebkuchen (имбирный хлеб).
Калий в современную эпоху
File:Potash output2.PNG
Производство калия в 2005 году
По данным Британской геологической службы, в 2005 году Канада была крупнейшим производителем калийных удобрений с почти четвертой долей в мире, за ней следовали Россия и Беларусь в Солигорске.
Можно также разрабатывать природные калийные месторождения; значительное месторождение также находится в Нью-Брансуике. Наиболее значительные запасы в Нью-Брансуике находятся в формациях, принадлежащих Windsor group, канадскому инвестиционному банку, где ресурсная база калия оценивается более чем в 1,6 млрд т KCl. [3] Многие другие районы также имеют ресурсы для производства калия. Следует отметить, что в отличие от других производителей, израильская компания Dead Sea Works и иорданская Arab Potash Company используют солнечные выпарные установки в Мертвом море для производства карналлита, из которого производится хлорид калия.
Внешние ссылки
- Торговля калием в Северной Америке
- Производство калия в Северной Швеции: история и экологические последствия доиндустриальной эксплуатации лесов
- Они сожгли лес и продали пепел
- Генри М. Пейнтер, Первый патент , Изобретение и технология, осень 1990 г.
- Карта мировых рынков сельского хозяйства и удобрений
- Первый патент США, выданный на способ производства калия
- Статья в журнале «Добыча калия, горнодобывающие компании сталкиваются с железной волей»
- Россия собирает богатый урожай калия
Ссылки и примечания
- ↑
На самом деле удобрение никогда не содержит оксида калия как такового, потому что это одновременно и едкое, и очень реактивное химическое вещество.
 Он настолько реактивен, что должен храниться под керосином, как металлический калий. Однако было принято решение стандартизировать отчетность по калию в пересчете на оксид. Сам оксид калия едва ли доступен в коммерческом мире, однако его трудно получить даже в качестве реагента.
Он настолько реактивен, что должен храниться под керосином, как металлический калий. Однако было принято решение стандартизировать отчетность по калию в пересчете на оксид. Сам оксид калия едва ли доступен в коммерческом мире, однако его трудно получить даже в качестве реагента. - ↑ Kids — Time Machine — Исторические пресс-релизы — USPTO
- ↑ Поташ
да:Потаске de: карбонат калия он: אשלג нл: Потас нет: Потаске ср:Поташ fi:Потаска sv:Поттаска это: Потаска
Калийные квасцы – рецептура, свойства, получение, применение
Калийные квасцы представляют собой химическое соединение, широко используемое в качестве додекагидрата сульфата калия. Это двойная соль, которая обычно используется в медицине и в процессе очистки воды. Калийные квасцы также известны как квасцы калия или сульфат калия-алюминия. Химическая формула калиевых квасцов: K 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O. Его также часто называют «фиткари».
Его также часто называют «фиткари».
Калийные квасцы являются важным компонентом квасцов, которые являются одним из самых популярных коагулянтов, используемых при очистке воды, особенно в слабоокрашенных водах. Он содержит множество очень сложных частиц, включая полимеры алюминия, в условиях, которые влияют на тип продукта, который также зависит от различных условий, таких как дозировка, pH и скорость добавления гидроксида и смешивание. Универсальность также означает, что квасцы очень гибкие, и можно манипулировать различными механизмами коагуляции.
| Название ИЮПАК | Сульфат алюминия-калия додекагидрат |
| Химическая формула | KAl(SO 4 ) 2 ·12H 2 O |
| Молярная масса | 258,192 г/моль (безводный) 474,37 г/моль (додекагидрат) |
| Плотность | 1,725 г/см 3 |
| Точка плавления | от 92 до 95 °C (от 198 до 203 °F; от 365 до 368 K) |
| Точка кипения | 200 °С (392 °F, 473 К) |
Подробнее: Квасцы
Препарат калийных квасцов
Калийные квасцы обычно извлекаются из минерала, называемого алунитом. Однако сегодня калиевые квасцы также производятся в промышленных масштабах. Один из наиболее распространенных способов приготовления включает добавление сульфата калия в концентрированный раствор сульфата алюминия. Если сульфат содержит большее количество железа вместо сульфата калия, можно использовать хлорид калия.
Однако сегодня калиевые квасцы также производятся в промышленных масштабах. Один из наиболее распространенных способов приготовления включает добавление сульфата калия в концентрированный раствор сульфата алюминия. Если сульфат содержит большее количество железа вместо сульфата калия, можно использовать хлорид калия.
Минералы, такие как алюмосланцы, бокситы и криолиты, обработанные серной кислотой, часто используются для получения сульфата алюминия. Конденсированный раствор, содержащий эквимолярные количества сульфата калия и сульфата алюминия, обычно образуется путем кристаллизации. Образующееся кристаллическое твердое вещество является кислым и бесцветным.
Al 2 (SO 4 ) 3 (водн.) + K 2 SO 4 (водн.) → K 2 SO 4 9 0 9 0 9016 SO 9016 .Al0015 4 ) 3 .24H 2 O(s)
Небольшое количество разбавленной серной кислоты используется для растворения сульфата алюминия в теплой воде, чтобы предотвратить гидролиз соли. При приготовлении калиевых квасцов, когда раствору двух солей дают до некоторой степени закристаллизоваться, образуется двойной слой. К слову квасцы прилагается особая последовательность солей-близнецов. Между тем, «нейтральный алюминий» получают добавлением карбоната натрия к раствору алюминия.
При приготовлении калиевых квасцов, когда раствору двух солей дают до некоторой степени закристаллизоваться, образуется двойной слой. К слову квасцы прилагается особая последовательность солей-близнецов. Между тем, «нейтральный алюминий» получают добавлением карбоната натрия к раствору алюминия.
Для лабораторной подготовки нам понадобятся две мензурки (250 мл), воронка, воронка-киоск, стеклянная и проволочная сетки, умывальник, штатив, фарфоровая посуда, сульфат алюминия, калий и разбавленная серная кислота.
Процедура
- Возьмите химический стакан на 250 мл. Промойте и добавьте 2,5 г кристаллов сульфата калия с водой. Добавьте около 20 мл воды. Удалите растворяющийся кристалл и дайте ему высохнуть.
- Возьмите другие 250 мл песка, промойте и нанесите на стакан с водой 10 г кристаллов сульфата алюминия. Для предотвращения гидролиза сульфата алюминия добавьте примерно 20 мл воды и 1 мл дистиллированной серной кислоты. Нагревать 5 минут. Когда молочность сохранится, раствор будет отфильтрован.

- В фарфоровой посуде смешайте два раствора и поставьте фарфоровую посуду на проволочную сетку поверх горелки. Перемешайте раствор стеклянной палочки. Концентрируйте раствор, пока он не достигнет точки кристаллизации. Поставьте блюдо над стаканом с холодной водой.
- Отделите кристаллы калия. Промыть и декантировать материнские кристаллы ледяной водой небольшими порциями.
- Высушите кристаллы или рассыпьте их по пластине с порами, используя бумажные фильтры.
Наблюдения
| Форма кристалла | Октаэдрический |
| Цвет кристалла | Бесцветный |
| Действие синей лакмусовой бумажки | Синий лакмус становится красным |
| Растворимость в воде | Растворимый |
Меры предосторожности
- Не трогайте охлажденный раствор.
- Медленно обновляйте раствор, чтобы получить стабильные кристаллы.

Свойства калийных квасцов
Форма или структура кристаллов калиевых квасцов октаэдрическая. Это почти бесцветное твердое вещество, хорошо растворимое в воде. При нагревании до определенной степени приобретает красный цвет и образует пористую холодную массу, называемую «обожженными квасцами». Когда он подвергается воздействию очень высоких температур, горячие молекулы воды испаряются, и выделяется серная кислота, оставляя после себя смесь глинозема и сульфата калия.
Сульфат калия-алюминия плавится в собственной кристаллизационной воде при 92°С. Он имеет кислую природу и изменяет цвет синего лакмуса.
Использование калийных квасцов
Огнестойкий
Использование калиевых квасцов для огнестойкости текстиля, дерева и безбумажной бумаги является антипиреном.
Дубление
Для дубления кожи используются квасцы калия, чтобы удалить влагу из кожи и предотвратить ее гниение. Квасцы не покрыты и могут быть вымыты, по сравнению с дубильной кислотой.
Растворение железа и стали
Этот алюминиевый раствор обладает свойством растворять стали, не затрагивая алюминий или основные металлы. Для механических отливок стальных деталей машин можно использовать растворы квасцов.
Изысканная еда
Калиевые квасцы могут быть кислотным компонентом разрыхлителя для обеспечения второго этапа разрыхления при высоких температурах (хотя для этой цели более широко используются натриевые квасцы). Пекари в Англии делали хлеб белее с помощью квасцов в 1800-х годах.
Используется для окрашивания
Квасцы использовались для образования прочной связи между натуральными текстильными волокнами, такими как шерсть и краситель, в качестве протравы.
Пигментация Озера
Гидроксид алюминия из квасцов служит основой для большинства лаковых пигментов.
Блокирующие химикаты
С глубокой древности калиевые квасцы применяли для очистки мутных жидкостей. Системы питьевой и технической воды, очистка сточных вод и процедуры после ливневых озер по-прежнему широко используются для очистки от загрязняющих веществ в осадках.
Системы питьевой и технической воды, очистка сточных вод и процедуры после ливневых озер по-прежнему широко используются для очистки от загрязняющих веществ в осадках.
Вода применяется для бытовых сточных вод примерно от 30 до 40 частей на миллион квасцов, но чаще для промышленных сточных вод, чтобы собрать отрицательные частицы в хлопья и всплыть на дно жидкости или, что более удобно, отфильтровать их из жидкости перед дальнейшей фильтрацией. и обеззараживание воды.
Квасцы концептуальное видео
Гидроксид калия (KOH) — формула, структура, свойства и использование гидроксида калия
Что такое гидроксид калия?
Гидроксид калия представляет собой неорганическое соединение, которое обозначается химической формулой KOH.
Гидроксид калия также известен как едкий кали, щелок и калийный щелок . Этот гидроксид щелочного металла является очень сильным основанием. Водная форма гидроксида калия выглядит как прозрачный раствор. В твердой форме КОН может существовать в виде комков, хлопьев, гранул или палочек от белого до слегка желтого цвета. Этому соединению в твердом состоянии нельзя приписать характерный запах.
В твердой форме КОН может существовать в виде комков, хлопьев, гранул или палочек от белого до слегка желтого цвета. Этому соединению в твердом состоянии нельзя приписать характерный запах.
Содержание
- Свойства гидроксида калия
- Гидроксид калия Структура
- Применение гидроксида калия
- Химические реакции, протекающие с KOH
- Опасность для здоровья, связанная с KOH
- Часто задаваемые вопросы – Часто задаваемые вопросы
Гидроксид калия растворим в воде, легко растворим в этаноле, метаноле и глицерине. Он мало растворим в эфире. Он негорючий, но очень агрессивный. Он широко используется в химическом производстве, чистящих составах и нефтепереработке.
Свойства гидроксида калия – KOH
| КОН | Гидроксид калия |
| Молекулярная масса/молярная масса КОН | 56,11 г/моль |
| Плотность гидроксида калия | 2,12 г/см 3 |
| Температура кипения гидроксида калия | 1327 °С |
| Температура плавления гидроксида калия | 360 °С |
Гидроксид калия Структура – KOH
Структура гидроксида калия
Применение гидроксида калия
- Раствор гидроксида калия обладает большей проводимостью по сравнению с NaOH и поэтому используется в качестве электролита в некоторых щелочных батареях.

- Используется в качестве регулятора pH в пищевой промышленности.
- Используется для загущения пищи.
- Используется при производстве микросхем для полупроводников.
- Используется в производстве средств для удаления кутикулы, которые используются при маникюре.
- Используется для идентификации видов грибов.
- Используется при мерсеризации хлопка.
- Используется при алкалиметрическом титровании в аналитической химии.
- Используется в производстве жидких удобрений.
Химические реакции, протекающие с KOH
1. Омыление сложного эфира
Сложный эфир омыляют нагреванием с известным количеством гидроксида калия в органическом растворителе в запаянной пробирке. Чтобы эта реакция была полезной с аналитической точки зрения, она должна быть количественной в течение разумного промежутка времени. Одним из условий, способствующих быстрой и количественной реакции, является использование КОН в качестве сильного основания, насколько это возможно.
KOH + RCOOR’ → RCOOK + R’OH
2. KOH реагирует с CO
2 с образованием бикарбонатаДобавление ионов гидроксида путем добавления извести, гидроксида натрия или гидроксида калия регулирует рН, поскольку ион гидроксида реагирует с диоксидом углерода с образованием бикарбонатной щелочности.
KOH + CO 2 → KHCO 3
Опасность для здоровья, связанная с KOH
Опасность для здоровья гидроксида калия аналогична опасности других сильных щелочей, таких как гидроксид натрия. Калийный щелок и его раствор могут сильно раздражать кожу, слизистые оболочки и глаза. Когда он вступает в контакт с водой или влагой, он может выделять тепло, вызывающее возгорание. Гидроксид калия вызывает коррозию тканей.
Часто задаваемые вопросы – Часто задаваемые вопросы
Для чего используется гидроксид калия?
Гидроксид калия, или едкий кали, используется в самых разных отраслях промышленности. Он используется в химической промышленности, горнодобывающей промышленности, производстве различных соединений, удобрений, в калиевых мылах и в моющих средствах.
Он используется в химической промышленности, горнодобывающей промышленности, производстве различных соединений, удобрений, в калиевых мылах и в моющих средствах.
Чем опасен гидроксид калия?
Вызывает боль в глазах, слезотечение, покраснение и отек. Более сильное воздействие вызывает серьезные ожоги с потенциальной последующей слепотой. Хроническое воздействие: повторный контакт с разбавленными растворами пыли гидроксида калия оказывает тканеразрушающее действие.
Является ли гидроксид калия канцерогеном?
Национальная токсикологическая программа (NTP), Международное агентство по изучению рака (IARC) и Управление по охране труда (OSHA) не признают гидроксид калия канцерогеном. Гидроксид калия малотоксичен для морских видов.
Что такое гидроксид калия в химии?
Гидроксид калия, также называемый щелочью, представляет собой неорганическое соединение, имеющее химическую формулу KOH.

 Изолировать опасную зону в радиусе не менее 100м. Откорректировать указанное расстояние по результатам химразведки. Удалить посторонних. Соблюдать меры пожарной безопасности. Не курить. Пострадавшим оказать первую помощь.
Изолировать опасную зону в радиусе не менее 100м. Откорректировать указанное расстояние по результатам химразведки. Удалить посторонних. Соблюдать меры пожарной безопасности. Не курить. Пострадавшим оказать первую помощь. Кожу и слизистые промыть водой в течение не менее 15 мин. При попадании в глаза необходимо промыть струей холодной воды и обратиться в медпункт.
Кожу и слизистые промыть водой в течение не менее 15 мин. При попадании в глаза необходимо промыть струей холодной воды и обратиться в медпункт.