Формула карбоната калия в химии
Определение и формула карбоната калия
Формула –
Молярная масса равна г/моль.
Физические свойства – соль белого цвета растворимая в воде, но не растворимая в этиловом спирте, образует растворы с сильно щелочной реакцией.
Плавится без разложения, при более глубоком нагревании разлагается.
Очень хорошо растворяется в воде (сильный гидролиз по аниону):
Карбонат калия является основным компонентом калийных удобрений. Исторически сложилось так, что карбонат калия получали при спекании поташа из золы растений в печи для удаления примесей. Мелкий белый оставшийся порошок являлся поташем. Первый патент, выданный патентным ведомством США был присужден Сэмюэлю Хопкинсу в 1790 году для улучшенного способа изготовления поташа из золы растений и карбоната калия.
В конце 18-го века в Северной Америке, до развития разрыхлителей, поташ использовался в качестве разрыхлителя в быстрых хлебах.
Химические свойства карбоната калия
Получение
В настоящее время, карбонат калия получают в промышленных масштабах путем электролиза хлорида калия. Полученный гидроксид калия приводят во взаимодействие с диоксидом углерода с образованием карбоната калия, который часто используется для получения других соединений калия:
Применение
Исторически карбонат калия использовался для производства мыла, стекла, фарфора. В качестве мягкого сушильного агента, где другие влагопоглощающие вещества, такие как хлорид кальция и сульфат магния, нельзя применить. Он не подходит для кислотных соединений, но может быть полезен для сушки органической фазы, если есть небольшое количество кислотных примесей. Он также может быть использован для сушки некоторых кетонов, спиртов и аминов перед перегонкой.
Используется в производстве порошка какао, чтобы сбалансировать натуральных какао-бобов (это также помогает улучшить аромат).
Примеры решения задач
Калий углекислый технический (поташ) кальцинированный
Калий углекислый технический (поташ) кальцинированныйГОСТ 10690-73
Применение: Строительство, стекольная, электровакуумная, химическая и другие отрасли промышленности.
Формула: К2С3
Упаковка и транспортировка:
Поташ упаковывается в многослойные бумажные мешки весом 25 кг или в мягкие контейнеры типа «биг-бег» весом до 700 кг или 1000 кг и транспортируется грузовым автотранспортом, в крытых ж/д вагонах или большегрузных контейнерах.
| Качественные показатели карбоната калия технического (поташа) | ||||
| Наименование показателя | Кальцинированный | Полутораводный подсушенный | Полутораводный 1 сорт | Полутораводный 2 сорт |
| Массовая доля углекислого калия (К2С3 ), %, не менее | 99.2 | 99.2 | 99.0 | 94.0 |
| Массовая доля натрия в пересчете на Na2CO3, %, не более | 0.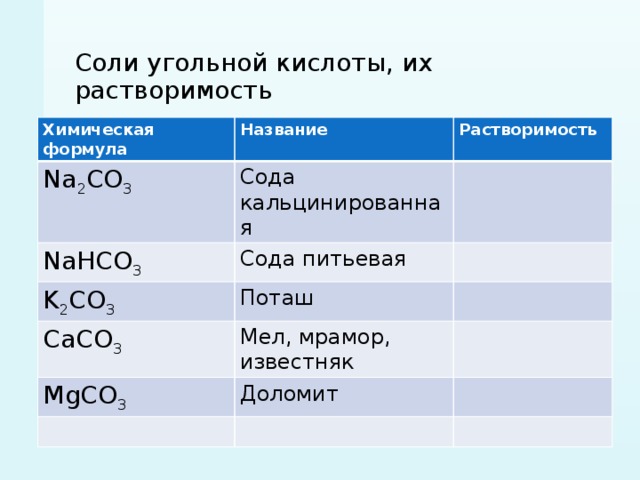 30 30 | 0.30 | 0.40 | 3.2 |
| Массовая доля хлоридов в пересчете на хлор-ион, %, не более/td> | 0.02 | 0.02 | 0.03 | 1.0 |
| Массовая доля сернокислых солей в пересчете на сульфат-ион, %, не более | 0.1 | 0.1 | 0.3 | 0.6 |
| Массовая доля железа в пересчете в пересчете на Fe2O3, %, не более | 0.001 | 0.001 | 0.001 | 0.005 |
| Массовая доля алюминия в пересчете на Al2О3, %, не более | 0.1 | 0.1 | 0.15 | 0.8 |
| Массовая доля нерастворимого в воде остатка, %, не более | 0. 01 01 | 0.01 | 0.01 | 0.1 |
| Массовая доля потери массы при прокаливании при 50°С, %, не более | 1.0 | 13-15.5 | 16.5 | 20 |
| Гранулометрический состав: <2,5 мм, мин <0,1 мм, макс. | 99% | 99% 20% | — | — |
Калий углекислый(Поташ) (б/в) Ч, цена 98 грн
Калий углекислый 98,1 % — неорганическое соединение, дикалиевая соль угольной кислоты. Часто употребляются также названия карбонат кальция, дикалий карбонат, поташ.
Химическая формула : K2CO3.
Свойства: Карбонат калия (углекислый калий, калий карбонат, поташ) K2CO3 — средняя соль калия и угольной кислоты. Калий углекислый — белое кристаллическое вещество, хорошо растворимое в воде. Старое название соли — поташ, отсюда английское наименование калия — potassium. Поташ — одна из наиболее древних солей, известных людям.
Поташ — одна из наиболее древних солей, известных людям.
Применение: Карбонат калия (углекислый калий, поташ) используется — в строительстве (в качестве противоморозной добавки), — в стекольной отрасли, — в электровакуумной отрасли, — в химической и других отраслей промышленности, — применялся при изготовлении сукна, мыла, ценных сортов стекла, красок, выделке кож и др.
Производитель : Россия
Сферы применения технического углекислого калия
Главными потребителями технического углекислого калия являются медицинские, металлургические, строительные, пищевые предприятия. Сфера применения поташа:
в качестве сушильного, буферного агента;
как наполнитель для огнетушителей;
при производстве стекла для повышения прозрачности и прочности;
для очищения хлопка, обезжиривания шерсти.
Купить вещество можно также и для сельскохозяйственных целей, использовать в качестве удобрения в разведенном виде. Цена на продукцию невысокая, что позволяет широко использовать для обработки разных по площади насаждений.
Цена на продукцию невысокая, что позволяет широко использовать для обработки разных по площади насаждений.
Купить калий поташ по хорошей цене
Технический углекислый калий применяется для производства фармацевтических препаратов, красителей, дегидратирующих веществ, адгезивов, мыла, удобрения. Поташ также является компонентом калиевого щелка, придает составу мягкость, обеспечивает полутвердую консистенцию. Углекислый калий можно также использовать в качестве антиоксиданта в фармацевтических составах и резиновых добавках. Купить сырье можно по хорошей цене.
Калий — Энциклопедия Нового Света
Термин калий имеет несколько значений. В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые могут быть добыты или произведены. [1]
Калий использовался с древних времен при производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название образовано путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Разные значения
Термин стал несколько двусмысленным из-за замены удобрений более дешевыми солями калия, такими как хлорид калия (KCl) или оксид калия (K 2 O), к которым теперь иногда применяется то же самое общее название.Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Различные химические соединения, содержащие калий, имеют слово potash в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий калий или калийный щелок | гидроксид калия | КОН |
| карбонат калия, винный камень или перлаш | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века калий был одним из важнейших химических веществ на промышленно развитом Западе. Добываемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 1790 году Сэмюэлю Хопкинсу на усовершенствование создания «Калийной золы и жемчужной золы с помощью нового устройства и процесса».
Добываемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 1790 году Сэмюэлю Хопкинсу на усовершенствование создания «Калийной золы и жемчужной золы с помощью нового устройства и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калийных удобрений дало североамериканским поселенцам возможность получить крайне необходимые денежные средства и кредит, поскольку они расчищали свои лесные земли для посева. Чтобы полностью использовать свою землю, необходимо было избавиться от лишней древесины, включая пни.Самый простой способ добиться этого — сжечь дрова, не нужные для топлива или строительства. Из золы лиственных деревьев производили щелок (гидроксид калия), который, в свою очередь, использовали для изготовления мыла или кипятили для производства поташа.
Древесина твердых пород может образовывать золу из расчета от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³ / км²)). В 1790 году золу можно было продать по цене от 3,25 до 6,25 доллара за акр (от 800 до 1500 долларов за квадратный километр) в сельской местности штата Нью-Йорк — почти столько же, сколько нанять рабочего для расчистки той же территории.
В 1790 году золу можно было продать по цене от 3,25 до 6,25 доллара за акр (от 800 до 1500 долларов за квадратный километр) в сельской местности штата Нью-Йорк — почти столько же, сколько нанять рабочего для расчистки той же территории.
Очищенный калий пользуется растущим спросом в Европе для использования в производстве стекла и керамических изделий. Утверждается, что американские лиственные породы не только более многочисленны, но и дают более высокий выход качественного поташа, чем европейская древесина. В некоторых регионах калийные расписки стали обычной формой валюты. Некоторые поселенцы считали производство калийных удобрений довольно прибыльным. К сожалению, такой подход к быстрому получению денежных средств увеличил темпы обезлесения, что отрицательно сказалось на дикой природе и экосистемах этих территорий.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калийных удобрений с помощью горнодобывающих и производственных процессов. Основное предложение поступает из Саскачевана, Канада, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого получают хлорид калия.
Основное предложение поступает из Саскачевана, Канада, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого получают хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также считается одним из самых богатых в мире запасов калийных удобрений и потенциально может стать крупным экспортером этого минерала.Однако разработка этого участка была отложена из-за общественного протеста. Многие сельские жители, которые живут непосредственно над предполагаемым участком рудника, выразили обеспокоенность по поводу неблагоприятных последствий, таких как проседание земли и засоление грунтовых вод и почвы. Эти последствия могут поставить под угрозу экономическую стабильность местных сообществ, выживание которых зависит в первую очередь от выращивания риса.
См. Также
Банкноты
- ↑ Potash USGS Minerals Information .
 Проверено 9 октября 2007 года.
Проверено 9 октября 2007 года.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Внешние ссылки
Все ссылки получены 13 июня 2019 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства.Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Калий — Энциклопедия Нового Света
Термин калий имеет несколько значений. В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые могут быть добыты или произведены. [1]
Калий использовался с древних времен при производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название образовано путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Разные значения
Термин стал несколько двусмысленным из-за замены удобрений более дешевыми солями калия, такими как хлорид калия (KCl) или оксид калия (K 2 O), к которым теперь иногда применяется то же самое общее название. Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Различные химические соединения, содержащие калий, имеют слово potash в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий калий или калийный щелок | гидроксид калия | КОН |
| карбонат калия, винный камень или перлаш | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века калий был одним из важнейших химических веществ на промышленно развитом Западе. Добываемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 1790 году Сэмюэлю Хопкинсу на усовершенствование создания «Калийной золы и жемчужной золы с помощью нового устройства и процесса».
Добываемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 1790 году Сэмюэлю Хопкинсу на усовершенствование создания «Калийной золы и жемчужной золы с помощью нового устройства и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калийных удобрений дало североамериканским поселенцам возможность получить крайне необходимые денежные средства и кредит, поскольку они расчищали свои лесные земли для посева. Чтобы полностью использовать свою землю, необходимо было избавиться от лишней древесины, включая пни.Самый простой способ добиться этого — сжечь дрова, не нужные для топлива или строительства. Из золы лиственных деревьев производили щелок (гидроксид калия), который, в свою очередь, использовали для изготовления мыла или кипятили для производства поташа.
Древесина твердых пород может образовывать золу из расчета от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³ / км²)). В 1790 году золу можно было продать по цене от 3,25 до 6,25 доллара за акр (от 800 до 1500 долларов за квадратный километр) в сельской местности штата Нью-Йорк — почти столько же, сколько нанять рабочего для расчистки той же территории.
В 1790 году золу можно было продать по цене от 3,25 до 6,25 доллара за акр (от 800 до 1500 долларов за квадратный километр) в сельской местности штата Нью-Йорк — почти столько же, сколько нанять рабочего для расчистки той же территории.
Очищенный калий пользуется растущим спросом в Европе для использования в производстве стекла и керамических изделий. Утверждается, что американские лиственные породы не только более многочисленны, но и дают более высокий выход качественного поташа, чем европейская древесина. В некоторых регионах калийные расписки стали обычной формой валюты. Некоторые поселенцы считали производство калийных удобрений довольно прибыльным. К сожалению, такой подход к быстрому получению денежных средств увеличил темпы обезлесения, что отрицательно сказалось на дикой природе и экосистемах этих территорий.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калийных удобрений с помощью горнодобывающих и производственных процессов. Основное предложение поступает из Саскачевана, Канада, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого получают хлорид калия.
Основное предложение поступает из Саскачевана, Канада, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого получают хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также считается одним из самых богатых в мире запасов калийных удобрений и потенциально может стать крупным экспортером этого минерала.Однако разработка этого участка была отложена из-за общественного протеста. Многие сельские жители, которые живут непосредственно над предполагаемым участком рудника, выразили обеспокоенность по поводу неблагоприятных последствий, таких как проседание земли и засоление грунтовых вод и почвы. Эти последствия могут поставить под угрозу экономическую стабильность местных сообществ, выживание которых зависит в первую очередь от выращивания риса.
См. Также
Банкноты
- ↑ Potash USGS Minerals Information .
 Проверено 9 октября 2007 года.
Проверено 9 октября 2007 года.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Внешние ссылки
Все ссылки получены 13 июня 2019 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства.Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Калий — Энциклопедия Нового Света
Термин калий имеет несколько значений. В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые могут быть добыты или произведены. [1]
Калий использовался с древних времен при производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название образовано путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Разные значения
Термин стал несколько двусмысленным из-за замены удобрений более дешевыми солями калия, такими как хлорид калия (KCl) или оксид калия (K 2 O), к которым теперь иногда применяется то же самое общее название. Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Кроме того, гидроксид калия (КОН) обычно называют едким калием , что является дополнительным источником путаницы.
Различные химические соединения, содержащие калий, имеют слово potash в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий калий или калийный щелок | гидроксид калия | КОН |
| карбонат калия, винный камень или перлаш | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века калий был одним из важнейших химических веществ на промышленно развитом Западе. Добываемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 1790 году Сэмюэлю Хопкинсу на усовершенствование создания «Калийной золы и жемчужной золы с помощью нового устройства и процесса».
Добываемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 1790 году Сэмюэлю Хопкинсу на усовершенствование создания «Калийной золы и жемчужной золы с помощью нового устройства и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калийных удобрений дало североамериканским поселенцам возможность получить крайне необходимые денежные средства и кредит, поскольку они расчищали свои лесные земли для посева. Чтобы полностью использовать свою землю, необходимо было избавиться от лишней древесины, включая пни.Самый простой способ добиться этого — сжечь дрова, не нужные для топлива или строительства. Из золы лиственных деревьев производили щелок (гидроксид калия), который, в свою очередь, использовали для изготовления мыла или кипятили для производства поташа.
Древесина твердых пород может образовывать золу из расчета от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³ / км²)). В 1790 году золу можно было продать по цене от 3,25 до 6,25 доллара за акр (от 800 до 1500 долларов за квадратный километр) в сельской местности штата Нью-Йорк — почти столько же, сколько нанять рабочего для расчистки той же территории.
В 1790 году золу можно было продать по цене от 3,25 до 6,25 доллара за акр (от 800 до 1500 долларов за квадратный километр) в сельской местности штата Нью-Йорк — почти столько же, сколько нанять рабочего для расчистки той же территории.
Очищенный калий пользуется растущим спросом в Европе для использования в производстве стекла и керамических изделий. Утверждается, что американские лиственные породы не только более многочисленны, но и дают более высокий выход качественного поташа, чем европейская древесина. В некоторых регионах калийные расписки стали обычной формой валюты. Некоторые поселенцы считали производство калийных удобрений довольно прибыльным. К сожалению, такой подход к быстрому получению денежных средств увеличил темпы обезлесения, что отрицательно сказалось на дикой природе и экосистемах этих территорий.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калийных удобрений с помощью горнодобывающих и производственных процессов. Основное предложение поступает из Саскачевана, Канада, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого получают хлорид калия.
Основное предложение поступает из Саскачевана, Канада, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого получают хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также считается одним из самых богатых в мире запасов калийных удобрений и потенциально может стать крупным экспортером этого минерала.Однако разработка этого участка была отложена из-за общественного протеста. Многие сельские жители, которые живут непосредственно над предполагаемым участком рудника, выразили обеспокоенность по поводу неблагоприятных последствий, таких как проседание земли и засоление грунтовых вод и почвы. Эти последствия могут поставить под угрозу экономическую стабильность местных сообществ, выживание которых зависит в первую очередь от выращивания риса.
См. Также
Банкноты
- ↑ Potash USGS Minerals Information .
 Проверено 9 октября 2007 года.
Проверено 9 октября 2007 года.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Внешние ссылки
Все ссылки получены 13 июня 2019 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства.Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Калий — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: калий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе рассказывается история о первом выделенном щелочном металле, почему это вообще щелочной металл и почему его символ начинается с буквы K.Вот Питер Уотерс.
Питер Уотерс
Калий — единственный элемент, названный в честь кухонной утвари. Он был назван в 1807 году Хамфри Дэви в честь соединения, из которого он выделил металл, калий или гидроксид калия.
В выдержке из 1730-х годов голландского химика Германа Бурхаве описывается, как калий получил свое название:
«Калий или горшечная зола ежегодно в большом количестве привозится торговыми судами из Корланда (ныне часть Латвии и Литвы), Россия. , и Польша.Его готовят там из древесины зеленой пихты, сосны, дуба и т. и когда верхний ликер, содержащий соль, очищается, т. е. освобождается от примесей при стоянии, он сливается прозрачным. Затем его сразу же помещают в большие медные горшки и варят там в течение трех дней, с помощью которых они добывают соль, которую они называют Potas (что означает горшечный пепел), поскольку она таким образом была сделана в горшках. .
Еще раньше, в 16 веке, Конрад Геснер сообщает нам, что «Из херба по имени Кали, doe certayne готовят соль»
Он описывает это растение, Kali , латинское название которого Salsola kali , но больше широко известный как Saltwort:
« Kali состоит из двух Cubites heygth, не имеет колючек или шипов, и иногда очень красный, соленый на вкус, с глубоким запахом, найденный и собранный в соленых местах: из которых , можно купить соль щелочи «
Его метод производства этой соли щелочи очень похож на тот, который описал Бургаве, причем оба процесса фактически дают нечистую смесь того, что мы сейчас назвали бы карбонатом калия и натрия; метод древесной золы, дающий больше карбоната калия, поташа, соленых трав, дающих больше карбоната натрия, соды. Однако именно от травы кали мы обязаны словом, которое описывает оба — ал-кали или щелочь; префикс «al» — это просто арабский определенный артикль «the».
Однако именно от травы кали мы обязаны словом, которое описывает оба — ал-кали или щелочь; префикс «al» — это просто арабский определенный артикль «the».
Неочищенный калий можно сделать более едким или «чистым» путем обработки его раствора известковой водой, гидроксидом кальция. Растворы карбоната калия и гидроксида кальция вступают в реакцию с небольшой химической заменой партнеров: нерастворимый карбонат кальция или мел выпадает в осадок, оставляя раствор гидроксида калия. Именно из этого чистого гидроксида Дэви впервые выделил металлический калий.Для этого он использовал относительно новую силу электричества.
После безуспешной попытки электролиза водных растворов поташа, во время которой ему удалось только разбить воду, он решил, что ему нужно избавиться от воды и попытаться электролизовать расплавленный гидроксид калия. Он сделал это шестого октября 1807 года, используя большую вольтовскую сваю, которую он построил в Королевском институте в Лондоне. Его младший двоюродный брат, Эдмунд Дэви, помогал Хамфри в то время, и он рассказывает, как, когда Хэмфри впервые увидел, что «крошечные шарики калия прорвались сквозь корку поташа и загорелись при входе в атмосферу, он не смог сдержать свою радость». .
.
Дэви имел полное право восхищаться этим удивительным новым металлом: он выглядел так же, как другие яркие, блестящие металлы, но его плотность была меньше, чем у воды. Это означало, что металл будет плавать по воде — по крайней мере, так будет, если он не взорвется при контакте с водой. Калий настолько реактивен, что даже прореагирует и прожигает дыру во льду. Это был первый выделенный щелочной металл, но Дэви продолжил выделение натрия, кальция, магния и бария.
В то время как Дэви назвал свой новый металл калием в честь поташа, Берцелиус, шведский химик, который изобрел международную систему химических символов, используемых в настоящее время химиками во всем мире, предпочел для металла название калий, которое лучше отражает его истинное происхождение, думал он. . Следовательно, из-за небольшой соленой травы мы теперь получаем символ K для элемента зола, калия.
Крис Смит
Кембриджский химик Питер Уотерс. В следующий раз красиво, но смертельно опасно — вот название игры.
Bea Perks
Мышьяк получил свое название от персидского слова, обозначающего желтый пигмент, ныне известный как аипимент. Для увлеченных лексикографов, очевидно, персидское слово Зарних, о котором идет речь, впоследствии было заимствовано греками для их слова арсеникон, что означает мужской род или могущественный. Что касается пигментации, то обои Наполеона незадолго до его смерти, как сообщается, имели так называемый зеленый цвет Шееле, который выделял пары мышьяка, когда становился влажным.
Крис Смит
Настолько мощно это или нет, но облизывать обои в квартирах Наполеона определенно не стоит.Это Беа Перкс, которая будет с нами в следующий раз, чтобы рассказать нам смертельную историю о мышьяке. Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
Как крупный международный издатель
академических и исследовательских журналов Science Alert издает
и разрабатывает названия в партнерстве с самыми
престижные научные общества и издатели. Наша цель
заключается в том, чтобы максимально широко использовать качественные исследования.
аудитория. Наша цель
заключается в том, чтобы максимально широко использовать качественные исследования.
аудитория. | ||||||
| Мы прилагаем все усилия, чтобы поддержать исследователей которые публикуют в наших журналах. Есть масса информации здесь, чтобы помочь вам публиковаться вместе с нами, а также получить ценные услуги для авторов, которые уже публиковались у нас. | ||||||
2021 цены уже доступны. Ты
может получить личную / институциональную подписку перечисленных
журналы прямо из Science Alert. В качестве альтернативы вы
возможно, пожелает связаться с выбранным вами агентством по подписке.
Направляйте заказы, платежи и запросы в службу поддержки клиентов
в службу поддержки клиентов журнала в Science Alert. Ты
может получить личную / институциональную подписку перечисленных
журналы прямо из Science Alert. В качестве альтернативы вы
возможно, пожелает связаться с выбранным вами агентством по подписке.
Направляйте заказы, платежи и запросы в службу поддержки клиентов
в службу поддержки клиентов журнала в Science Alert. | ||||||
| Science Alert гордится своей тесные и прозрачные отношения с обществом. В виде некоммерческий издатель, мы стремимся к самым широким возможное распространение публикуемых нами материалов и на предоставление услуг высочайшего качества нашим издательские партнеры. | ||||||
Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную форму в Интернете. В зависимости от характера вопросов мы разделили часто задаваемые вопросы на разные категории. В зависимости от характера вопросов мы разделили часто задаваемые вопросы на разные категории. | ||||||
| Азиатский индекс научного цитирования (ASCI) стремится предоставить авторитетный, надежный и значимая информация по освещению наиболее важных и влиятельные журналы для удовлетворения потребностей мировых научное сообщество.База данных ASCI также предоставляет ссылку к полнотекстовым статьям до более чем 25000 записей с ссылка на цитированные ссылки. | ||||||
Гидроксид калия: применение, взаимодействие, механизм действия
Гидроксид калия — это дезинфицирующее средство, используемое для мытья рук, кожи и поверхностей.
Гидроксид калия, также известный как щелок , представляет собой неорганическое соединение с химической формулой KOH .Также обычно называемый каустическим калием , это мощная основа, которая продается в нескольких формах, включая гранулы, хлопья и порошки. Он используется в различных химических, промышленных и производственных приложениях. Гидроксид калия также является предшественником других соединений калия. Гидроксид калия используется в пищевых продуктах для регулирования pH, как стабилизатор и как загуститель. 6,10 Этот ингредиент был признан Управлением по контролю за продуктами и лекарствами в целом безопасным, как непосредственный пищевой ингредиент для человека, на основании соблюдения нескольких условий надлежащей производственной практики. 4
Помимо перечисленных выше применений, гидроксид калия также используется в производстве мыла, в качестве электролита в щелочных батареях, а также в гальванике, литографии и средствах для удаления краски и лака. Очистители канализации содержат от 25 до 36% гидроксида калия 6 .
Очистители канализации содержат от 25 до 36% гидроксида калия 6 .
В медицине гидроксид калия (КОН) широко используется для влажной подготовки различных клинических образцов для микроскопической визуализации грибков и грибковых элементов на коже, волосах, ногтях и даже вагинальных выделениях 1 , 6 .
Недавно были изучены его эффективность и переносимость при лечении бородавок. Было установлено, что местный раствор КОН оказался безопасным и эффективным средством лечения плоских бородавок 2 .
- Вес
- Среднее значение: 56,1056
Моноизотопное соединение: 55,966446515 907 907 907 907 907 907 907 907 907 Химическая формула Синтез де калия
под микроскопом диагностика грибковых гиф или трихомонад 9 900 10.
Образцы волос, кожи или ткани ногтей получают путем соскабливания скальпелем с аппликатором с ватным наконечником и вносят непосредственно в раствор КОН 9 .
В дополнение к вышеперечисленному, гидроксид калия используется в качестве пластификатора ногтевых канавок 8 .
Снижение количества неудач при разработке лекарств
Создание, обучение и проверка моделей машинного обучения с использованием структурированных наборов данных, основанных на фактических данных.
Создавайте, обучайте и проверяйте прогнозные модели машинного обучения с помощью структурированных наборов данных.
Избегайте опасных для жизни побочных эффектов лекарственных препаратов
Улучшите поддержку принятия клинических решений с помощью информации о противопоказаниях и предупреждениях о «черных ящиках», ограничениях для населения, ограничениях для населения & более.
Избегайте опасных для жизни побочных эффектов лекарств и улучшайте поддержку принятия клинических решений.
Коррозионная активность гидроксида калия делает его очень полезным агентом при разложении / удалении мягких тканей и удалении волос.Он входит в состав некоторых продуктов для ногтей, кремов для бритья и мыла 13 .
Точный механизм действия КОН не известен, но предполагают, что местное применение КОН переваривает кератин и вызывает воспаление 7 .
Механизм повреждения кожи щелочными веществами, такими как гидроксид калия, заключается в омылении жира, в результате чего жировая ткань теряет свою функцию с повышенным повреждением из-за тепловой реакции.Извлечение воды из клеток происходит за счет гигроскопичности (абсорбента) щелочи. Также происходит растворение белков, что способствует более глубокому проникновению ионов ОН- и приводит к различным химическим реакциям 14 .
Щелочь быстро проникает в кожу, омыляет плазматические мембраны, денатурирует белки коллагена и приводит к тромбозам сосудов в конъюнктиве и других частях глаза. В результате ожоги роговицы включают рубцевание и помутнение роговицы, что приводит к потере зрения, неоваскуляризации роговицы, образованию язв и перфорации.Другие последствия нелеченных или очень тяжелых ожогов щелочью включают эрозии эпителия, вторичную глаукому и разрушение клеток слизистой конъюнктивы, вызывая сухость глаз, трихиаз (неправильно направленное волосков на ресницах) и другие заболевания глаз 14 .
В желудочно-кишечном тракте при приеме внутрь могут возникнуть ожоги. Механизм травмы — разжижающийся некроз. Тромбоз желудочно-кишечных сосудов также способствует повреждению тканей. Когда щелочь попадает в желудок, желудочная кислота может нейтрализовать сильное основание, что может ограничить степень повреждения.Перфорация желудка иногда может возникать при перитоните и каустическом поражении окружающих органов, включая толстую кишку, поджелудочную железу, печень и селезенку 14 .
KOH в водных растворах полностью диссоциирует на ионы K + и OH-. Из-за нейтрализации OH- с помощью HCl желудочного сока и быстрого действия по регуляции pH крови (буферная способность внеклеточных жидкостей организма, респираторные и почечные механизмы компенсации), возникает алкалоз из-за ионов OH- после перорального приема КОН в нераздражающих условиях. таким образом предотвратил 3 .
Поглощение калия в форме гидроксида калия намного меньше, чем пероральное потребление с терапевтическими дозами KCl для лечения дефицита калия, до 10 г / день. Кроме того, пероральное потребление калия из пищевых / природных источников или из пищевых добавок, вероятно, также будет намного выше 3 .
Недоступно
Недоступно
КОН в водном растворе полностью диссоциирует на ионы K + и OH-.Из-за нейтрализации ОН- желудочной HCl и быстрых и эффективных механизмов регуляции pH крови (буферная способность внеклеточных жидкостей организма, респираторные и почечные механизмы компенсации), алкалоз из-за ионов ОН- после перорального приема КОН в не- раздражающие состояния предотвращены 14 .
Недоступно
Недоступно
Недоступно
Улучшить структуру принятия решений и результаты исследований данные о побочных эффектах, в том числе: предупреждений в виде черного ящика, побочные реакции, предупреждения и меры предосторожности, а также показатели заболеваемости.
Улучшите поддержку принятия решений и результаты исследований с помощью наших структурированных данных о побочных эффектах.
В настоящее время исследований токсичности гидроксида калия 14 на репродуктивную / онтогенетическую токсичность не проводилось.
Ld50 гидроксида калия у крыс колеблется от 0,273 до 1,230 г КОН / кг массы тела / день 3 .
Побочные эффекты включают рвоту, диарею, образование пузырей, желудочно-кишечные расстройства и ожоги. 5 .
5 .
Сильные щелочные химические вещества, такие как гидроксид калия, разрушают мягкие ткани, могут вызвать глубокий проникающий ожог. Каустики обычно представляют собой гидроксиды легких металлов. Гидроксид натрия и гидроксид калия являются наиболее широко используемыми едкими добавками в промышленности 11 .
Гидроксид калия может раздражать легкие. Повторное воздействие может вызвать развитие бронхита с кашлем, выделением мокроты и / или одышкой 9 .
Приготовление калийных квасцов — Swiflearn
Нажмите, чтобы оценить этот пост!
[Всего: 1 Среднее: 5]Что такое калийные квасцы?
Квасцы калия также называют сульфатом алюминия и калия — это химическое соединение, обычно встречающееся как додекагидрат.Это двойная соль, широко используемая в медицине и при очистке воды. Калийные квасцы не являются комплексной солью. Химическая формула калийных квасцов: K2SO4.Al2 (SO4) 3,24h3O.
Калийные квасцы не являются комплексной солью. Химическая формула калийных квасцов: K2SO4.Al2 (SO4) 3,24h3O.
Цель:
Для получения калийных квасцов из сульфата калия и сульфата алюминия путем кристаллизации.
Теория:
Формула для калийных квасцов: K2SO4.Al2 (SO4) 3,24h3O. Его получают путем кристаллизации квасцов из концентрированного раствора, содержащего эквимолярные количества сульфата калия и сульфата алюминия.Это бесцветное кристаллическое вещество с кислым вкусом. Кристалл калийных квасцов октаэдрический. Это широко известно как «фиткари».
Химическая реакция приведена ниже —
K2SO4 (водн.) + Al2 (SO4) 3 (водн.) → K2SO4. Al2 (SO4) 3,24h3O (s) (Калийные квасцы)
При растворении сульфата алюминия в теплой воде добавляют небольшое количество разбавленной серной кислоты, чтобы предотвратить гидролиз этой соли.
Когда раствору двух неорганических солей в определенной пропорции дают возможность кристаллизоваться, говорят, что двойная пластина разделилась. Алюминий — самый распространенный металл, и переработка алюминиевых изделий путем плавления и переработки в другие металлические изделия используется в производстве различных соединений алюминия. Одно из самых полезных соединений — это калийные квасцы.
Алюминий — самый распространенный металл, и переработка алюминиевых изделий путем плавления и переработки в другие металлические изделия используется в производстве различных соединений алюминия. Одно из самых полезных соединений — это калийные квасцы.
Необходимые материалы:
1. Сульфат калия
2. Сульфат алюминия
3. Разл. серная кислота
4. Вода дистиллированная
5. Стакан
6. Колба коническая
7.Штатив
8. Воронка
9. Горелка
10. Китайское блюдо
11. Сетка проволочная
12. Фильтровальная бумага
Процедура:
1. Взвешивают 12,5 г сульфата калия и растворяют в минимальном количестве дистиллированной воды в химическом стакане. Перемешайте, чтобы кристаллы растворились.
2. Возьмите коническую колбу, в которой растворите 50 г сульфата алюминия в теплой воде и добавьте 3 мл разбавленной серной кислоты, чтобы раствор стал прозрачным.
3. Отфильтруйте решения, если они непонятны.
4. Смешайте два прозрачных раствора в фарфоровой посуде.
5. Поставьте фарфоровую форму на проволочную сетку над горелкой.
6. Перемешайте раствор и концентрируйте раствор до точки кристаллизации.
7. Поместите раствор в стакан с холодной водой на несколько часов.
8. Кристаллы калийных квасцов отделяются, затем отфильтровываются от маточного раствора и промываются небольшим количеством холодной воды.
9. Высушите кристаллы, осторожно нажав между складками фильтровальной бумаги.
10. Взвесьте их на химических весах, чтобы узнать выход.
Наблюдения:
Это бесцветный кристалл октаэдрической формы. Легко растворяется в воде. Это может превратить синюю лакмусовую бумажку в красную.
Меры предосторожности:
Чтобы предотвратить гидролиз сульфата алюминия, при приготовлении насыщенного раствора следует добавить разбавленную серную кислоту.