вес, размеры и цена в Москве
Маркировка изделия
Согласно ГОСТ 13579-78 название «ФБС 24.4.6-Т» расшифровывается следующим образом:
- ФБС — фундаментный блок сплошной
- 24 (первая цифра) — длина блока в метрах
- 4 (вторая цифра) — ширина блока в метрах
- 6 (третья цифра) — высота блока в метрах
- Т — тяжелый бетон. Если эта маркировка в названии отсутствует, то фундаментный блок выполнен из других видов бетона, информация о котором указана в техническом паспорте на изделие
Все изделия ФБС, выпускаемые компанией «Евроконтракт», снабжаются техническим паспортом, содержащим следующий минимум информации:
- дата изготовления ФБС;
- ГОСТ
- Морозостойкость и водонепроницаемость бетона;
- Прочность и плотность бетона;
Фундаментные блоки ФБС 24.4.6
Строительство дома, торгового, промышленного здания начинается с фундамента.
В строительстве важным показателем является скорость и оперативность работ. Быстрые сроки завершения стройки. И сокращая и оптимизируя время строительства здания, следует уделить внимание выбору того типа фундамента, на возведение которого потребуется как можно меньше времени. Удачным будет выбор ленточного фундамента, при закладке которого используются сплошные фундаментные блоки, или ФБС.
Быстрая закладка фундамента с помощью бетонных блоков
Как уже говорилось выше, при закладке фундамента ленточного типа, используются сплошные фундаментные бетонные блоки ФБС. Они удобны по многим показателям:
- очень легко рассчитать количество блоков под нужную площадь основания дома;
- одинаковые размеры позволяют возводить ровный фундамент;
- блоки выдерживают большие перепады температур и воздействие атмосферных осадков;
- ФБС отличает высокая влагостойкость;
- прочность бетона, который используется в их составе позволяет выдерживать большие нагрузки от конструкций постройки и обеспечивает надежное основание здания.
 Тяжелый
Тяжелый
Именно по этой причине строители выбирают именно ленточный тип фундамента и в качестве строительного материала — фундаментные бетонные блоки. Сборные блочные ленточные фундаменты будут удачным решением для построек со стенами из кирпича или любого другого тяжелого строительного материала. Они прекрасно выдерживают вес стен и распределяют по грунту всю их нагрузку.
ФБС 24.4.6 для надежного и прочного фундамента
Среди часто используемых строителями блочных изделий для фундамента, является типовой размер 24.4.6. Сплошные бетонные блоки для фундамента ФБС 24.4.6 имеют следующие характеристики:
- длина изделия — 2380 мм;
- ширина — 400 мм;
- высота — 580 мм;
- масса составляет 1270 кг;
- объем — 0,55 м3.
Блоки имеют ровную форму и поверхность, что обеспечивает их равномерную кладку. Для удобства монтажа на ФБС предусмотрены стальные петли из стержневой горячекатаной арматуры. Все изделия на производстве проходят контроль и испытания согласно действующему ГОСТ 13579-78. Это позволяет говорить об их прочности, надежности арматурных петель и о соответствии всем строительным нормам и правилам. Этот типоразмер позволяет рассчитывать нужное количество единиц для основания постройки и легко вписывается в его площадь.
Это позволяет говорить об их прочности, надежности арматурных петель и о соответствии всем строительным нормам и правилам. Этот типоразмер позволяет рассчитывать нужное количество единиц для основания постройки и легко вписывается в его площадь.
Фундаментные блоки от компании «Евроконтракт»
Наша компания “Евроконтракт” изготавливает уже более 15 лет товарный бетон, дорожные плиты, фундаментные блоки и другие строительные материалов. Мы обеспечиваем ими строительные и дорожные компании, частные застройки по все стране. Заказать нужное количество фундаментных блоков ФБС 24.4.6 и рассчитать стоимость вы можете позвонив по номеру +7 992 999 19 19 или оставив заявку на сайте.
Фундаментные блоки ФБС — предложение нашего завода жб изделий.
Фундаментные блоки ФБС от надежного завода
При строительстве фундаментов зданий широко востребованными стали фундаментные блоки фбс. Это изделия из тяжелого бетона, позволяющие возводить основания домов с высокой несущей способностью. Наш завод предлагает купить фундаментные блоки для строительства подвальных и цокольных этажей, вся продукция строго соответствует актуальным стандартам.
Наш завод предлагает купить фундаментные блоки для строительства подвальных и цокольных этажей, вся продукция строго соответствует актуальным стандартам.
Мы гарантируем высокое качество продукции, ведь она выпускается с использованием современного оборудования. При покупке у производителя цена фундаментного блока за штуку будет выгодной, так как сможете приобрести товар без дополнительных наценок.
Сколько стоят блоки фбс?
Если хотите купить фундаментные блоки, цена будет зависеть от размеров самих изделий, заказанного количества и некоторых других условий. Наше предприятие выпускает ФБС стандартных габаритов: длина изделий может составлять 2380, 1180 или 880 мм, ширина — 300, 400, 500, 600 мм, высота — 280 или 580 мм. Разные типы изделий могут использоваться при реализации различных строительных проектов. Размеры и цену фундаментных блоков сможете уточнить у наших консультантов. Чтобы сделать заказ, позвоните по нашим номерам!
| Маркировка | Размеры (мм) | Объём (м3) | Масса (тн) | ||
| L | B | Н | |||
ФБС 24. 6.6 6.6 | 2380 | 600 | 580 | 0,82 | 1,96 |
| ФБС 24.5.6 | 2380 | 500 | 580 | 0,68 | 1,63 |
| ФБС 24.4.6 | 2380 | 400 | 580 | 0,54 | 1,30 |
| ФБС 24.3.6 | 2380 | 300 | 580 | 0,41 | 0,98 |
| ФБС 24.6.3 | 2380 | 600 | 280 | 0,47 | 1,13 |
| ФБС 12.6.6 | 1180 | 600 | 580 | 0,41 | 0,98 |
| ФБС 12.6.3 | 1180 | 600 | 280 | 0,19 | 0,46 |
| ФБС 12.5.6 | 1180 | 500 | 580 | 0,33 | 0,79 |
| ФБС 12.5.3 | 1180 | 500 | 280 | 0,16 | 0,38 |
| ФБС 12.4.6 | 1180 | 400 | 580 | 0,27 | 0,65 |
| ФБС 12.4.3 | 1180 | 400 | 280 | 0,13 | 0,31 |
ФБС 12.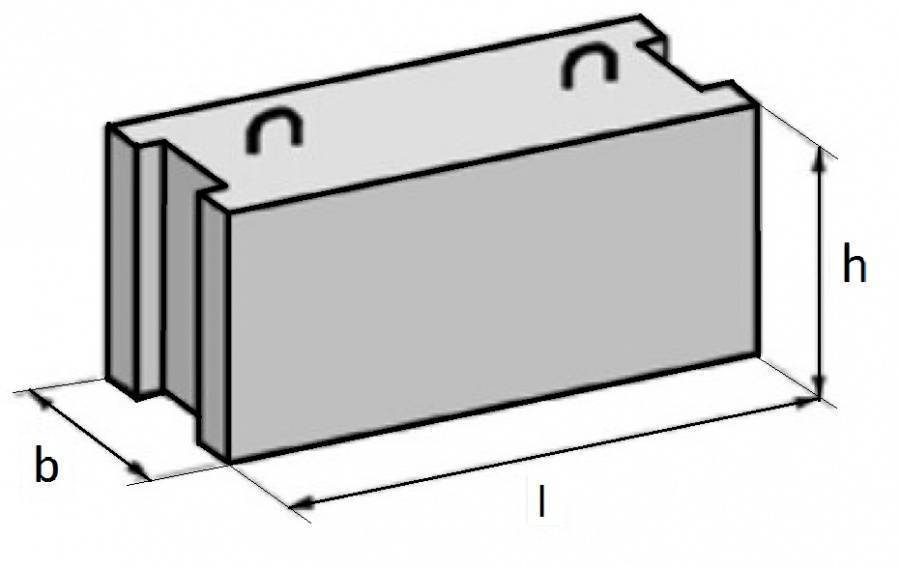 3.6 3.6 | 1180 | 300 | 580 | 0,20 | 0,48 |
| ФБС 12.3.3 | 1180 | 300 | 280 | 0,10 | 0,24 |
| ФБС 9.6.6 | 880 | 600 | 580 | 0,29 | 0,70 |
| ФБС 9.5.6 | 880 | 500 | 580 | 0,24 | 0,58 |
| ФБС 9.4.6 | 880 | 400 | 580 | 0,19 | 0,47 |
| ФБС 9.3.6 | 880 | 300 | 580 | 0,15 | 0,36 |
| ФБС 9.6.3 | 880 | 600 | 280 | 0,14 | 0,34 |
плиты перекрытия, кольца и колодцы, плиты дорожные, фундаментные блоки ФБС, сваи, бордюры, перемычки
Полный ассортимент железобетонных изделий
Наша компания занимается распространением всех видов железобетонной продукции по самым низким ценам. Мы производим поставки как в Москву и Московскую область, так и во многие другие регионы Российской Федерации.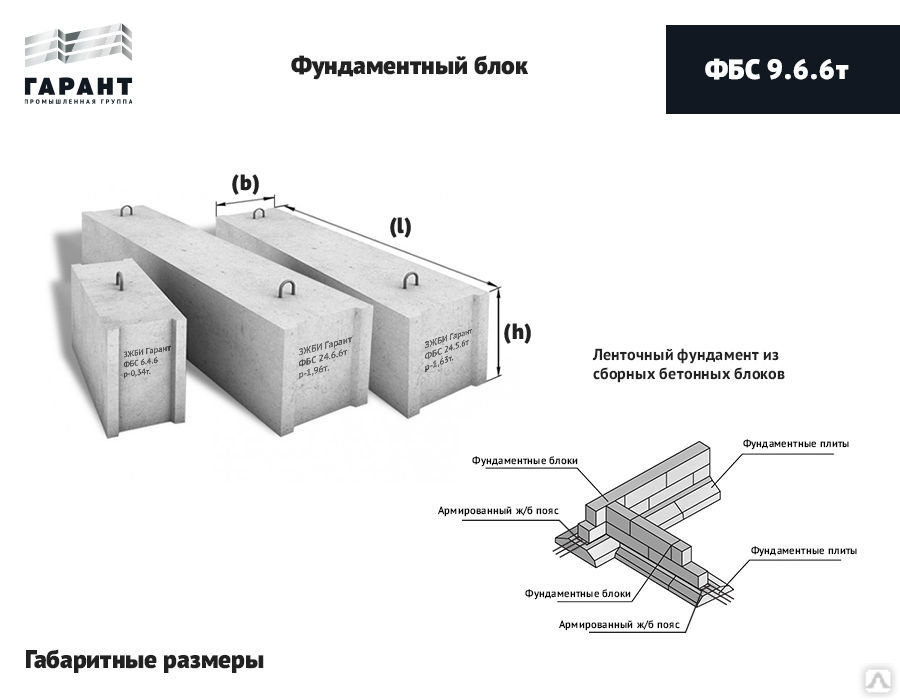
В нашем каталоге вы сможете найти все, что может понадобиться для строительства, не зависимо от того, что вы строите, дачные колодцы или многоэтажный деловой центр. Ассортимент включает в себя плиты перекрытия, плиты дорожные, строительные блоки, железобетонные панели, перемычки, колодезные кольца и дно колодца. Если вам требуется ЖБИ изделие по вашим уникальным размерам – мы с радостью возьмемся за реализацию по вашим чертежам.
Качество предлагаемых железобетонных изделий – гарантировано! Мы сотрудничаем только с лучшими заводами по производству ЖБИ продукции, где трепетно относятся к соблюдению всех требований и стандартов.
Начните работу с нами со звонка на наш телефон:
8 (495) 937-56-71
Позвонив нам, вы получите:
информацию о ценах;
информацию об условиях работы с нами;
информацию о действующих скидках и бонусах;
помощь в подборе необходимой вам продукции;
подробные инструкции для работы с нами.

Мы будем рады вашему звонку и надеемся, что у нас сложатся долгие и взаимовыгодные отношения.
Плиты перекрытия
Плиты перекрытия: производство. Пустотные плиты перекрытия.
Изготовляют плиты перекрытия из железобетона. Марка бетона для плит перекрытия избирается в зависимости от условий климата, места и технологии установки.
Для уменьшения веса изготовляют плиты перекрытия с пустотами разных форм — это позволяет экономить материал. Кроме того, благодаря этой технологии, улучшаются шумо- и вибропоглощающие характеристики плит.
Разновидности плит перекрытия
Плиты перекрытия в строительстве. Облегченные плиты перекрытия
Плиты перекрытия используют при строительстве жилых, общественных и промышленных зданий. С помощью них возможно построить здание любой сложности и высоты.
Для строительства и реконструкции зданий, требующих легкости конструкции, производят специальные плиты перекрытия из полистиролбетона. Особые включения делают такие плиты перекрытия из подобного бетона очень легкими.
Особые включения делают такие плиты перекрытия из подобного бетона очень легкими.
Колодцы и кольца для колодца
Колодцы: устройство и применение
Колодцы собирают из специальных железобетонных колец для колодца, которые образуют горловину и ствол. Все кольца для колодца имеют специальные выемки-замки, которые нужны, чтобы упростить монтаж и повысить прочность колодца. Также в колодцах устанавливают днище и крышку из железобетона.
Колодцы применяют для обустройства систем водоснабжения, канализации, газопровода, кабельных систем и дренажа.
В зависимости от назначения существует и разделение колодцев на виды.
Различают колодцы:
Кольца для колодца
В соответствии с назначением колодцев используют кольца из разных марок бетона и с разными диаметрами.
На заводе изготовляют кольца для колодца диаметром от 70 см до 200 см (самые маленькие для прокладки проводов и сетей, самые большие для обустройства системы водоснабжения). Высота колец для колодца может варьироваться от 15 до 90 см.
Качество изготовления колец для колодцев регулирует ГОСТ 8020-90.
Плиты дорожные
Основа любой дороги – дорожная плита
Дорожная плита – это база для качественного и долговечного дорожного полотна, ж/д или трамвайных путей, взлетных полос аэродромов. Кроме того, плиты дорожные находят применение в строительстве автобанов.
Плиты дорожные – контроль качества
Дорожная плита должна быть прочной и износостойкой, ведь от этого зависят долговечность и безопасность дорожного полотна. Именно поэтому к ним предъявляют высокие требования. Дорожные плиты производят в соответствии со стандартами СНиП, а также различными государственными отраслевыми стандартами. Действуют следующие стандарты, касающиеся дорожных плит:
- для аэродромных дорожных плит существует ГОСТ 25912.0-ГОСТ 25912.3,
- дорожные плиты, используемые в строительстве городских дорог ГОСТ 21924.0-ГОСТ 21924.1,
- плита дорожная для трамвайных путей должна соответствовать ГОСТ 19231.
 0- ГОСТ 19231.1.
0- ГОСТ 19231.1.
Многократное использование дорожных плит
Качество и долговечность, которыми отличается дорожная плита, позволяют использовать ее многократно. То есть б/у дорожные плиты, остающиеся посла разбора дороги, которая потеряла свое значение, можно применять повторно. Для строительства дорог и площадок используют дорожные плиты из железобетона. Такие дорожные плиты позволяют в самые короткие сроки построить качественную автодорогу. Благодаря прочности дорожных плит, дорога выдерживает не только автомобили, но и тяжелую грузовую технику.
Фундаментные блоки ФБС
Фундамент из блоков ФБС
Фундамент — один из важнейших этапов строительства любого здания. А один из самых простых и удобных способов возведения фундамента — это использование готовых фундаментных блоков ФБС.
Фундаментные блоки обеспечивают необходимые долговечность и прочность для основы здания. Притом блоки ФБС можно использовать на любом типе грунта. Фундамент, построенный из фундаментных блоков, ничуть не хуже, а во многих случаях и лучше, монолитного выполняет свою основную функцию — распределение нагрузки веса здания на основание постройки.
Фундаментные блоки в строительстве стен
Также фундаментные блоки можно использовать для строительства стен.
Блоки ФБС для стен делают обычно полыми. Благодаря этому фундаментные блоки становятся легче, тепло- и звукоизоляционные характеристики улучшаются, а материал — экономится.
Производство фундаментных блоков ФБС
Фундаментные блоки ФБС производят из высокопрочного тяжелого железобетона. Для их укрепления чаще всего используют сталь А-1 и А-111.
Выпускаются фундаментные блоки различных размеров — для разных видов почв.
На сегодняшний день выпускаются блоки ФБС не только в привычной всем форме параллелепипеда — возможно изготовление фундаментных блоков любой формы и массы для любых проектов на заказ.
Железобетонные изделия, которые мы предлагаем нашим клиентам, изготовлены на ведущих заводах России по всем государственным стандартам, установленным на все виды ЖБИ. К тому же железобетонные изделия тестируются у нас, поэтому мы гарантируем качество и точность в размерах.
Поиск номерных знаков — регистрация FBS
Покупка заветных номерных знаков с номерными знаками
При покупке номерных знаков мы возьмем на себя все заботы за вас, так как наша преданная и опытная команда сделает процесс передачи максимально простым. Мы заполним для вас необходимые документы, включая ваши автомобили V5 и действующий сертификат MOT. Это означает, что вы можете наслаждаться своим новым персонализированным номерным знаком без стресса и хлопот, связанных с запутанными документами.Наша репутация говорит сама за себя, у нас есть рейтинг 5/5 на Reviewcentre и лучшие отзывы о нашем магазине ebay.
Мы являемся зарегистрированными торговыми посредниками DVLA, признанными и поддерживаемыми самими DVLA. Как «RNPS» (номер лицензии 47727) мы можем поставлять номерные знаки в соответствии со всеми правилами DVLA и MOT. Это означает, что вы можете быть уверены, что ваша покупка будет обработана профессионально и что мы доставим именно то, что вы заказываете.
Что говорят наши клиенты
«Услуги 1-го класса от первоначального запроса до оформления документов. Без колебаний рекомендую или воспользуюсь снова. Никогда не думал, что покупка частной тарелки может быть такой простой и прямой». — Стюарт на Trustpilot.
«Абсолютно профессионально, как я и надеялся. Первоклассная связь по электронной почте, а также устно, когда я звонил, чтобы проверить детали. Хорошая цена, за которой следует гораздо больше, например, очень хорошо сделанные тарелки, отправленные в специальный мягкий конверт; и именно это «правильное понимание» побуждает меня присуждать пять звезд и искренне рекомендовать их.Отличная работа!» — Мистер Битти на Trustpilot.
«Когда увидел отзывы, подумал, что это слишком хорошо, чтобы быть правдой. Сюрприз, сюрприз, Regplates сделали именно то, что обещали. Купил рег номер, планшеты пришли за 3 дня, все сделали за 5 рабочих дней.
Номерные знаки имеют более 99% всех доступных номерных знаков, доступных для покупки онлайн 24 часа в сутки. Мы являемся членами ассоциаций торговых дилеров MIRAD, APRT и CNG.
Если вы хотите продать личный номерной знак, наш персональный отдел оценки номерных знаков может предоставить вам точную рыночную стоимость вашего регистрационного номера по почте или по электронной почте.
Персонализированные заветные номерные знаки
С момента своего скромного появления в 1903 году заветные числа продолжали набирать популярность, часто добавляя последний штрих к нашему ценному имуществу и очень часто оказываясь ценным вложением.
Первый в истории номерной знак А1 присвоен в 1903 г. |
|---|
Закон об автомобилях 1903 года, вступивший в силу 1 января 1904 года, требовал, чтобы все автомобили были зарегистрированы в официальном реестре транспортных средств и имели номерные знаки. Закон был принят для того, чтобы транспортные средства можно было легко отследить в случае аварии или нарушения закона.Регистрационные номерные знаки транспортных средств в Великобритании имеют прямоугольную или квадратную форму, а точные разрешенные размеры номерного знака и его надписи установлены законом.
Новые гибкие стальные пластины для 3D-принтера из смолы | Новый FBS для смолы
Гибкие рабочие пластины из нержавеющей пружинной стали для полимерных 3D-принтеров (2 комплекта)
Знаете ли вы, что расстраивает печать смолой? Уборка.
Снять отпечатки, не повредив ни отпечаток, ни рабочую пластину, непросто. Слишком легко отправить свой только что напечатанный настольный мини-принтер через всю комнату неуместным ударом шпателя только для того, чтобы он рухнул на пол, разбитый и печальный, лежащий в луже медленно затвердевающей смолы.
Слишком легко отправить свой только что напечатанный настольный мини-принтер через всю комнату неуместным ударом шпателя только для того, чтобы он рухнул на пол, разбитый и печальный, лежащий в луже медленно затвердевающей смолы.
К счастью, есть решение; гибкие рабочие пластины . Просто снимите их с принтера с помощью удобных язычков, дайте им пошевелиться и лопните! Ваши отпечатки приходят сразу.Кроме того, если у вас более одной гибкой пластины, вы можете начать следующую печать, очищая предыдущую. У вас будет целая армия мини в кратчайшие сроки!
Начать работу легко; вы прикрепляете сверхсильное (переменной полярности) магнитное основание к рабочей пластине вашего любимого полимерного принтера с помощью прилагаемого высокопрочного клея 3M. Это особый вид клея, который не вступает в реакцию со смолами и растворителями, но очень хорошо прилипает к металлу рабочей пластины. Как только магнит включен и клей застыл, пластина из нержавеющей стали защелкивается прямо на нем.
Выровняйте принтер, чтобы учесть дополнительную толщину, и готово! Нержавеющая сталь имеет высокое содержание хрома (это волшебный ингредиент нержавеющей стали), что защищает ее от коррозионно-активных соединений в смолах; в то время как матовая текстура нержавеющей стали гарантирует, что ваш отпечаток будет хорошо держаться на нем, что поможет предотвратить деформацию и неудачные отпечатки.
Ваш пакет будет содержать:
- 2 гибкие пластины из нержавеющей стали и пружинной стали
- 2 листа магнитной резины (с прикрепленным клеем 3M-9448A)
Примечание: при работе со смолой обязательно надевайте соответствующее защитное снаряжение; е.g нитриловые перчатки, защитные очки и средства защиты органов дыхания.
Убедитесь, что рабочий стол тщательно очищен. | |
Проверьте правильность температуры и влажности. Прежде чем начать, убедитесь, что температура окружающей среды находится в пределах 21–38 °C (67–100 °F), а влажность — в пределах 40–60 %. Если температура слишком низкая, вы можете немного нагреть рабочий стол для этого процесса. Этот температурный диапазон применим только для процесса установки. После прикрепления магнита и затвердевания клея он будет нормально работать вне этих температур. | |
Установите магнитный лист | |
Дайте клею застыть | |
Поместите пластину из нержавеющей стали на рабочий стол | |
Повторное выравнивание рабочего стола | |
Распечатать! | |
Снимите отпечатки | |
Очистите пластину и магнит и снова прикрепите их | |
Уход и обслуживание Если на вашей пластине из нержавеющей стали появилась царапина или след, тщательно очистите ее и слегка отшлифуйте мелкозернистой шлифовкой, чтобы удалить пятно. Снова очистите его изопропиловым спиртом и дайте ему полностью высохнуть.Высокая концентрация хрома в этих пластинах будет творить чудеса при воздействии кислорода, превращаясь в оксид хрома, который защищает пластину от коррозии. | |
96-луночная стеклянная нижняя пластина с высококачественным покровным стеклом #1,5
Microtubeles Gate Конденсация тау для пространственной регуляции функций микротрубочек
Ruensern Tan, et al., BioRxiv, 22 сентября 2018 г.
1A-C, S1A) проводили в 96-луночном стекле Cellvis.
Нижняя пластина (Cellvis, #P96-1.5H-N), как описано ранее »
Параллельная визуализация хемотаксиса лейкоцитов в высоком разрешении под агарозой с помощью биосенсоров Rho-семейства GTPase
GRR Bell, et al. , Rho GTPases pp 71-85, 2018
, Rho GTPases pp 71-85, 2018
Цитата: « Imaging Materials. пластина (Cellvis, каталог № P96–1.5HN или эквивалент) »
Ki67 представляет собой градуированный, а не бинарный маркер пролиферации в сравнении с состоянием покоя
I Miller, et al., Cell Reports, Volume 24, Issue 5, 31 July 2018, Pages 1105-1112
Цитата: « 96-луночный планшет со стеклянным дном , Селлвис, номер по каталогу P96-1.5HN »
Характеристика процессов репарации ДНК при транзиторных и длительных двухцепочечных разрывах ДНК с помощью иммунофлуоресцентной микроскопии
V Murthy, et al., Jove 2018
Цитата: « Посев 6 x 10 3 клеток/лунку в 200 мкл 96-луночного планшета со стеклянным дном. »
Вентральный диск представляет собой гибкую органеллу микротрубочек, которая зависит от куполообразной ультраструктуры для функционального прикрепления Giardia lamblia
Scott Charles Dawson, et al. , Biorxiv 2017
, Biorxiv 2017
96-луночный №1.5 планшетов для визуализации с черным стеклянным дном (In Vitro Scientific). »
Конкурирующие воспоминания о митогене и передаче сигналов p53 контролируют вход в клеточный цикл
HW Yang, et al., Nature 549, 404–408 (21 сентября 2017 г.)
Цитата: « Вкратце, клетки помещали в 96-луночный стакан планшет (Cellvis P96-1.5HN), предварительно гибридизованный с коллагеном »
Экспрессия поверхностного Toll-подобного рецептора 3 в метастатических эпителиальных клетках кишечника индуцирует продукцию воспалительных цитокинов и способствует инвазивности
Marit Bugge, et al., Журнал биологической химии 292, 15408-15425.
Цитата: « В исследованиях ядерной транслокации клетки HT29 высевали в 96-луночные планшеты со стеклянным дном (P96-1. 5H-N, In Vitro Scientific, Саннивейл, Калифорния) и обрабатывали только поли(I:C) »
5H-N, In Vitro Scientific, Саннивейл, Калифорния) и обрабатывали только поли(I:C) »
Энтоз вызывается глюкозным голоданием
Йенс С. Хаманн и др., Отчеты о клетках, том 20, выпуск 1, 5 июля 2017 г., страницы 201-210
Цитата: « Для визуализации клетки были высеяны на № 1.5 96-луночных планшетов со стеклянным дном (P96-1.5H-N; In Vitro Scientific) при температуре 37°C и 5% CO2 »
Защита макак-резусов от ингаляционной сибирской язвы с помощью капсульной конъюгированной вакцины Bacillus anthracis
DJ Chabot, et al., Vaccine
Дульбекко'ы
Модифицированная среда Игла с 10% инактивированной нагреванием FBS (DF10) в 96-луночном 0.стекло толщиной 15 мкм
нижние пластины (In Vitro Scientific, Sunnyvale, CA) »
Этадология количественной характеристики фотопереключения флуорофора для прогнозирования качества изображения микроскопии сверхвысокого разрешения
AM Bittel, et al. , Scientific Reports
, Scientific Reports
Цитата: « Образцы одиночных молекул были зафиксированы в 96-луночных планшетах со стеклянным дном с дном из покровного стекла #1,5 (In Vitro Scientific) »
Трехмерные культуры эпителиальных клеток молочной железы мышей
1.1. Обоснование использования моделей культивирования грызунов для понимания заболеваний человека
Биологическим исследованиям препятствует невозможность поддерживать функциональную дифференциацию органов и тканей ex vivo в течение достаточно долгого времени, чтобы можно было проводить адекватные эксперименты. Кроме того, образцы тканей человеческого происхождения немногочисленны, а этические ограничения, регулирующие их использование, требуют поиска альтернативных модельных организмов для изучения. Грызуны и особенно мыши стали предпочтительным видом для биологических исследований: они достаточно похожи на человека анатомически и физиологически, хотя различия необходимо всегда иметь в виду. Кроме того, они маленькие, с ними легко обращаться и разводить, а их короткая продолжительность жизни и высокая скорость размножения позволяют изучать процессы развития и болезни и генерировать статистически значимые наборы данных. Стандартизация исследований на мышах стала возможной благодаря получению инбредных линий лабораторных мышей. Первоначально это было важно, чтобы обойти проблемы генетической изменчивости среди животных, и поэтому позволяло более точно воспроизводить эксперименты. Генная инженерия на мышах стала еще одной вехой в биологических исследованиях.Универсальность сконструированных мышей позволяет исследователям исследовать роль определенных генов в росте, развитии и заболевании, и, таким образом, эти животные стали важными модельными системами болезней человека и важным компонентом клинических и фармацевтических исследований (1).
Кроме того, они маленькие, с ними легко обращаться и разводить, а их короткая продолжительность жизни и высокая скорость размножения позволяют изучать процессы развития и болезни и генерировать статистически значимые наборы данных. Стандартизация исследований на мышах стала возможной благодаря получению инбредных линий лабораторных мышей. Первоначально это было важно, чтобы обойти проблемы генетической изменчивости среди животных, и поэтому позволяло более точно воспроизводить эксперименты. Генная инженерия на мышах стала еще одной вехой в биологических исследованиях.Универсальность сконструированных мышей позволяет исследователям исследовать роль определенных генов в росте, развитии и заболевании, и, таким образом, эти животные стали важными модельными системами болезней человека и важным компонентом клинических и фармацевтических исследований (1).
Тем не менее, исследования на грызунах не идеальны не только потому, что они должны быть ограничены этическими принципами, но и из-за проблем системных и физиологических различий между людьми и грызунами и изменчивости среди разных линий животных, а также среди однопометников. Кроме того, создание чистых лабораторных штаммов, хотя и полезно для генетического анализа, не отражает гетерогенность человеческой популяции. Обе проблемы особенно актуальны, когда требуется большое количество образцов. Кроме того, эксперименты на целых животных затрудняют анализ молекулярных событий на клеточном уровне. Таким образом, использование культивируемых клеток остается необходимостью.
Кроме того, создание чистых лабораторных штаммов, хотя и полезно для генетического анализа, не отражает гетерогенность человеческой популяции. Обе проблемы особенно актуальны, когда требуется большое количество образцов. Кроме того, эксперименты на целых животных затрудняют анализ молекулярных событий на клеточном уровне. Таким образом, использование культивируемых клеток остается необходимостью.
1.2. Структура и функция молочной железы грызунов
Основная функция молочной железы – вырабатывать молоко для ребенка.Таким образом, структурной единицей функции молочной железы является ацинус: двухслойная трубка из двух типов эпителиальных клеток, которая окружает полый просвет, где молоко секретируется векторно на пути к соску через разветвленную систему протоков. Люминальные эпителиальные клетки (Leps) окружены сократительными миоэпителиальными клетками (Meps), и оба клеточных слоя инкапсулированы базальной мембраной (BM) и окружены стромой, включая иммунные клетки (см. ). Несмотря на различия между молочной железой мыши и молочной железой человека, ацинарная единица функции во многом схожа у двух видов, что делает ее подходящим заменителем функциональной единицы молочной железы человека.Наблюдения за молочной железой мыши могут быть перенесены на человеческую грудь, и этот обмен информацией был неоценим для постепенного развития систем культивирования молочной железы от монотипных 3D-культур к многоклеточным кокультурам и моделям ксенотрансплантатов in vivo.
Несмотря на различия между молочной железой мыши и молочной железой человека, ацинарная единица функции во многом схожа у двух видов, что делает ее подходящим заменителем функциональной единицы молочной железы человека.Наблюдения за молочной железой мыши могут быть перенесены на человеческую грудь, и этот обмен информацией был неоценим для постепенного развития систем культивирования молочной железы от монотипных 3D-культур к многоклеточным кокультурам и моделям ксенотрансплантатов in vivo.
Репрезентативные схемы различных стадий развития молочной железы и ацинуса молочной железы. ( a ) Схема, показывающая пять зачатков молочной железы у эмбриона вдоль молочной линии, которые позже разовьются в молочные железы.( b ) Репрезентативные рисунки различных стадий развития молочной железы, начиная с рождения, когда присутствует зачаток молочной железы, до периода полового созревания, когда ГЭБ проходят через жировую подушку и зрелые нерожавшие железы, заполненные эпителиальными протоками. Беременность и лактация моделируются, когда железа заполняется альвеолами, которые регрессируют в процессе инволюции, так что железа ремоделируется до состояния, подобного состоянию до беременности. ( c ) Репрезентативный рисунок ацинуса молочной железы: кубовидные эпителиальные клетки просвета ( светло-голубой ) окружены сократительными миоэпителиальными клетками веретенообразной формы ( розовый ) и обращены к просвету на своей апикальной стороне, где капельки молока откладываются во время лактации. на пути к протокам, которые заканчиваются в соске.Вся структура окружена базальной мембраной со стромальными клетками, включая фибробласты ( желтый ) и жировые клетки ( прозрачные круглые клетки ).
Беременность и лактация моделируются, когда железа заполняется альвеолами, которые регрессируют в процессе инволюции, так что железа ремоделируется до состояния, подобного состоянию до беременности. ( c ) Репрезентативный рисунок ацинуса молочной железы: кубовидные эпителиальные клетки просвета ( светло-голубой ) окружены сократительными миоэпителиальными клетками веретенообразной формы ( розовый ) и обращены к просвету на своей апикальной стороне, где капельки молока откладываются во время лактации. на пути к протокам, которые заканчиваются в соске.Вся структура окружена базальной мембраной со стромальными клетками, включая фибробласты ( желтый ) и жировые клетки ( прозрачные круглые клетки ).
Каждая из 3D-моделей может использоваться независимо и представляет собой физиологически значимый анализ, способный дать ответ на конкретный вопрос. Однако при использовании в качестве серии и разработке с общими компонентами эти модели становятся бесценными инструментами для выявления и тестирования механизмов, связанных с заболеванием, и позволяют разрабатывать или использовать эффективные лекарственные терапии.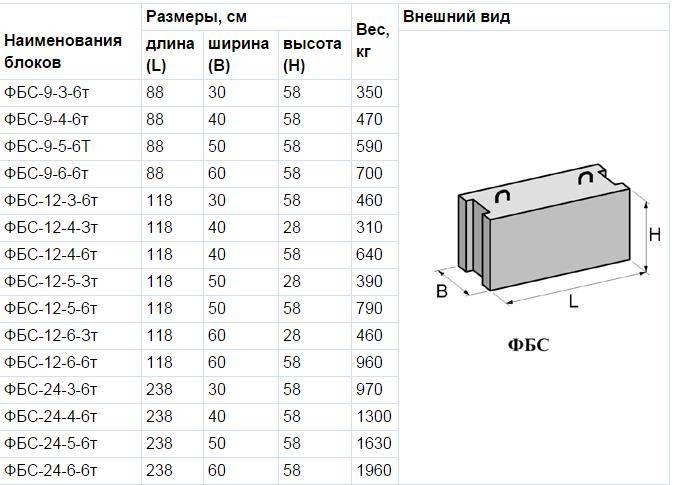 Наконец, жировая ткань молочных желез мышей может быть «очеловечена» путем повторного заселения ее клетками молочной железы человека, и тогда она может служить более точной моделью человеческого микроокружения, чтобы обойти проблемы, связанные с различиями между видами (2–4).
Наконец, жировая ткань молочных желез мышей может быть «очеловечена» путем повторного заселения ее клетками молочной железы человека, и тогда она может служить более точной моделью человеческого микроокружения, чтобы обойти проблемы, связанные с различиями между видами (2–4).
Чтобы использовать ацинус молочной железы в качестве экспериментальной модели в культуре, важно понять, как молочная железа развивается и выполняет свою функцию in vivo. У мышей есть пять пар молочных желез, которые находятся в жировых подушечках, расположенных прямо под кожей.Они простираются от грудного (три пары) до пахового (две пары) отделов животного вдоль молочной линии (см. ). Каждая жировая подушка имеет внешний сосок, соединенный с первичным эпителиальным протоком, где выделяется молоко после того, как оно выкачивается миоэпителиальными клетками из просвета ацинусов (5, 6). Развитие молочной железы происходит в две фазы: рост протоков и раннее альвеолярное развитие в период полового созревания. Кроме того, альвеолярный рост, расширение и дифференцировка происходят при каждой беременности и лактации, после чего следует период ремоделирования эпителия во время постлактационной инволюции. Перед рождением рудиментарная структура протоков, происходящая из паренхимы, распространяется в жировую ткань (5). Затем эта эпителиальная структура остается бездействующей примерно до 3-недельного возраста, когда она начинает стимулироваться гормонами яичников (7). В это время в конце молочных протоков появляется скопление эпителиальных клеток, называемых концевыми зачатками (TEB), и начинается процесс удлинения протоков (8–10), который продолжается примерно до 10–12-недельного возраста, когда время, когда TEBs достигают пределов жировой подушки и регрессируют.С началом эстрального цикла в период полового созревания железа начинает ветвиться и формируются альвеолярные зачатки. Во время беременности изменения в гормональной и локальной среде позволяют прогрессировать альвеолярному развитию и формированию железы, которая плотно заполнена альвеолярными телами (11). Одновременно эпителиальные клетки молочной железы в железе начинают приобретать свою дифференциальную способность синтезировать специфические компоненты молока, так что при родах реализуется функциональный лактогенез.
Перед рождением рудиментарная структура протоков, происходящая из паренхимы, распространяется в жировую ткань (5). Затем эта эпителиальная структура остается бездействующей примерно до 3-недельного возраста, когда она начинает стимулироваться гормонами яичников (7). В это время в конце молочных протоков появляется скопление эпителиальных клеток, называемых концевыми зачатками (TEB), и начинается процесс удлинения протоков (8–10), который продолжается примерно до 10–12-недельного возраста, когда время, когда TEBs достигают пределов жировой подушки и регрессируют.С началом эстрального цикла в период полового созревания железа начинает ветвиться и формируются альвеолярные зачатки. Во время беременности изменения в гормональной и локальной среде позволяют прогрессировать альвеолярному развитию и формированию железы, которая плотно заполнена альвеолярными телами (11). Одновременно эпителиальные клетки молочной железы в железе начинают приобретать свою дифференциальную способность синтезировать специфические компоненты молока, так что при родах реализуется функциональный лактогенез. При родах из альвеол начинается обильное выделение молока, которое продолжается около 3 недель (12–16).
При родах из альвеол начинается обильное выделение молока, которое продолжается около 3 недель (12–16).
При отлучении от груди в железе начинается процесс ремоделирования ткани (инволюция), который включает организованный апоптоз эпителиальных клеток молочной железы и ремоделирование обратно в состояние, несколько похожее, но не идентичное архитектуре железы до беременности (17–20) (видеть ). Процесс инволюции у грызунов занимает примерно 2 недели, после чего железа готова начать новый цикл беременности, лактации и инволюции.
1.3. Моделирование функциональной дифференциации и морфогенеза молочной железы в культуре
Ацинус молочной железы существует в контексте богатой среды стромы и внеклеточного матрикса (ECM), которая постоянно меняется и подвергается сигнальным сигналам от различных гормонов и факторов роста.В течение десятилетий было известно, что в то время как клетки в монослоях теряют функциональную дифференцировку даже в присутствии лактогенных гормонов, те же самые клетки, трансплантированные в свободные от желез жировые тела мышей, образуют трубчатые структуры и способны реагировать на правильные гормональные сигналы (21). , 22). Очевидно, что либо клеточное микроокружение, окружающее эпителиальные клетки молочных желез, играет существенную роль в обеспечении их функциональной дифференцировки, либо in vivo действуют системные факторы, отсутствующие в культуре.За работой Михалопулос и Пито (1976), которые использовали плавающие гели коллагена для гепатоцитов, последовали исследования Эмермана и Пительки в 70-х годах, а затем в нашей лаборатории, где использовались как плавающие гели коллагена-I (Col-I), так и богатые ламинином гели. Гели ECM (lrECM) использовали для выращивания первичных эпителиальных клеток молочной железы мышей (23–26). В отличие от клеток, культивируемых на прикрепленных гелях Col-I, эпителиальные клетки молочной железы, выращенные на флотированных коллагеновых гелях, реорганизовывались и образовывали секреторные структуры, способные к экспрессии молочных белков de novo (14, 26-28).На плавающих коллагеновых (но не плоских) гелях первичные эпителиальные клетки молочной железы (MEC), сгруппированные с базоапикальной полярностью и соединениями, экспрессировали молочный белок β-казеин, но не сывороточный кислый белок (WAP) и не образовывали просветные альвеолярные структуры.
, 22). Очевидно, что либо клеточное микроокружение, окружающее эпителиальные клетки молочных желез, играет существенную роль в обеспечении их функциональной дифференцировки, либо in vivo действуют системные факторы, отсутствующие в культуре.За работой Михалопулос и Пито (1976), которые использовали плавающие гели коллагена для гепатоцитов, последовали исследования Эмермана и Пительки в 70-х годах, а затем в нашей лаборатории, где использовались как плавающие гели коллагена-I (Col-I), так и богатые ламинином гели. Гели ECM (lrECM) использовали для выращивания первичных эпителиальных клеток молочной железы мышей (23–26). В отличие от клеток, культивируемых на прикрепленных гелях Col-I, эпителиальные клетки молочной железы, выращенные на флотированных коллагеновых гелях, реорганизовывались и образовывали секреторные структуры, способные к экспрессии молочных белков de novo (14, 26-28).На плавающих коллагеновых (но не плоских) гелях первичные эпителиальные клетки молочной железы (MEC), сгруппированные с базоапикальной полярностью и соединениями, экспрессировали молочный белок β-казеин, но не сывороточный кислый белок (WAP) и не образовывали просветные альвеолярные структуры. При культивировании в лрВКМ первичные мышиные Leps приобрели структурную организацию, подобную in vivo, секретировали молочные белки в просвет и в этих условиях они были способны экспрессировать WAP (13), но не экспрессировать даже при флотации гелей Col-I (29). ).Экспрессия WAP была возможна, потому что образовывались плотные контакты, которые были необходимы для удержания TGFα, ингибитора WAP, на расстоянии от его рецептора (EGFR). В более поздних исследованиях было показано, что ламинин-111 (LN1) является основным компонентом внеклеточного матрикса, который управляет экспрессией молочного белка (30). Культурам одиночных клеток мыши в коллагеновых гелях требовался LN1 для экспрессии β-казеина. Позже было показано, что LN1 частично модулирует экспрессию β-казеина, позволяя клеткам поляризоваться, тем самым подвергая базолатерально локализованный рецептор пролактина (PrlR) воздействию его лиганда (Prl), который сигнализирует о синтезе β-казеина (30, 31).Интересно, что исследование, проведенное в сотрудничестве с лабораторией Петерсена с использованием первичных Leps человека, показало, что Leps, культивированные внутри коллагеновых гелей, образуют кластеры такого же размера и состояния покоя, что и кластеры, сформированные внутри lrECM, но они были «наизнанку», т.
При культивировании в лрВКМ первичные мышиные Leps приобрели структурную организацию, подобную in vivo, секретировали молочные белки в просвет и в этих условиях они были способны экспрессировать WAP (13), но не экспрессировать даже при флотации гелей Col-I (29). ).Экспрессия WAP была возможна, потому что образовывались плотные контакты, которые были необходимы для удержания TGFα, ингибитора WAP, на расстоянии от его рецептора (EGFR). В более поздних исследованиях было показано, что ламинин-111 (LN1) является основным компонентом внеклеточного матрикса, который управляет экспрессией молочного белка (30). Культурам одиночных клеток мыши в коллагеновых гелях требовался LN1 для экспрессии β-казеина. Позже было показано, что LN1 частично модулирует экспрессию β-казеина, позволяя клеткам поляризоваться, тем самым подвергая базолатерально локализованный рецептор пролактина (PrlR) воздействию его лиганда (Prl), который сигнализирует о синтезе β-казеина (30, 31).Интересно, что исследование, проведенное в сотрудничестве с лабораторией Петерсена с использованием первичных Leps человека, показало, что Leps, культивированные внутри коллагеновых гелей, образуют кластеры такого же размера и состояния покоя, что и кластеры, сформированные внутри lrECM, но они были «наизнанку», т. е. имели обратную полярность. Правильная полярность могла быть установлена, если LN1 был добавлен к коллагеновым гелям (32), подтверждая роль LN1 в индукции ацинарной полярности. Неизвестно, образуют ли очищенные мышиные Leps также кластеры наизнанку в коллагене.В экспериментах, проведенных Streuli et al. (30) с нефракционированными эпителиальными клетками (т. е. содержащими как Leps, так и Meps) в коллагеновых гелях мышиные клетки были способны продуцировать эндогенный LN1, обеспечивающий необходимый лиганд для интегрина β1 и сигнализирующий о продукции молока.
е. имели обратную полярность. Правильная полярность могла быть установлена, если LN1 был добавлен к коллагеновым гелям (32), подтверждая роль LN1 в индукции ацинарной полярности. Неизвестно, образуют ли очищенные мышиные Leps также кластеры наизнанку в коллагене.В экспериментах, проведенных Streuli et al. (30) с нефракционированными эпителиальными клетками (т. е. содержащими как Leps, так и Meps) в коллагеновых гелях мышиные клетки были способны продуцировать эндогенный LN1, обеспечивающий необходимый лиганд для интегрина β1 и сигнализирующий о продукции молока.
Структурным каркасом, который окружает клетки в их естественном трехмерном окружении, является базальная мембрана (БМ), специализированная и гетерогенная сущность внутри ВКМ (33, 34). На самом деле ВКМ не является статичным автономным образованием: его состав находится под контролем физиологических эффекторов, таких как факторы роста, цитокины и гормоны, и, таким образом, постоянно меняется на стадиях развития, старения, восстановления тканей, а также во время опухолевой прогрессии. (33, 35).В свою очередь, структура ВКМ и ее составляющие регулируют рост, дифференцировку и выживание клеток в тканях. Например, в молочной железе специализированный BM, содержащий коллаген IV и ламинин-1, обеспечивает лучшую экспрессию генов, кодирующих молочные белки (36–39), но ECM, богатый Col-I, будет способствовать росту канальцев при правильной гормональной стимуляции (40–39). 42) Более подробное описание этих анализов см. в последующих подзаголовках 1.3.1 и 1.3.2.
(33, 35).В свою очередь, структура ВКМ и ее составляющие регулируют рост, дифференцировку и выживание клеток в тканях. Например, в молочной железе специализированный BM, содержащий коллаген IV и ламинин-1, обеспечивает лучшую экспрессию генов, кодирующих молочные белки (36–39), но ECM, богатый Col-I, будет способствовать росту канальцев при правильной гормональной стимуляции (40–39). 42) Более подробное описание этих анализов см. в последующих подзаголовках 1.3.1 и 1.3.2.
Сигналы от внеклеточного матрикса передаются клеткам через поверхностные рецепторы, которые переводят биохимические и механические стимулы в клеточный и ядерный ответ (30, 43).Рецепторы ECM образованы в основном белками семейства интегринов, хотя было показано, что для молочных белков также участвует дистрогликан (44). Как упоминалось ранее, рецептор пролактина также необходим для экспрессии молочных белков, и для того, чтобы эти рецепторы получали сигнал от своих лигандов, они должны присутствовать на правильной механической и структурной платформе (31, 45).
В дополнение к ECM и передаче сигналов гормонов роль соседних клеток и межклеточных взаимодействий внутри ткани важна для функциональной дифференцировки (46-48).В настоящее время системы культивирования молочных желез варьируются от монотипных моделей клеточных культур, выращенных в соответствующей трехмерной микросреде, до совместных культур Leps и Meps (32, 49) и совместных культур эпителиальных и эндотелиальных клеток, а также Leps и стромальных фибробластов (50–53). к культивированию кусочков эпителиальной ткани в различных гелях, называемых органоидными культурами (54, 55). Все еще необходимо разработать больше моделей, чтобы включить весь спектр межклеточных взаимодействий, обнаруживаемых в молочной железе.Обладая таким растущим набором систем культивирования, исследователям будет легче исследовать различные молекулярные сигнальные события, которые в противном случае были бы затруднительны для всего организма и давали бы артефакты на монослойных культурах (56) (см. Подзаголовки 1. 3.1 и 1.3). .2).
3.1 и 1.3). .2).
1.3.1. Дифференциация
Ацинус молочной железы в культуре обеспечивает надежную функциональную индикацию, а именно экспрессию молочных белков и векторную секрецию молока в просвет (13). Эта концепция была распространена на клетки человека и использовалась в качестве анализа для быстрого и воспроизводимого различения нормальных и злокачественных фенотипов (57) (для получения дополнительной информации см. сопроводительную главу Vidi et al.). Несмотря на нашу неспособность воспроизвести всю структуру органа в культуре, 3D-модели ацинуса молочной железы предоставили достаточно информации о молекулярных событиях, которые способствуют дифференцировке. Эти тесты позволили исследователям проанализировать иерархию процессов, которые устанавливают функцию ткани (58). Функциональная дифференцировка в ацинусах молочных желез включает два компонента: архитектурную реорганизацию, которая делает возможной формирование поляризованной структуры, которая, в конечном счете, обеспечивает синтез и векторную секрецию молока.
Используя методологию плавающего геля Col-I, разработанную Michalopoulos и Pitot (25), Emerman и Pitelka впервые продемонстрировали, что эпителиальные клетки молочной железы (MEC), культивированные поверх коллагеновых гелей, которым впоследствии позволили плавать, приобрели кубовидную морфологию и экспрессировали некоторые молочные белки (26). В последующем исследовании мы показали, что МЭК, культивируемые в плавающих гелях Col-I, способны становиться полярными и функциональными путем векторного осаждения коллагена-IV и LN1 на базальную поверхность плавающих гелей, что после сборки в BM позволит экспрессия de novo некоторых молочных белков, наиболее заметным из которых является β-казеин (59).Чтобы определить минимальные требования для экспрессии β-казеина и могут ли отдельные клетки молочной железы продуцировать этот молочный белок без межклеточных взаимодействий, мы культивировали первичных мышей Leps внутри коллагеновых гелей. Затем мы добавили различные молекулы BM и показали, что LN-1, но не другие белки BM, может индуцировать экспрессию β-казеина (30). Однако межклеточные взаимодействия необходимы для обеспечения экспрессии β-казеина в отсутствие экзогенно обеспечиваемого LN1 BM (30). Этот вывод коррелирует с предыдущими выводами о плавающем геле Col-I, где клетки были способны откладывать BM и производить некоторые молочные белки (26, 27).Однако при выращивании на поверхности или внутри лрВКМ первичные клетки мыши (см. ) могут экспрессировать большое количество молочных белков, включая WAP, что указывает на важность ацинарной морфологии и плотных контактов в формировании WAP и, предположительно, других специфичных для молока молекул, которые не были измерены в этих исследованиях. .
Однако межклеточные взаимодействия необходимы для обеспечения экспрессии β-казеина в отсутствие экзогенно обеспечиваемого LN1 BM (30). Этот вывод коррелирует с предыдущими выводами о плавающем геле Col-I, где клетки были способны откладывать BM и производить некоторые молочные белки (26, 27).Однако при выращивании на поверхности или внутри лрВКМ первичные клетки мыши (см. ) могут экспрессировать большое количество молочных белков, включая WAP, что указывает на важность ацинарной морфологии и плотных контактов в формировании WAP и, предположительно, других специфичных для молока молекул, которые не были измерены в этих исследованиях. .
Первичные органоиды молочной железы в 3D. ( a ) первичные молочные органоиды, выделенные из молочных желез 14-недельных нерожавших мышей, выращивают внутри / , встроенных в lrECM ( слева ) и поверх lrECM ( справа) 90 изображение с помощью светлопольной световой микроскопии на 4-й день культивирования, полоса размера 50 мкм.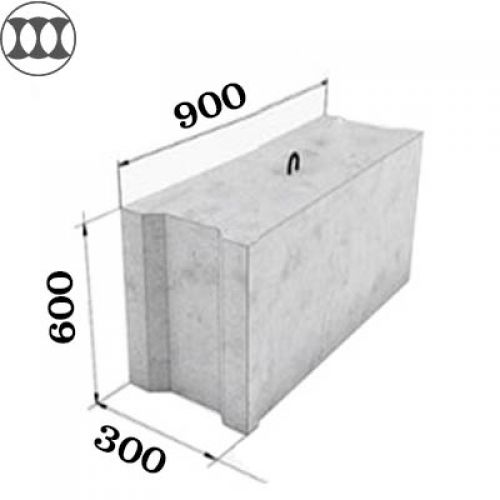 ( b ) Первичные органоиды, выделенные из молочных желез 8-12-недельных мышей, помещают в lrECM на 4 дня в среду без добавок в качестве контроля ( слева ) и стимулируют TGFα для индукции альвеолярного роста ( справа ). ( c ) Первичные органоиды, выделенные из молочных желез 8–12-недельных мышей, помещают в коллаген I (1 мг/мл) на 4 дня в качестве контроля ( слева ) и стимулируют с помощью FGF2 для индукции ветвления. формация ( справа ), калибровочная полоса, 50 мкм.
( b ) Первичные органоиды, выделенные из молочных желез 8-12-недельных мышей, помещают в lrECM на 4 дня в среду без добавок в качестве контроля ( слева ) и стимулируют TGFα для индукции альвеолярного роста ( справа ). ( c ) Первичные органоиды, выделенные из молочных желез 8–12-недельных мышей, помещают в коллаген I (1 мг/мл) на 4 дня в качестве контроля ( слева ) и стимулируют с помощью FGF2 для индукции ветвления. формация ( справа ), калибровочная полоса, 50 мкм.
Было обнаружено, что сигналы от BM и особенно от LN1 передаются главным образом через семейство гетеродимерных белков integrin и особенно через β1- и β4-интегрины (60–62). Было обнаружено, что дистрогликан (DG), еще один партнер по связыванию LN1, наряду с интегрином, необходим для индукции поляризации и экспрессии β-казеина, связанных с передачей сигналов LN1, и действует, помогая ламинину закрепляться на клеточной поверхности (63). В то время как культуры на плавающих гелях Col-I и гелях lrECM обеспечивали обильную экспрессию β-казеина, WAP, другой основной молочный белок, плохо экспрессировался даже в первичных культурах. Это связано с тем, что в отличие от β-казеина, который может экспрессироваться даже в отдельных клетках, пока присутствуют LN1 и пролактин, WAP не экспрессируется до тех пор, пока клетки не образуют полные ацинусы с плотными контактами, что позволяет отделить ингибитор WAP, TGF-α, от его рецептора. ЭФР (29, 64). Это регулируемое во времени событие, при котором плотная герметизация соединения разделяет отдельные апикальные и базальные стороны MEC, является важным шагом в завершении функциональной дифференцировки в ткани. Фактически, поляризация клеток и тканей имеет первостепенное значение для модулирования приема и передачи сигналов внутри и между клетками и вносит основной вклад в тканеспецифические функции.В ацинусе молочной железы правильная поляризация Leps гарантирует, что базальная сторона клеток получает соответствующие сигнальные сигналы от окружающих костного мозга, ECM, Meps и циркулирующих гормонов, а апикальная сторона клетки векторно доставляет молоко в просвет для дальнейшего транспорта в систему протоков по направлению к соску.
Это связано с тем, что в отличие от β-казеина, который может экспрессироваться даже в отдельных клетках, пока присутствуют LN1 и пролактин, WAP не экспрессируется до тех пор, пока клетки не образуют полные ацинусы с плотными контактами, что позволяет отделить ингибитор WAP, TGF-α, от его рецептора. ЭФР (29, 64). Это регулируемое во времени событие, при котором плотная герметизация соединения разделяет отдельные апикальные и базальные стороны MEC, является важным шагом в завершении функциональной дифференцировки в ткани. Фактически, поляризация клеток и тканей имеет первостепенное значение для модулирования приема и передачи сигналов внутри и между клетками и вносит основной вклад в тканеспецифические функции.В ацинусе молочной железы правильная поляризация Leps гарантирует, что базальная сторона клеток получает соответствующие сигнальные сигналы от окружающих костного мозга, ECM, Meps и циркулирующих гормонов, а апикальная сторона клетки векторно доставляет молоко в просвет для дальнейшего транспорта в систему протоков по направлению к соску. Тканевая полярность важна для правильной презентации поверхностных молекул и рецепторов их лигандам. Действительно, даже в случае β-казеина мы недавно снова продемонстрировали этот принцип: эпителиальные клетки молочной железы на 2D культуральном пластике в условиях, допускающих дифференцировку, были неспособны поддерживать активацию фактора транскрипции STAT5 его вышестоящим регулятором, пролактином (Prl).Исследование показало, что в этих условиях рецептор Prl локализован базально и, таким образом, недоступен для лиганда Prl, который обычно помещают в культуральную среду. Однако, когда клетки выращивали либо на неадгезивном субстрате с LN1, либо поверх гелей 3D lrECM, Prl был способен связываться с экспонированным рецептором и мог кратковременно активировать STAT5. Тем не менее, непрерывное воздействие LN1 было также необходимо для обеспечения реорганизации хроматина и поддержания активации STAT5, обеспечивающей непрерывную экспрессию молочного белка (31).
Тканевая полярность важна для правильной презентации поверхностных молекул и рецепторов их лигандам. Действительно, даже в случае β-казеина мы недавно снова продемонстрировали этот принцип: эпителиальные клетки молочной железы на 2D культуральном пластике в условиях, допускающих дифференцировку, были неспособны поддерживать активацию фактора транскрипции STAT5 его вышестоящим регулятором, пролактином (Prl).Исследование показало, что в этих условиях рецептор Prl локализован базально и, таким образом, недоступен для лиганда Prl, который обычно помещают в культуральную среду. Однако, когда клетки выращивали либо на неадгезивном субстрате с LN1, либо поверх гелей 3D lrECM, Prl был способен связываться с экспонированным рецептором и мог кратковременно активировать STAT5. Тем не менее, непрерывное воздействие LN1 было также необходимо для обеспечения реорганизации хроматина и поддержания активации STAT5, обеспечивающей непрерывную экспрессию молочного белка (31).
Используя β-казеин в качестве функционального индикатора, стало возможным разработать тесты для изучения взаимосвязи между внеклеточной средой и ядром и того, как взаимодействие между ними важно для тканеспецифических функций (31, 65–67).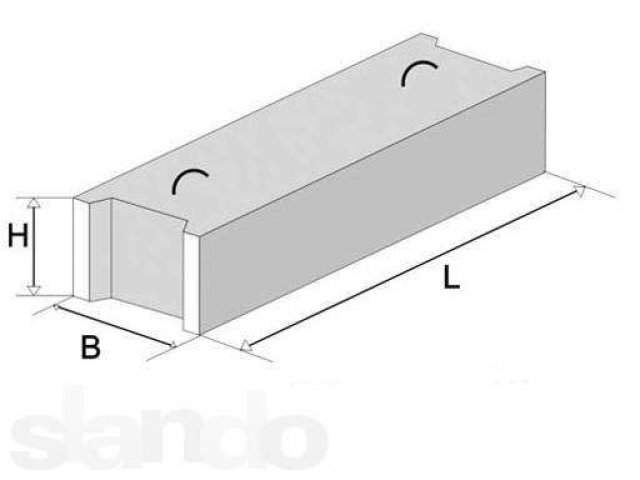 ). Мы обнаружили первый ECM-ответный элемент в промоторе гена β-казеина, а позже установили, что хроматиновый контекст и ацетилирование/деацетилирование гистонов играют существенную роль в ECM-опосредованных ядерных изменениях, которые, в свою очередь, приводят к установлению тканеспецифического гена. выражение, поддерживающее постулируемую модель «динамической взаимности» (65, 68–70).
). Мы обнаружили первый ECM-ответный элемент в промоторе гена β-казеина, а позже установили, что хроматиновый контекст и ацетилирование/деацетилирование гистонов играют существенную роль в ECM-опосредованных ядерных изменениях, которые, в свою очередь, приводят к установлению тканеспецифического гена. выражение, поддерживающее постулируемую модель «динамической взаимности» (65, 68–70).
1.3.2. Морфогенез ветвления и формирование паттерна
Морфогенез ветвления у нерожавших мышей является результатом сложного взаимодействия между клетками и внешними факторами. Более ранние исследования, проведенные в нашей и других лабораториях, установили важность ферментов ремоделирования ВКМ (металлопротеиназ: MMPs) в обеспечении инвазии в жировую ткань и ветвления эпителия молочной железы (71-73). Этот процесс может быть смоделирован в культуре путем включения эпителиальных клеток молочных желез в гели коллагена-I и стимуляции их факторами роста, которые способствуют образованию ветвей (42, 55, 74).
В описанном выше анализе нелегко исследовать роль позиционного контроля в процессе ветвления. Чтобы отделить позиционный контроль от простого роста и инвазии, мы разработали анализ с микроструктурой, в котором клетки помещались между коллагеновым «сэндвичем» и где можно было визуализировать и бинаризировать результаты 50 или более лунок, что позволяло быстро считывать и получать содержательную статистику для изучения. как позиционные сигналы диктуют начало точек ветвления (75). Используя различные геометрические контексты для размещения клеток, анализ позволил нам обнаружить, что геометрия влияет на секрецию и активацию эндогенного TGF-β, который затем будет ингибировать ветвление в зависимости от формы микропаттернов (75).
Морфогенез в железе беременных мышей протекает в форме альвеологенеза, процесса, при котором формируются дольки ацинусов, вырабатывающих молоко. Этот процесс можно смоделировать, заменив состав геля ВКМ с Col-I на лрВКМ (см. ). Это еще один пример того, как природа молекул ECM позволяет изучать уникальные аспекты роста и функциональной дифференцировки. В этом последнем анализе МЭК (первичные или укоренившиеся линии, сгруппированные, как описано ниже, или органоиды молочной железы) помещают в гель лрВКМ и стимулируют факторами роста, такими как TGF-α (76).В этих условиях эпителиальные клетки молочной железы подвергаются процессу роста и ремоделирования, который напоминает структуру «альвеол» в молочной железе (см.) во время беременности и лактации, а не ветвящихся протоков (см.). Использование анализа альвеологенеза позволило нашей лаборатории раскрыть критическую роль передачи сигналов MAPK и ее нижестоящих молекул в стимулировании альвеолярного роста (76).
В этом последнем анализе МЭК (первичные или укоренившиеся линии, сгруппированные, как описано ниже, или органоиды молочной железы) помещают в гель лрВКМ и стимулируют факторами роста, такими как TGF-α (76).В этих условиях эпителиальные клетки молочной железы подвергаются процессу роста и ремоделирования, который напоминает структуру «альвеол» в молочной железе (см.) во время беременности и лактации, а не ветвящихся протоков (см.). Использование анализа альвеологенеза позволило нашей лаборатории раскрыть критическую роль передачи сигналов MAPK и ее нижестоящих молекул в стимулировании альвеолярного роста (76).
Эти исследования ясно демонстрируют, что можно создать «дизайнерскую микросреду» (77) в 3D, чтобы ответить на вопросы, которые иначе было бы слишком сложно решить в организме.Это стало возможным благодаря модулированию типа и организации культуральных субстратов для моделирования различных аспектов роста и развития молочных желез. Тем не менее, остается много проблем при создании физиологически значимых систем культивирования, и мы ссылаемся на них в разделе ниже.
1.4. Текущие ограничения и перспективы на будущее
Трехмерные системы культивирования эпителия молочной железы претерпели значительные изменения с момента их создания и все еще подвергаются усовершенствованиям, направленным в конечном итоге на воссоздание всего органа в культуре.Однако для этого потребуются согласованные усилия представителей многих областей науки. Появление таких инструментов, как биоинженерные материалы и нанотехнологии, стало движущей силой в улучшении доступных систем культивирования, позволяя исследователям манипулировать и контролировать клеточную микросреду на разных уровнях и в разных масштабах. То есть они предоставили средства для управления химией, геометрией и механикой настроек культуры с возрастающей точностью. Эти инструменты в конечном итоге позволят нам воспроизвести железу в культуре, и при строгом контроле можно будет ответить на вопросы, касающиеся конкретных стадий развития и ограничений окружающей среды in vivo.
Однако впереди еще много испытаний и много вопросов, на которые нужно найти ответы. Нам все еще не хватает глубоких знаний о сложном наборе сигналов, генерируемых ECM. Передача сигналов от ламинина-1 как через интегриновые, так и неинтегриновые (например, дистрогликановые) рецепторы необходима для образования и дифференцировки BM и ацинуса (62, 63). За некоторыми исключениями, в настоящее время у нас есть ограниченные знания о функциональных ролях других компонентов BM. Кроме того, пока неясно, почему клетки на 2D-культуральном пластике способны синтезировать молекулы БМ, но почему они не откладывают структурно интактный БМ, который в конечном итоге привел бы к реорганизации клеток в их правильную конформацию в ткани.Однако сейчас можно начать решать эти вопросы с помощью синтетических инертных гелей, куда добавляются очищенные компоненты БМ. В конечном счете, различные компоненты могут быть объединены вместе для изучения иерархии сигнальных событий от BM до эпителия (78).
Нам все еще не хватает глубоких знаний о сложном наборе сигналов, генерируемых ECM. Передача сигналов от ламинина-1 как через интегриновые, так и неинтегриновые (например, дистрогликановые) рецепторы необходима для образования и дифференцировки BM и ацинуса (62, 63). За некоторыми исключениями, в настоящее время у нас есть ограниченные знания о функциональных ролях других компонентов BM. Кроме того, пока неясно, почему клетки на 2D-культуральном пластике способны синтезировать молекулы БМ, но почему они не откладывают структурно интактный БМ, который в конечном итоге привел бы к реорганизации клеток в их правильную конформацию в ткани.Однако сейчас можно начать решать эти вопросы с помощью синтетических инертных гелей, куда добавляются очищенные компоненты БМ. В конечном счете, различные компоненты могут быть объединены вместе для изучения иерархии сигнальных событий от BM до эпителия (78).
К сожалению, простого добавления различных компонентов мембран ECM и BM недостаточно для моделирования сложной микросреды in vivo, особенно с учетом временной регуляции передачи сигналов в ткани. Наша неспособность смоделировать такую сложность ставит в тупик нашу интерпретацию данных, полученных в результате культурологических исследований. Один конкретный пример такой сложности наблюдается при анализе альвеологенеза. Несмотря на то, что мы можем смоделировать процесс, который фенотипически напоминает альвеолярный рост в культуре, мы все еще не знаем, является ли наш анализ альвеологенеза истинным заменителем альвеолярного роста и расширения, происходящего во время беременности, что в конечном итоге приводит к лактации. Однако очевидно, что благодаря успехам, достигнутым нами в создании систем культуры эпителия молочной железы, мы ответили на ряд вопросов, но также открыли целый ряд новых вопросов.Важно признать, что для того, чтобы получить соответствующие знания из культурных систем, мы должны задавать соответствующие вопросы и признавать ограничения доступных моделей. В конце концов, орган сам по себе остается функциональной единицей, и именно интеграция сигналов внутри органа в конечном счете обеспечивает тканевую специфичность (79).
Наша неспособность смоделировать такую сложность ставит в тупик нашу интерпретацию данных, полученных в результате культурологических исследований. Один конкретный пример такой сложности наблюдается при анализе альвеологенеза. Несмотря на то, что мы можем смоделировать процесс, который фенотипически напоминает альвеолярный рост в культуре, мы все еще не знаем, является ли наш анализ альвеологенеза истинным заменителем альвеолярного роста и расширения, происходящего во время беременности, что в конечном итоге приводит к лактации. Однако очевидно, что благодаря успехам, достигнутым нами в создании систем культуры эпителия молочной железы, мы ответили на ряд вопросов, но также открыли целый ряд новых вопросов.Важно признать, что для того, чтобы получить соответствующие знания из культурных систем, мы должны задавать соответствующие вопросы и признавать ограничения доступных моделей. В конце концов, орган сам по себе остается функциональной единицей, и именно интеграция сигналов внутри органа в конечном счете обеспечивает тканевую специфичность (79).
Apache Tomcat/7.0.59 — отчет об ошибке
Apache Tomcat/7.0.59 — отчет об ошибкетип отчет об исключении
сообщение javax.servlet.jsp.JspTagException: ресурс не найден (/_ui/desktop/common/np/css/bootstrap.css)
описание Сервер обнаружил внутреннюю ошибку, которая не позволила ему выполнить этот запрос.
исключение
javax.servlet.ServletException: javax.servlet.jsp.JspTagException: ресурс не найден (/_ui/desktop/common/np/css/bootstrap.css) org.apache.jasper.runtime.PageContextImpl.doHandlePageException(PageContextImpl.ява: 916) org.apache.jasper.runtime.PageContextImpl.handlePageException(PageContextImpl.java:845) org.apache.jsp.WEB_002dINF.views.desktop.pages.layout.static_jsp._jspService(static_jsp.java:123) org.apache.jasper.runtime.HttpJspBase.service(HttpJspBase.java:70) javax.servlet.http.HttpServlet.service(HttpServlet.java:727) org.apache.jasper.servlet.JspServletWrapper.service(JspServletWrapper.java:432) org.apache.jasper.servlet.JspServlet.serviceJspFile(JspServlet.java:395) орг.apache.jasper.servlet.JspServlet.service(JspServlet.java:339) javax.servlet.http.HttpServlet.service(HttpServlet.java:727) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52) sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник) sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.lang.reflect.Method.invoke(Method.java:497) net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150) net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.вызвать (JdbcWrapper.java: 286) com.sun.proxy.$Proxy195.forward(Неизвестный источник) org.springframework.web.servlet.view.InternalResourceView.renderMergedOutputModel(InternalResourceView.java:168) org.springframework.web.servlet.view.AbstractView.render(AbstractView.java:303) org.springframework.web.servlet.DispatcherServlet.render(DispatcherServlet.
java:1257) org.springframework.web.servlet.DispatcherServlet.processDispatchResult (DispatcherServlet.java:1037) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:980) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:897) org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:970) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:861) javax.servlet.http.HttpServlet.service(HttpServlet.java:620) org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:846) javax.servlet.http.HttpServlet.service(HttpServlet.ява: 727) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52) sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник) sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.lang.reflect.Method.invoke(Method.java:497) net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150) net.
bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.java:286) com.sun.proxy.$Proxy195.forward(Неизвестный источник) com.newport.genesis.storefront.filters.RedirectFilter.doFilter(RedirectFilter.java:245) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.CartRestorationFilter.doFilterInternal(CartRestorationFilter.java:123) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.ява: 225) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:317) org.springframework.security.web.access.intercept.FilterSecurityInterceptor.invoke(FilterSecurityInterceptor.java:127) org.springframework.security.web.access.intercept.FilterSecurityInterceptor.doFilter(FilterSecurityInterceptor.
java:91) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.access.ExceptionTranslationFilter.doFilter(ExceptionTranslationFilter.java:115) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.session.SessionManagementFilter.doFilter(SessionManagementFilter.java:137) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.AnonymousAuthenticationFilter.doFilter(AnonymousAuthenticationFilter.ява:111) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.rememberme.RememberMeAuthenticationFilter.doFilter(RememberMeAuthenticationFilter.java:150) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.
java:331) org.springframework.security.web.servletapi.SecurityContextHolderAwareRequestFilter.doFilter(SecurityContextHolderAwareRequestFilter.java:169) орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.savedrequest.RequestCacheAwareFilter.doFilter(RequestCacheAwareFilter.java:63) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.AbstractAuthenticationProcessingFilter.doFilter(AbstractAuthenticationProcessingFilter.java:200) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.logout.LogoutFilter.doFilter(LogoutFilter.java:121) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.header.HeaderWriterFilter.doFilterInternal (HeaderWriterFilter.
java:66) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.context.request.async.WebAsyncManagerIntegrationFilter.doFilterInternal(WebAsyncManagerIntegrationFilter.java:56) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.context.SecurityContextPersistenceFilter.doFilter(SecurityContextPersistenceFilter.java:105) орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.access.channel.ChannelProcessingFilter.doFilter(ChannelProcessingFilter.java:157) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.
springframework.security.web.FilterChainProxy.doFilterInternal (FilterChainProxy.java:214) org.springframework.security.web.FilterChainProxy.doFilter(FilterChainProxy.java:177) де.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.UrlEncoderFilter.doFilterInternal(UrlEncoderFilter.java:72) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.StorefrontFilter.doFilter(StorefrontFilter.java:99) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.cms.CMSSiteFilter.doFilterInternal(CMSSiteFilter.java:100) org.springframework.web.filter.OncePerRequestFilter.
doFilter(OncePerRequestFilter.java:107) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) ком.ньюпорт.genesis.storefront.filters.RequestLoggerFilter.doFilter(RequestLoggerFilter.java:89) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) de.hybris.platform.servicelayer.web.SessionFilter.doFilter(SessionFilter.java:96) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) de.hybris.platform.servicelayer.web.Log4JFilter.doFilter(Log4JFilter.java:44) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.
doFilter(AbstractPlatformFilterChain.java:225) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain.doFilterInternal(AbstractPlatformFilterChain.java:155) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346) org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52) net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:201) net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:178) org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:197) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92) org.springframework.web.filter.
DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346) org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262) de.hybris.platform.servicelayer.web.XSSFilter.processPatternsAndDoFilter(XSSFilter.java:342) de.hybris.platform.servicelayer.web.XSSFilter.doFilter(XSSFilter.java:290)
основная причина
javax.servlet.jsp.JspTagException: ресурс не найден (/_ui/desktop/common/np/css/bootstrap.css) net.sf.packtag.tag.BaseTag.promoteError(BaseTag.java:298) net.sf.packtag.tag.PackTag.doEndTag(PackTag.java:67) org.apache.jsp.tag.webdesktop.template.styleSheets_tag._jspx_meth_pack_005fstyle_005f0(styleSheets_tag.ява: 246) org.apache.jsp.tag.webdesktop.template.styleSheets_tag.doTag(styleSheets_tag.java:86) org.apache.jsp.tag.webdesktop.template.master_tag._jspx_meth_template_005fstyleSheets_005f0(master_tag.java:1631) org.apache.jsp.tag.webdesktop.template.master_tag.doTag(master_tag.java:283) org.apache.jsp.tag.webdesktop.template.page_tag._jspx_meth_template_005fmaster_005f0(page_tag.java:203) org.apache.jsp.tag.webdesktop.template.page_tag.doTag(page_tag.java:166) org.apache.jsp.WEB_002dINF.представления.desktop.pages.layout.static_jsp._jspx_meth_template_005fpage_005f0(static_jsp.java:142) org.apache.jsp.WEB_002dINF.views.desktop.pages.layout.static_jsp._jspService(static_jsp.java:110) org.apache.jasper.runtime.HttpJspBase.service(HttpJspBase.java:70) javax.servlet.http.HttpServlet.service(HttpServlet.java:727) org.apache.jasper.servlet.JspServletWrapper.service(JspServletWrapper.java:432) org.apache.jasper.servlet.JspServlet.serviceJspFile(JspServlet.java:395) org.apache.jasper.servlet.JspServlet.сервис (JspServlet.java:339) javax.servlet.http.HttpServlet.service(HttpServlet.java:727) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52) sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник) sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.
lang.reflect.Method.invoke(Method.java:497) net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150) net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.ява: 286) com.sun.proxy.$Proxy195.forward(Неизвестный источник) org.springframework.web.servlet.view.InternalResourceView.renderMergedOutputModel(InternalResourceView.java:168) org.springframework.web.servlet.view.AbstractView.render(AbstractView.java:303) org.springframework.web.servlet.DispatcherServlet.render(DispatcherServlet.java:1257) org.springframework.web.servlet.DispatcherServlet.processDispatchResult (DispatcherServlet.java:1037) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.ява: 980) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:897) org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:970) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:861) javax.servlet.http.HttpServlet.
service(HttpServlet.java:620) org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:846) javax.servlet.http.HttpServlet.service(HttpServlet.java:727) орг.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52) sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник) sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.lang.reflect.Method.invoke(Method.java:497) net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150) net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.java:286) com.sun.proxy.$Proxy195.forward(Неизвестный источник) com.newport.genesis.storefront.filters.RedirectFilter.doFilter(RedirectFilter.java:245) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.CartRestorationFilter.doFilterInternal(CartRestorationFilter.java:123) org.springframework.
web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:317) org.springframework.security.web.access.intercept.FilterSecurityInterceptor.invoke(FilterSecurityInterceptor.java:127) org.springframework.security.web.access.intercept.FilterSecurityInterceptor.doFilter(FilterSecurityInterceptor.java:91) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.access.ExceptionTranslationFilter.doFilter(ExceptionTranslationFilter.java:115) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.session.SessionManagementFilter.doFilter(SessionManagementFilter.java:137) org.springframework.security.
web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.AnonymousAuthenticationFilter.doFilter(AnonymousAuthenticationFilter.java:111) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.rememberme.RememberMeAuthenticationFilter.doFilter(RememberMeAuthenticationFilter.java:150) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.servletapi.SecurityContextHolderAwareRequestFilter.doFilter(SecurityContextHolderAwareRequestFilter.java:169) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.savedrequest.RequestCacheAwareFilter.doFilter(RequestCacheAwareFilter.java:63) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.
java:331) org.springframework.security.web.authentication.AbstractAuthenticationProcessingFilter.doFilter(AbstractAuthenticationProcessingFilter.java:200) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.authentication.logout.LogoutFilter.doFilter(LogoutFilter.java:121) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.header.HeaderWriterFilter.doFilterInternal (HeaderWriterFilter.java:66) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.context.request.async.WebAsyncManagerIntegrationFilter.doFilterInternal(WebAsyncManagerIntegrationFilter.java:56) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.
springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.context.SecurityContextPersistenceFilter.doFilter(SecurityContextPersistenceFilter.java:105) орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.access.channel.ChannelProcessingFilter.doFilter(ChannelProcessingFilter.java:157) org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331) org.springframework.security.web.FilterChainProxy.doFilterInternal (FilterChainProxy.java:214) org.springframework.security.web.FilterChainProxy.doFilter(FilterChainProxy.java:177) де.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.UrlEncoderFilter.doFilterInternal(UrlEncoderFilter.java:72) org.springframework.web.filter.OncePerRequestFilter.
doFilter(OncePerRequestFilter.java:107) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.StorefrontFilter.doFilter(StorefrontFilter.java:99) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.cms.CMSSiteFilter.doFilterInternal(CMSSiteFilter.java:100) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) ком.ньюпорт.genesis.storefront.filters.RequestLoggerFilter.doFilter(RequestLoggerFilter.java:89) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.
doFilter(AcceleratorAddOnFilter.java:92) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) de.hybris.platform.servicelayer.web.SessionFilter.doFilter(SessionFilter.java:96) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) de.hybris.platform.servicelayer.web.Log4JFilter.doFilter(Log4JFilter.java:44) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225) de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain.doFilterInternal(AbstractPlatformFilterChain.java:155) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346) org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262) org.
apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52) net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:201) net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:178) org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:197) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92) org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346) org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262) de.hybris.platform.servicelayer.web.XSSFilter.processPatternsAndDoFilter(XSSFilter.java:342) de.hybris.platform.servicelayer.web.XSSFilter.doFilter(XSSFilter.java:290)
note Полная трассировка стека основной причины доступна в журналах Apache Tomcat/7.0.59.
Apache Tomcat/7.
 0.59
0.59Документ без названия
Документ без названияПеред использованием MEF для культуры ES вы должны размножить и инактивировать (остановить клеточное деление) MEF, чтобы сделать фидеры.
Расширение MEF
День 1: Разморозить 1 флакон MEF на чашку 10 см. Используйте питательные среды для культуры. Эти клетки не нужно кормить каждый день, но можно кормить каждые 2 дня.
День 2-3: При сливном пассаже каждые 10 см планшета 1:3. (3 чашки по 10 см)
День 4-5: При конфлюэнтном пассаже каждая чашка 10 см на чашку 120 см 1:1 или каждая чашка 10 см на чашку 3-10 см (1:3).
День 5–6: При слиянии инактивировать MEF и заморозить.
Инактивация MEF
Мы используем Митомиоцин С для инактивации. Он доступен от Sigma (M-0503) 2 мг/флакон в виде порошка
.
ВАЖНОЕ ПРИМЕЧАНИЕ. Митомиоцин С токсичен, не допускать попадания на кожу
1. Приготовьте свежий раствор митомиоцина С. Используйте шприц на 5 мл и введите 2 мл PBS в бутылку, чтобы получить 1 мг/мл. Хорошо перемешайте и наберите обратно в шприц. Пропустите через шприцевой фильтр 0,2 мкм и поместите в пробирку на 15 мл. Завернуть в алюминиевую фольгу и хранить при 4°С.
Приготовьте свежий раствор митомиоцина С. Используйте шприц на 5 мл и введите 2 мл PBS в бутылку, чтобы получить 1 мг/мл. Хорошо перемешайте и наберите обратно в шприц. Пропустите через шприцевой фильтр 0,2 мкм и поместите в пробирку на 15 мл. Завернуть в алюминиевую фольгу и хранить при 4°С.
2. Разбавьте 1:100 фидерной средой, когда будете готовы инактивировать MEF. Вам понадобится 5 мл.
сред с лекарственными средствами на каждую чашку 10 см и 15 мл среды на чашку 120 см. Для 9 чашек размером 120 см вам потребуется 135 мл фидерной среды с добавлением 1,3 мл митомиоцина С в среду.
3. Добавьте среду с митомиоцином С в чашки и инкубируйте при 37°С в течение 2–3 часов.
4. Аспирируйте среду с митомиоцином С в колбу.
5. Промойте PBS. Трипсинизируют в течение 5 мин при 37°С.
6. Инактивируйте трипсин с помощью питающей среды и соберите в пробирки на 50 мл.
7. Снова промыть планшеты PBS, чтобы увеличить выход клеток.
8. Промойте клетки центрифугированием при 1000 об/мин в течение 5 мин.
9. Ресуспендируйте в 25 мл PBS. Сделайте 3 промывки PBS при объединении клеток в одну пробирку на 50 мл. Во время промывок (или раньше) замораживайте среду.
а. 20 % FBS, 20 % ДМСО, 60 % DMEM и
.
б. 20% FBS, 80% DMEM
окончательное замораживание конц.будет 10% DMSO, 20% FBS, 70% DMEM
10. Подсчитайте клетки. Рассчитайте концентрацию флакона и количество, используя рабочий лист.
т. е. 2,5 x 106 ячеек/чашка 10 см
11. Промаркируйте соответствующие флаконы для замораживания объемом 2 мл (Corning) с указанием концентрации, даты и т. д.
Поместите флаконы на лед с замораживающей средой и ослабьте крышки.
12. Ресуспендируйте клетки при удвоенной концентрации замораживания. в 20% FBS, 80% DMEM
т.е. 12 флаконов с 1X конц. добавить 6 мл 20% FBS, 80% DMEM
13.Добавьте равный объем среды для замораживания 20% FBS, 20% DMSO, 60% DMEM до объема.
клеток. Хорошо смешать.
14.
Аликвота 1 мл/флакон быстро. Только аликвоту 3-5 мл за один раз, чтобы предотвратить эффект потока. Затяните колпачки.
Затяните колпачки.
15. Немедленно перенесите в морозильную камеру с температурой -80 C. Перенесите в резервуар с жидким азотом в течение одной недели.
Таблица размеров пластин и соответствующей концентрации дозатора
Размер Дозатор Концентрация
тарелка 10 см 1X (две тарелки используют 2X
6-луночный планшет концентрация)
24-луночный планшет
12-луночный планшет
96-луночный планшет
Тарелка 60 см .35X
2 лунки 6-луночного планшета
8 лунок 24-луночного планшета
2 4-луночных планшета nunc
Формы Сервисы Ссылки Вернуться на главную страницу протокола Вернуться на главную страницу ES Core
границ | Новая модель гематоэнцефалического барьера Transwell с использованием первичных клеток человека
Введение
Гематоэнцефалический барьер (ГЭБ) представляет собой уникальный интерфейс, разделяющий периферическое кровоснабжение и нервную ткань. Структурно ГЭБ состоит из специализированных эндотелиальных клеток микрососудов головного мозга (HBMEC), периваскулярных клеток (перицитов) и астроцитов (Abbott et al., 2006, 2010). Нейроны и микроглия также вносят вклад в поддержание ГЭБ и формируют то, что известно как нейроваскулярная единица (NVU) (Abbott et al., 2006). Перициты составляют 22–32% сосудов головного мозга и вместе с клетками гладкой мускулатуры сосудов и эндотелиальными клетками поддерживают сосудистую функцию (Martini and Bartholomew, 2017).В ЦНС перициты присутствуют в более высоком соотношении с HBMEC в головном мозге по сравнению с периферией, и недавние исследования показали обширную роль перицитов в развитии и поддержании ГЭБ (Kacem et al., 1998; Armulik et al., 2011; Суини и др., 2016). Помимо механической поддержки, они также регулируют сократимость сосудов, пролиферацию эндотелия, кровоток и ангиогенез (Bergers and Song, 2005; Dore-Duffy, 2008). Также было показано, что перициты секретируют ангиогенные факторы, такие как фактор роста эндотелия сосудов (VEGF), которые поддерживают выживание и пролиферацию эндотелиальных клеток (Darland et al.
Структурно ГЭБ состоит из специализированных эндотелиальных клеток микрососудов головного мозга (HBMEC), периваскулярных клеток (перицитов) и астроцитов (Abbott et al., 2006, 2010). Нейроны и микроглия также вносят вклад в поддержание ГЭБ и формируют то, что известно как нейроваскулярная единица (NVU) (Abbott et al., 2006). Перициты составляют 22–32% сосудов головного мозга и вместе с клетками гладкой мускулатуры сосудов и эндотелиальными клетками поддерживают сосудистую функцию (Martini and Bartholomew, 2017).В ЦНС перициты присутствуют в более высоком соотношении с HBMEC в головном мозге по сравнению с периферией, и недавние исследования показали обширную роль перицитов в развитии и поддержании ГЭБ (Kacem et al., 1998; Armulik et al., 2011; Суини и др., 2016). Помимо механической поддержки, они также регулируют сократимость сосудов, пролиферацию эндотелия, кровоток и ангиогенез (Bergers and Song, 2005; Dore-Duffy, 2008). Также было показано, что перициты секретируют ангиогенные факторы, такие как фактор роста эндотелия сосудов (VEGF), которые поддерживают выживание и пролиферацию эндотелиальных клеток (Darland et al. , 2003). При таких патологиях, как ишемический инсульт, между соседними перицитами могут образовываться большие промежутки, увеличивающие проницаемость барьера и протечку сосудов. Эти изменения в морфологии перицитов в сочетании с усилением экспрессии молекул адгезии и лигандов лейкоцитарного интегрина способствуют экстравазации периферических лейкоцитов в головной мозг после ишемического инсульта (Pieper et al., 2013). Таким образом, перициты играют большую роль в функционировании сосудов головного мозга в нормальных физиологических условиях, а также в сосудистой дисфункции при гипоксии.
, 2003). При таких патологиях, как ишемический инсульт, между соседними перицитами могут образовываться большие промежутки, увеличивающие проницаемость барьера и протечку сосудов. Эти изменения в морфологии перицитов в сочетании с усилением экспрессии молекул адгезии и лигандов лейкоцитарного интегрина способствуют экстравазации периферических лейкоцитов в головной мозг после ишемического инсульта (Pieper et al., 2013). Таким образом, перициты играют большую роль в функционировании сосудов головного мозга в нормальных физиологических условиях, а также в сосудистой дисфункции при гипоксии.
Несколько исследований также выявили роль нейронов и глии в развитии и поддержании ГЭБ. Нейральные клетки-предшественники, присутствующие в желудочковом нейроэпителии, как было показано, помогают рекрутированию эндотелиальных клеток во время раннего развития BBB, которое в значительной степени регулируется сигнальным путем Wnt (Risau et al., 1986). В частности, передача сигналов Wnt на раннем этапе развития ЦНС отвечает за стабилизацию сосудов и ангиогенез (Liebner et al. , 2008). В дополнение к этому было показано, что ранняя передача сигналов нейронами необходима для созревания ГЭБ, в частности, для организации плотных соединений (TJ).Исследование, проведенное с использованием эндотелиальных клеток микрососудов крысы и нейрональных клеток-предшественников, показало, что в присутствии нейральных клеток-предшественников эндотелиальные клетки установили регулярное образование TJ, включая: клаудин 5, zonula occludens (ZO-1) и окклюдин (Weidenfeller et al., 2007). После созревания поддержание ГЭБ и сохранение гомеостаза головного мозга в значительной степени зависит от адекватной перфузии нейронной ткани и передачи нейронами сигналов к сосудам головного мозга, процесс, известный как гиперемия (Attwell et al., 2010). Исследования показали, что перекрестные помехи между нейронами и астроцитами важны для соответствующей сократимости сосудов и кровотока в зависимости от метаболических потребностей (Zonta et al., 2003; Attwell et al., 2010; Macvicar and Newman, 2015).
, 2008). В дополнение к этому было показано, что ранняя передача сигналов нейронами необходима для созревания ГЭБ, в частности, для организации плотных соединений (TJ).Исследование, проведенное с использованием эндотелиальных клеток микрососудов крысы и нейрональных клеток-предшественников, показало, что в присутствии нейральных клеток-предшественников эндотелиальные клетки установили регулярное образование TJ, включая: клаудин 5, zonula occludens (ZO-1) и окклюдин (Weidenfeller et al., 2007). После созревания поддержание ГЭБ и сохранение гомеостаза головного мозга в значительной степени зависит от адекватной перфузии нейронной ткани и передачи нейронами сигналов к сосудам головного мозга, процесс, известный как гиперемия (Attwell et al., 2010). Исследования показали, что перекрестные помехи между нейронами и астроцитами важны для соответствующей сократимости сосудов и кровотока в зависимости от метаболических потребностей (Zonta et al., 2003; Attwell et al., 2010; Macvicar and Newman, 2015). При церебральной ишемии астроциты ощущают повышение уровня ионов Ca 2+ и увеличение внеклеточного глутамата, высвобождаемого нейронами, и реагируют соответствующим образом, секретируя ряд вазоактивных веществ, помогающих смягчить последствия окклюзии кровеносных сосудов (Macvicar and Newman, 2015).В целом взаимодействия между нервными и сосудистыми клетками внутри NVU считаются первостепенными для функциональности ГЭБ, поскольку вместе они индуцируют и усиливают барьерные свойства; помогая сохранить его ключевые характеристики, включая низкую парацеллюлярную проницаемость и функциональную герметичность (Abbott et al., 2010). Разрушение ГЭБ при таких состояниях, как ишемический инсульт, может привести к серьезным последствиям для гомеостаза головного мозга, поэтому моделирование этих взаимодействий необходимо для понимания сложных сигнальных сетей между этими типами клеток и того, как на них влияют болезненные состояния.
При церебральной ишемии астроциты ощущают повышение уровня ионов Ca 2+ и увеличение внеклеточного глутамата, высвобождаемого нейронами, и реагируют соответствующим образом, секретируя ряд вазоактивных веществ, помогающих смягчить последствия окклюзии кровеносных сосудов (Macvicar and Newman, 2015).В целом взаимодействия между нервными и сосудистыми клетками внутри NVU считаются первостепенными для функциональности ГЭБ, поскольку вместе они индуцируют и усиливают барьерные свойства; помогая сохранить его ключевые характеристики, включая низкую парацеллюлярную проницаемость и функциональную герметичность (Abbott et al., 2010). Разрушение ГЭБ при таких состояниях, как ишемический инсульт, может привести к серьезным последствиям для гомеостаза головного мозга, поэтому моделирование этих взаимодействий необходимо для понимания сложных сигнальных сетей между этими типами клеток и того, как на них влияют болезненные состояния.
На сегодняшний день разработан ряд моделей ГЭБ, начиная от монослоев HBMEC и заканчивая более сложными моделями в виде сфероидов и чипов, см.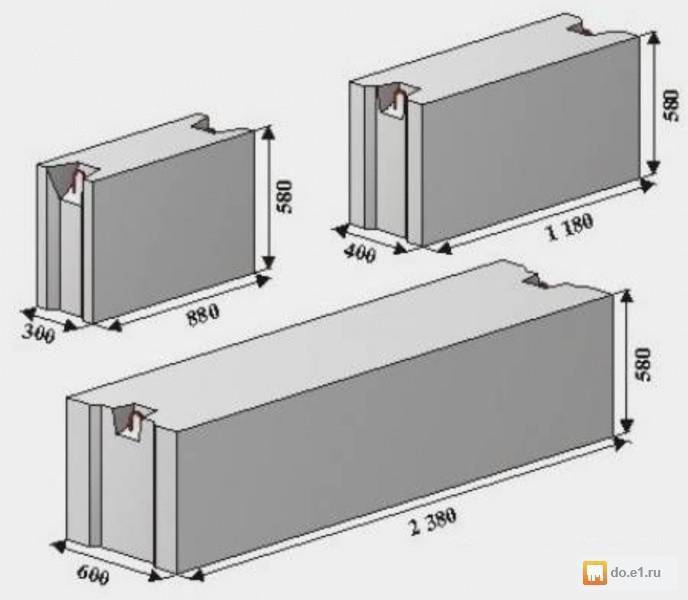 Таблицу 1. После успешного выделения эндотелиальных клеток головного мозга были разработаны первые, наиболее упрощенные модели ГЭБ с использованием HBMEC в качестве одиночный монослой на аблюминальной стороне трансвеллальных вставок, см. табл. 1 (Borges et al., 1994; Hartz et al., 2010). Позднее добавление других типов клеток ГЭБ (астроцитов и перицитов) привело к разработке трансвелловых систем совместного культивирования, которые демонстрировали большую прочность барьера, демонстрируемую более высокой трансэпителиальной резистентностью (TEER) и более низкой проницаемостью, чем отдельные модели HBMEC, см. Рисунок 1.В более поздних трансвелловых системах обычно используются три типа клеток, происходящих от крупного рогатого скота, свиней или грызунов, см. Таблицу 1 (Gaillard et al., 2000; Nakagawa et al., 2009; Thomsen et al., 2015).
Таблицу 1. После успешного выделения эндотелиальных клеток головного мозга были разработаны первые, наиболее упрощенные модели ГЭБ с использованием HBMEC в качестве одиночный монослой на аблюминальной стороне трансвеллальных вставок, см. табл. 1 (Borges et al., 1994; Hartz et al., 2010). Позднее добавление других типов клеток ГЭБ (астроцитов и перицитов) привело к разработке трансвелловых систем совместного культивирования, которые демонстрировали большую прочность барьера, демонстрируемую более высокой трансэпителиальной резистентностью (TEER) и более низкой проницаемостью, чем отдельные модели HBMEC, см. Рисунок 1.В более поздних трансвелловых системах обычно используются три типа клеток, происходящих от крупного рогатого скота, свиней или грызунов, см. Таблицу 1 (Gaillard et al., 2000; Nakagawa et al., 2009; Thomsen et al., 2015).
Рис. 1. Схематическое изображение разработки модели ГЭБ. (A) Модель клеток совместного культивирования, содержащая HBMEC и астроциты. (B) HBMEC, посеянные на апикальной стороне, астроциты, посеянные на нижней стороне вставки, и перициты, посеянные на дне планшета. (C) HBMEC, высеянные на апикальную сторону вставки, перициты, высеянные на нижнюю сторону вставки, и астроциты, высеянные на дно планшета. (D) HBMEC, посеянные на апикальной стороне вставки со смешанной культурой астроцитов и перицитов на нижней стороне вставки. (E) HBMEC, посеянные на апикальной стороне вставки, со смешанной культурой астроцитов и перицитов на нижней стороне вставки и нейронами, посеянными на покровное стекло, покрытое поли-L-лизином, на дне планшета.
(B) HBMEC, посеянные на апикальной стороне, астроциты, посеянные на нижней стороне вставки, и перициты, посеянные на дне планшета. (C) HBMEC, высеянные на апикальную сторону вставки, перициты, высеянные на нижнюю сторону вставки, и астроциты, высеянные на дно планшета. (D) HBMEC, посеянные на апикальной стороне вставки со смешанной культурой астроцитов и перицитов на нижней стороне вставки. (E) HBMEC, посеянные на апикальной стороне вставки, со смешанной культурой астроцитов и перицитов на нижней стороне вставки и нейронами, посеянными на покровное стекло, покрытое поли-L-лизином, на дне планшета.
Таблица 1. Различные модели гематоэнцефалического барьера; Их особенности, преимущества и недостатки.
Хотя моделирование с использованием нечеловеческих клеток дешевле и проще в получении, они не сопоставимы с человеческими клетками, при этом многие исследования показывают ключевые различия в морфологии и функциях, особенно в их чувствительности к глутамату и экспрессии белков-переносчиков оттока (Oberheim et al.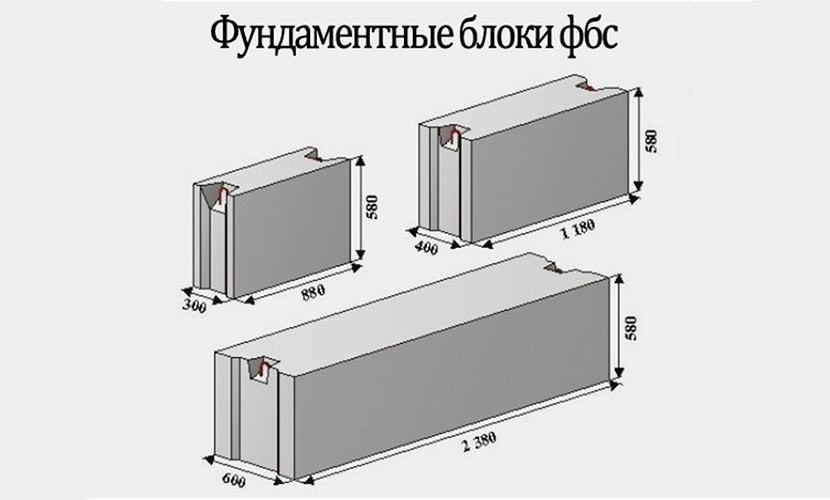 , 2009; Уоррен и др., 2009; Чжан и др., 2016). Также доступны более сложные модели BBB, такие как сфероидные или микрожидкостные модели, которые предлагают более близкое представление о среде in vivo .Однако эти установки сложны и дороги в сборке (Ruck et al., 2015). Следовательно, существует необходимость в разработке многоклеточной трансвелловой модели, которая включает в себя несколько типов клеток NVU для изучения их взаимодействий, особенно роли нейронов и их влияния на прочность барьера как при физиологических, так и при болезненных состояниях. Системы Transwell по-прежнему имеют явное преимущество в том, что они относительно просты в настройке и управлении, а также предлагают ряд конечных точек для изучения. Измерение TEER в этих типах моделей является обычным явлением, поскольку оно обеспечивает надежную, неинвазивную количественную оценку целостности барьера, позволяя проводить повторные измерения в течение желаемого периода времени с минимальным повреждением клеток (Srinivasan et al.
, 2009; Уоррен и др., 2009; Чжан и др., 2016). Также доступны более сложные модели BBB, такие как сфероидные или микрожидкостные модели, которые предлагают более близкое представление о среде in vivo .Однако эти установки сложны и дороги в сборке (Ruck et al., 2015). Следовательно, существует необходимость в разработке многоклеточной трансвелловой модели, которая включает в себя несколько типов клеток NVU для изучения их взаимодействий, особенно роли нейронов и их влияния на прочность барьера как при физиологических, так и при болезненных состояниях. Системы Transwell по-прежнему имеют явное преимущество в том, что они относительно просты в настройке и управлении, а также предлагают ряд конечных точек для изучения. Измерение TEER в этих типах моделей является обычным явлением, поскольку оно обеспечивает надежную, неинвазивную количественную оценку целостности барьера, позволяя проводить повторные измерения в течение желаемого периода времени с минимальным повреждением клеток (Srinivasan et al. , 2015). В дополнение к этому модели трансвелла обеспечивают доступ как к апикальному, так и к базолатеральному (базальному) отсеку для применения лекарств и отбора проб среды, а также позволяют визуализировать клетки в ходе эксперимента.
, 2015). В дополнение к этому модели трансвелла обеспечивают доступ как к апикальному, так и к базолатеральному (базальному) отсеку для применения лекарств и отбора проб среды, а также позволяют визуализировать клетки в ходе эксперимента.
Поэтому нашей целью было создание новой четырехклеточной модели ГЭБ человека для изучения изменений проницаемости после кислородно-глюкозной депривации (OGD) и для использования в фармакологии in vitro . Первоначально мы сосредоточились на разработке модели, уточняя протокол, впервые описанный Hind (2014), путем оптимизации самих вставок, покрытия вставок, плотности посева клеток и сроков культивирования клеток.Наконец, мы внедрили метод посева нейронов на пластиковые покровные стекла, которые помещали на дно 12-луночных планшетов для культивирования клеток. Таким образом, наша модель сохраняет простоту установки трансвелла, но использует четыре первичные клетки человека, что делает ее более близким представлением среды человека in vivo .
Материалы и методы
Первичные клетки (астроциты, перициты, HBMEC и нейроны) и специализированная среда для культивирования клеток (среда для астроцитов, среда для перицитов, среда для эндотелиальных клеток и среда для нейронов) были получены от ScienCell, США, поставляемой Caltag Medsystems, Соединенное Королевство.Поли-L-лизин и свиной фибронектин также были получены от ScienCell, США, поставляемые Caltag Medsystems, Соединенное Королевство. Вставки с коллагеновым покрытием, 3,0 мкм, 12 мм, были получены от Corning, Соединенное Королевство. Пластиковые покровные стекла (Thermanox ® диаметром 13 мм), реагент для диссоциации Accutase и среда RPMI без глюкозы были получены от Thermo Fisher Scientific, Соединенное Королевство.
Клетки содержали во влажном инкубаторе (37°C, 5% CO 2 ).Астроциты и перициты культивировали и использовали между пассажами 4 и 6. Эндотелиальные клетки микрососудов головного мозга человека (HBMEC) использовали между пассажами 3 и 5, а нейроны использовали в пассаже 1. Во время пересева колбы, содержащие HBMEC, покрывали 2 мкг⋅см 2 фибронектина перед оживлением или делением клеток в соответствии с рекомендациями производителей. Клетки пассировали при 80-90% слиянии. Вставки содержали 1,2 мл среды в базолатеральном отсеке и 800 мкл в апикальном отсеке.
Во время пересева колбы, содержащие HBMEC, покрывали 2 мкг⋅см 2 фибронектина перед оживлением или делением клеток в соответствии с рекомендациями производителей. Клетки пассировали при 80-90% слиянии. Вставки содержали 1,2 мл среды в базолатеральном отсеке и 800 мкл в апикальном отсеке.
зонда STX-3 и омметр были получены от World Precision Instruments, Великобритания. Дексаметазон был получен от Sigma, Соединенное Королевство, и растворен в ДМСО при исходной концентрации 10 мМ, а затем разбавлен в среде для культивирования клеток. Анаэробные контейнерные системы GasPak TM EZ были получены от BD, Соединенное Королевство.
Проверка модели
Наша модель была основана на первоначальной совместной культуре, созданной Hind (2014) и предыдущих моделях Allen and Bayraktutan (2009).Наша модель была модифицирована и разработана в ходе ряда предварительных экспериментов, включая сравнение размеров пор вставки, покрытия вставки, организации клеток и добавления нескольких типов клеток.
Размер пор, размер вставки и покрытие
Первоначально сравнивались размеры пор вставок Corning, Соединенное Королевство (0,4 мкм против 3,0 мкм), а также планшетов для клеточных культур (12 лунок против 24 лунок). Это должно было определить наилучшую начальную настройку, обеспечивающую самое высокое и наиболее стабильное барьерное сопротивление, а также обеспечивающее наилучший контакт с ячейкой.Во время разработки протокола мы обнаружили, что добавление перицитов в меньшие 24-луночные планшеты дало плохие результаты и недостаточную TEER, что свидетельствует о неадекватном формировании барьера. Возможно, в результате неадекватного клеточного роста на такой небольшой площади поверхности и в такой среде. Поэтому 24-луночные планшеты были заменены обратно на 12-луночные, что привело к значительно более высоким показателям TEER. После работы, проведенной Niego и Medcalf (2013), мы также обнаружили, что вставки с размером пор 3,0 мкм имеют более высокие значения TEER, чем 0. Вставки размером 4 мкм, что свидетельствует о том, что усиленный контакт между клетками на апикальной и базолатеральной сторонах вставки приводит к большей прочности барьера, см. Рисунок 2А.
Вставки размером 4 мкм, что свидетельствует о том, что усиленный контакт между клетками на апикальной и базолатеральной сторонах вставки приводит к большей прочности барьера, см. Рисунок 2А.
Рис. 2. Разработка протокола модели (A) измеряла трансэпителиальную резистентность (TEER) как маркер герметичности барьера, сравнивая 12-луночный планшет с транслункцией и 24-луночный планшет с транслункцией и вставкой с размером пор 3,0 мкм и 0,4 мкм. HBMEC высевают на апикальной стороне вставки, астроциты под ней и перициты на дне планшета. (B) Организация клеток была оптимизирована путем сравнения TEER, генерируемого смешанной культурой астроцитов и перицитов, перицитов или только астроцитов на нижней стороне трансвелловых вставок и астроцитов или перицитов на дне планшета для культивирования клеток. HBMEC высевали на апикальной стороне вставки. Данные представлены как среднее ± SEM, n = 4–6 из двух экспериментальных повторов. Статистический анализ, проведенный с использованием двухфакторного ANOVA с тестом множественных сравнений Турции, ∗∗ P < 0. 01 и ∗∗∗ P < 0,001 смешанная культура астроцитов и перицитов по сравнению с перицитами под вставкой и астроцитами на дне планшета. # P < 0,05 смешанная культура астроцитов и перицитов по сравнению с астроцитами под вставкой и перицитами на дне планшета.
01 и ∗∗∗ P < 0,001 смешанная культура астроцитов и перицитов по сравнению с перицитами под вставкой и астроцитами на дне планшета. # P < 0,05 смешанная культура астроцитов и перицитов по сравнению с астроцитами под вставкой и перицитами на дне планшета.
Добавление нескольких типов ячеек и позиционирование ячеек
Несмотря на эти улучшения в модели совместного культивирования, потребность в дополнительных типах клеток была критической для создания более близкого представления in vivo BBB.Мы установили три различных установки, как показано на рисунке 1. В одном астроциты были высеяны на базолатеральной стороне вставок, а перициты на дне чашки для культивирования (рис. 1B), в другом перициты были высеяны на базолатеральной стороне вставок. в то время как астроциты были высеяны на дно чашки для культивирования (рис. 1C), и, наконец, последняя установка включала смешанную культуру астроцитов и перицитов, высеянную на базолатеральной стороне вставки (рис. 1D). Во всех протестированных моделях HBMEC были засеяны на апикальной стороне трансвелловой вставки.
1D). Во всех протестированных моделях HBMEC были засеяны на апикальной стороне трансвелловой вставки.
Окончательная установка предлагала более близкое воспроизведение организации, проведенной на in vivo BBB, поскольку клетки будут находиться в прямом контакте, что позволит им обмениваться жизненно важными факторами роста, необходимыми для клеточного роста и развития. Мы обнаружили, что смешанная культура перицитов и астроцитов демонстрирует значительно более высокие значения TEER по сравнению с установкой с перицитами, посеянными на дне чашки, и астроцитами под вставкой или астроцитами на дне чашки и перицитами под вставкой на 3 и 4 дни. P < 0.05 и P <0,01 соответственно (рис. 2В). Кроме того, эта установка также считалась наиболее стабильной, как показали более стабильные показания TEER, и в целом была более физиологической. Таким образом, эта установка была использована в последующей разработке протокола для четырех ячеек.
Чтобы проверить жизнеспособность добавления нейронов в модель, мы первоначально посеяли нейроны на дно 12-луночного планшета, в котором были подвешены вставки. Однако это было невозможно, так как датчики TEER касались дна планшета, вызывая нежелательное повреждение клеток.Поэтому мы решили использовать покровные стекла, которые можно было бы расположить на дне планшета, но не занимать всю лунку, позволяя зонду находиться там, где клеток не было. После тестирования стеклянных и пластиковых покровных стекол, покрытых поли-L-лизином, мы обнаружили, что покровные стекла с пластиковым покрытием были наиболее эффективными в адгезии нейронов, и этот метод был использован в окончательной модели.
Однако это было невозможно, так как датчики TEER касались дна планшета, вызывая нежелательное повреждение клеток.Поэтому мы решили использовать покровные стекла, которые можно было бы расположить на дне планшета, но не занимать всю лунку, позволяя зонду находиться там, где клеток не было. После тестирования стеклянных и пластиковых покровных стекол, покрытых поли-L-лизином, мы обнаружили, что покровные стекла с пластиковым покрытием были наиболее эффективными в адгезии нейронов, и этот метод был использован в окончательной модели.
Обзор метода четырех ячеек
После оптимизации наша модель BBB с четырьмя ячейками состояла из четырех основных типов ячеек NVU, расположенных в схеме трансвелловой проницаемости (см. Рисунок 1E).Сборка этого включает посев различных типов клеток в разное время на апикальной и базолатеральной сторонах трансвелловой вставки. В течение этого времени нейроны высевают на пластиковые покровные стекла, помещенные на дно отдельного 12-луночного планшета, для развития нейритов перед соединением обеих частей модели в последний день создания модели. Среду для культивирования клеток в обоих отсеках заменяли через день, а окончательную установку оставляли для уравновешивания на 2 дня перед началом экспериментов.Более 85% вставок пригодны для использования в экспериментах, а модель остается жизнеспособной до 5 дней.
Среду для культивирования клеток в обоих отсеках заменяли через день, а окончательную установку оставляли для уравновешивания на 2 дня перед началом экспериментов.Более 85% вставок пригодны для использования в экспериментах, а модель остается жизнеспособной до 5 дней.
Покрытие вставки и посев астроцитов
В первый день базолатеральную сторону вставок трансвелл покрывали поли-L-лизином, а астроциты высевали на базолатеральную сторону вставок, см. рис. 3. Вкратце, 3,0 мкм, 12 мм вставки, покрытые коллагеном (Corning, Соединенное Королевство ) осторожно вынимали из упаковки и помещали в 12-луночные планшеты для культивирования клеток с помощью стерильных щипцов.Раствор поли-L-лизина (2 мкг/см 2 ) готовили в стерильной воде, гомогенно перемешивали и осторожно пипетировали с помощью пипетки Пастера, чтобы только покрыть базолатеральную часть вставки, см. рис. 4A,i. Затем планшеты со вставками возвращали в инкубатор при 37°C, 5% CO 2 на 1 ч в соответствии с рекомендациями поставщика. Через 1 ч планшеты вынимали из инкубатора и дважды промывали стерильной водой для удаления остатков поли-L-лизина. Всю оставшуюся жидкость удаляли осторожной аспирацией.Затем вставки Transwell перевернули внутрь планшета и сняли крышку (рис. 4B). На вставки с новым покрытием 100 мкл суспензии клеток астроцитов в среде астроцитов (3,13 × 10 5 клеток) быстро пипетировали на базолатеральную сторону трансвелла и осторожно закрывали крышку (см. рис. 4C, ii). Планшеты возвращали в инкубатор для клеточных культур на 2-3 часа для прилипания клеток. По прошествии этого времени вставки Transwell переворачивали и избыток среды удаляли аспирацией.Среду добавляли в апикальное и базолатеральное отделения, см. рис. 4iii. Планшеты снова возвращали в инкубатор.
Через 1 ч планшеты вынимали из инкубатора и дважды промывали стерильной водой для удаления остатков поли-L-лизина. Всю оставшуюся жидкость удаляли осторожной аспирацией.Затем вставки Transwell перевернули внутрь планшета и сняли крышку (рис. 4B). На вставки с новым покрытием 100 мкл суспензии клеток астроцитов в среде астроцитов (3,13 × 10 5 клеток) быстро пипетировали на базолатеральную сторону трансвелла и осторожно закрывали крышку (см. рис. 4C, ii). Планшеты возвращали в инкубатор для клеточных культур на 2-3 часа для прилипания клеток. По прошествии этого времени вставки Transwell переворачивали и избыток среды удаляли аспирацией.Среду добавляли в апикальное и базолатеральное отделения, см. рис. 4iii. Планшеты снова возвращали в инкубатор.
Рис. 3. Временная шкала, показывающая этапы создания модели. На 1-й день вставки покрывали и высевали астроциты на базолатеральной стороне вставок трансвелл, а на 3-й день перициты высевали на базолатеральной стороне вставок с образованием смешанной культуры. На 6-й день HBMEC высевали на апикальную сторону вставок, а нейроны высевали на покровные стекла с покрытием в отдельный 12-луночный планшет.На 10/11 день вставки осторожно вынимают из их текущего планшета и помещают во второй 12-луночный планшет, содержащий нейроны, высеянные на покровные стекла. Через 2 дня проводят измерения TEER, чтобы убедиться в адекватном формировании барьера. ∗ В нашей лаборатории эксперименты OGD были начаты в этот момент и были жизнеспособны в течение 4–5 дней.
На 6-й день HBMEC высевали на апикальную сторону вставок, а нейроны высевали на покровные стекла с покрытием в отдельный 12-луночный планшет.На 10/11 день вставки осторожно вынимают из их текущего планшета и помещают во второй 12-луночный планшет, содержащий нейроны, высеянные на покровные стекла. Через 2 дня проводят измерения TEER, чтобы убедиться в адекватном формировании барьера. ∗ В нашей лаборатории эксперименты OGD были начаты в этот момент и были жизнеспособны в течение 4–5 дней.
Рисунок 4. Настройка модели (A–D) и (i–v) . (A/i) Вставки помещают в 12-луночный планшет, покрывают поли-L-лизином и промывают, гарантируя удаление всей жидкости. (B/ii) Вставки осторожно переворачивают внутрь пластины и пластину удаляют. 100 мкл соответствующей клеточной суспензии осторожно помещают на нижнюю часть вставки. (C/ii) Дно планшета для клеточных культур действует как «крышка» и заменяется как можно быстрее, после чего планшеты возвращаются в инкубатор для прилипания клеток на 3–4 часа. (iv) В отдельном 12-луночном планшете покровные стекла помещают на дно чашки для культивирования, покрывают поли-L-лизином и засевают суспензией нейрональных клеток. (v) После того, как все клетки были посеяны в трансвеллах, вставки осторожно переносят в планшеты, содержащие нейроны на покровных стеклах.
(iv) В отдельном 12-луночном планшете покровные стекла помещают на дно чашки для культивирования, покрывают поли-L-лизином и засевают суспензией нейрональных клеток. (v) После того, как все клетки были посеяны в трансвеллах, вставки осторожно переносят в планшеты, содержащие нейроны на покровных стеклах.
Посев перицитов
На 2-й день планшеты вынимали из инкубатора и осторожно удаляли среду для астроцитов, чтобы не повредить слой клеток на базолатеральной стороне вставки. Затем вставки снова переворачивали и добавляли 100 мкл 6,25 × 10 4 клеточной суспензии перицитов к клеточному слою астроцитов на базолатеральной стороне трансвелловых вставок, получая примерное соотношение астроцитов к перицитам 5:1 (Pardridge, 1999). .Крышки планшетов быстро заменяли и возвращали в инкубатор на 2–3 часа. По прошествии этого времени трансвелловые вставки переворачивали, любой избыток среды удаляли аспирацией и добавляли смесь среды для астроцитов и перицитов (1:1) в апикальный и базолатеральный компартменты.
HBMEC Засев
Как только астроциты и перициты достигли 90% слияния (приблизительно на 4-й день от начала моделирования, см. рисунок 3), среду астроциты:перициты (1:1) из апикального компартмента удаляли и добавляли 100 мкл клеточной суспензии HBMEC (7.5 × 10 4 ) в среде HBMEC добавляли в апикальное отделение вставок Transwell и клетки оставляли для прилипания минимум на 5 часов, затем среду доводили до 700 мкл средой для эндотелиальных клеток и планшеты возвращали в инкубатор. .
Посев нейронов
В тот же день, что и посев HBMEC, пластиковые покровные стекла (диаметром 13 мм) покрывали поли-L-лизином и помещали в инкубатор для клеточных культур не менее чем на 1 час в соответствии с рекомендациями поставщика. Планшеты с покровными стеклами осторожно вынимали из инкубатора, покровные стекла дважды промывали стерильной водой и оставляли сушиться на воздухе в вытяжном шкафу для культивирования клеток.После этого криоконсервированные нейроны оживляли в 3 мл среды для нейронов (чтобы получить общий объем клеточной суспензии 4 мл) и добавляли по 100 мкл клеточной суспензии к каждому покровному стеклу (таким образом засевали с плотностью примерно 2,5 × 10 4 клеток). на см 2 в пределах оптимального диапазона согласно рекомендациям производителя) (рис. 4D,iv). Среду доливают через 2 ч и каждые 2–3 дня заменяют половину среды. После наблюдения под световым микроскопом нейроны начали демонстрировать обширный рост нейритов примерно на 5-й день.К этому моменту HBMEC почти сформируют сплошной монослой над астроцитами и перицитами. Затем трансвеллы осторожно вынимали из их текущего 12-луночного планшета с помощью стерильных щипцов и помещали в 12-луночный планшет, содержащий покровные стекла нейронов. Свежую среду HBMEC наносили на апикальное отделение, а смесь среды для перицитов, астроцитов и нейронов (1:1:2 соответственно) добавляли в базолатеральное отделение. Это было необходимо для поддержания низкой концентрации фетальной бычьей сыворотки, оптимальной для поддержания нейронов, а также для сохранения роста астроцитов и перицитов.Поскольку все клетки были конфлюэнтными и барьер был адекватно сформирован, условия можно было поддерживать в различных компартментах.
на см 2 в пределах оптимального диапазона согласно рекомендациям производителя) (рис. 4D,iv). Среду доливают через 2 ч и каждые 2–3 дня заменяют половину среды. После наблюдения под световым микроскопом нейроны начали демонстрировать обширный рост нейритов примерно на 5-й день.К этому моменту HBMEC почти сформируют сплошной монослой над астроцитами и перицитами. Затем трансвеллы осторожно вынимали из их текущего 12-луночного планшета с помощью стерильных щипцов и помещали в 12-луночный планшет, содержащий покровные стекла нейронов. Свежую среду HBMEC наносили на апикальное отделение, а смесь среды для перицитов, астроцитов и нейронов (1:1:2 соответственно) добавляли в базолатеральное отделение. Это было необходимо для поддержания низкой концентрации фетальной бычьей сыворотки, оптимальной для поддержания нейронов, а также для сохранения роста астроцитов и перицитов.Поскольку все клетки были конфлюэнтными и барьер был адекватно сформирован, условия можно было поддерживать в различных компартментах.
Протокол кислородно-глюкозной депривации (OGD)
Для повышения проницаемости барьера использовался протокол кислородно-глюкозной депривации (OGD), моделирующий последствия ишемического инсульта in vitro (Hind et al., 2015, 2016). Нормальную среду для культивирования клеток удаляли из вкладышей Transwell и заменяли средой RPMI, не содержащей глюкозы (Thermo Fisher Scientific, Великобритания), и помещали в среду с 0% O 2 (анаэробный пакет GasPak TM Beckton Dickinson, Оксфорд, Великобритания). в течение 20 мин для обеспечения анаэробных условий еще на 4 ч.Начального периода предварительной подготовки не было. Реперфузию инициировали удалением планшетов из анаэробного кармана и возвращением клеток в их нормальную среду (среда HBMEC в апикальном отделе и в базолатеральном отделе смесь перицитов, астроцитов и нейронов, 1:1:2 соответственно). TEER измеряли исходно (0 часов), сразу после OGD (4 часа), через 24, 48 и 72 часа.
Оценка целостности барьера
Трансэпителиальная резистентность (TEER) была измерена до начала экспериментов OGD для обеспечения целостности модельного барьера; вставки должны иметь значение TEER ≥45 Ом/см 2 (рис. 4v).Также проводилось наблюдение с помощью светового микроскопа, чтобы убедиться в слиянии клеток и успешном образовании нейритов. Для обеспечения согласованности измерения TEER всегда следует считывать не менее чем через 24 часа после смены среды. Вкратце, электроды STX3 стерилизовали, помещая кончики зонда в 70% этанол, а затем уравновешивали в течение 15 минут в культуральной среде эндотелиальных клеток при комнатной температуре. Затем зонд STX был подключен к измерителю EVOM 2 (Both World Precision Instruments, Соединенное Королевство) и вставлен во вставку Transwell.Электрод состоит из двух частей, которые имеют разную длину: более длинная часть электрода была помещена так, чтобы слегка касаться дна планшета для культивирования клеток, в то время как более короткий электрод располагался немного выше вставной чашки, не полностью контактируя со слоем клеток HBMEC. . Следует соблюдать осторожность, чтобы не повредить нейроны в нижней части клеточной пластины, см. технические комментарии и ограничения.
4v).Также проводилось наблюдение с помощью светового микроскопа, чтобы убедиться в слиянии клеток и успешном образовании нейритов. Для обеспечения согласованности измерения TEER всегда следует считывать не менее чем через 24 часа после смены среды. Вкратце, электроды STX3 стерилизовали, помещая кончики зонда в 70% этанол, а затем уравновешивали в течение 15 минут в культуральной среде эндотелиальных клеток при комнатной температуре. Затем зонд STX был подключен к измерителю EVOM 2 (Both World Precision Instruments, Соединенное Королевство) и вставлен во вставку Transwell.Электрод состоит из двух частей, которые имеют разную длину: более длинная часть электрода была помещена так, чтобы слегка касаться дна планшета для культивирования клеток, в то время как более короткий электрод располагался немного выше вставной чашки, не полностью контактируя со слоем клеток HBMEC. . Следует соблюдать осторожность, чтобы не повредить нейроны в нижней части клеточной пластины, см. технические комментарии и ограничения. Поскольку значения TEER очень чувствительны к изменениям, важно держать электрод в вертикальном положении и избегать наклона, так как это может вызвать колебания значений TEER.Было получено фоновое значение для вкладыша только со средой для культивирования клеток, которое вычиталось из каждого показания (показания повторялись дважды для обеспечения воспроизводимости), а затем умножались на 1,12 для определения площади вкладыша для клеточной культуры (см 2 ) (Hind, 2014).
Поскольку значения TEER очень чувствительны к изменениям, важно держать электрод в вертикальном положении и избегать наклона, так как это может вызвать колебания значений TEER.Было получено фоновое значение для вкладыша только со средой для культивирования клеток, которое вычиталось из каждого показания (показания повторялись дважды для обеспечения воспроизводимости), а затем умножались на 1,12 для определения площади вкладыша для клеточной культуры (см 2 ) (Hind, 2014).
Дексаметазоновый протокол
Дексаметазон представляет собой синтетический глюкокортикоид, и несколько групп показали, что он способен искусственно повышать прочность барьера (Shi and Zheng, 2005; Pyrgos et al., 2010; Hind, 2014).Поэтому мы использовали дексаметазон в качестве положительного контроля для исследования любой потенциальной разницы в ответе трех- и четырехклеточной модели на применение лекарственного средства. Записывали исходные показания TEER и заменяли среду, затем в апикальное отделение трансвелловой вставки добавляли дексаметазон, получая конечную концентрацию 1 мкМ. TEER измеряли через 2, 4 и 24 часа.
TEER измеряли через 2, 4 и 24 часа.
Анализ данных
Анализ данных проводили с использованием программного обеспечения GraphPad prism (La Jolla, CA, США).Данные представлены как среднее значение ± стандартная ошибка среднего и проанализированы с использованием двухфакторного дисперсионного анализа с последующим тестом множественных сравнений Сидака или Турции. ∗ P < 0,05 считалось значимым.
Технические комментарии и ограничения
Важным шагом для создания четырехклеточной модели является определение времени, а также возрождение и посев человеческих нейронов. Добавление ячеек в неправильное время приведет к тому, что модель будет работать не так эффективно, а значения TEER будут ниже ожидаемых.Поэтому мы наметили временную шкалу для настройки модели (рис. 2), шаги 4 и 5 могут варьироваться в зависимости от времени, необходимого для образования барьера и образования нейритов нейронами. Неправильная техника посева нейронов на покровные приведет к неравномерности и неадекватному образованию нейритов. Убедитесь, что покровные стекла достаточно высушены на воздухе, а суспензия нейронов тщательно, но адекватно перемешана в процессе возрождения и посева. Избегайте удаления нейронов из инкубатора в течение длительного времени.
Убедитесь, что покровные стекла достаточно высушены на воздухе, а суспензия нейронов тщательно, но адекватно перемешана в процессе возрождения и посева. Избегайте удаления нейронов из инкубатора в течение длительного времени.
При измерении значений TEER убедитесь, что большая часть зонда STX не касается нейронов, культивируемых на покровном стекле. Это особенно важно, если выполняется несколько измерений (рекомендуется). Также возможно использование нейронов после завершения первичных экспериментов. Окрашивание покровных стекол можно проводить с использованием различных методов, включая окрашивание йодидом пропидия (PI) и DAPI, можно лизировать нейроны и проводить внутриклеточные анализы.
Результаты
Разработка протокола
При разработке модели BBB сравнивались различные настройки, в том числе; введите размер пор, размер пластины и организацию клеток.На рис. 2 показаны этапы разработки протокола и соответствующие им значения TEER до добавления нейронов в модель. На рисунке 2А показано, что поры большего размера (3,0 мкм) демонстрируют большую барьерную целостность (о чем свидетельствуют более высокие показания TEER), чем поры меньшего размера (0,4 мкм). Кроме того, 12-луночные вставки показали значительно более высокие значения TEER, чем 24-луночные вставки. Продолжая разработку модели с использованием 12 вставок размером 3,0 мкм, на рисунке 2B сравниваются три различных набора клеточных культур через несколько дней после создания модели.На третий и четвертый дни вставки, содержащие смешанную культуру астроцитов и перицитов, демонстрировали значительно более высокие показания TEER, чем установки, содержащие астроциты или перициты, посеянные на нижней стороне вставок или на дне планшета для культивирования клеток, P < 0,05 и P <0,01 соответственно.
На рисунке 2А показано, что поры большего размера (3,0 мкм) демонстрируют большую барьерную целостность (о чем свидетельствуют более высокие показания TEER), чем поры меньшего размера (0,4 мкм). Кроме того, 12-луночные вставки показали значительно более высокие значения TEER, чем 24-луночные вставки. Продолжая разработку модели с использованием 12 вставок размером 3,0 мкм, на рисунке 2B сравниваются три различных набора клеточных культур через несколько дней после создания модели.На третий и четвертый дни вставки, содержащие смешанную культуру астроцитов и перицитов, демонстрировали значительно более высокие показания TEER, чем установки, содержащие астроциты или перициты, посеянные на нижней стороне вставок или на дне планшета для культивирования клеток, P < 0,05 и P <0,01 соответственно.
Моделирование модели OGD
Чтобы оценить влияние присутствия разных клеток, изменения TEER в моделях D и E, показанных на рис. 1, сравнивали в соответствии с протоколом OGD. На рисунке 5A показаны различные ответы трехклеточной и четырехклеточной модели в ответ на 4-часовой протокол OGD с последующим периодом реперфузии. Трехклеточный режим показал примерно 30-процентное снижение TEER по сравнению с исходным уровнем через 4 часа OGD. Это контрастирует с моделью с четырьмя ячейками, которая показала 50% снижение TEER после OGD и значительно отличалась от модели с тремя ячейками P <0,05. После OGD, когда была начата реперфузия, TEER смогла вернуться к исходному уровню в трехклеточной модели, однако проницаемость ГЭБ восстановилась лишь незначительно на 20% в четырехклеточной модели.Это значительно отличалось через 24 часа ( P <0,01), но не через 48 или 72 часа. Изображения 5B и C показывают световой микроскоп изображения нейронов в четырехклеточной модели до и сразу после протокола OGD, соответственно. На рисунке 5C отчетливо видны скопления нейронов вместе с очевидной фрагментацией нейритов по сравнению с рисунком 5B, показывающим здоровые нейроны до OGD.
На рисунке 5A показаны различные ответы трехклеточной и четырехклеточной модели в ответ на 4-часовой протокол OGD с последующим периодом реперфузии. Трехклеточный режим показал примерно 30-процентное снижение TEER по сравнению с исходным уровнем через 4 часа OGD. Это контрастирует с моделью с четырьмя ячейками, которая показала 50% снижение TEER после OGD и значительно отличалась от модели с тремя ячейками P <0,05. После OGD, когда была начата реперфузия, TEER смогла вернуться к исходному уровню в трехклеточной модели, однако проницаемость ГЭБ восстановилась лишь незначительно на 20% в четырехклеточной модели.Это значительно отличалось через 24 часа ( P <0,01), но не через 48 или 72 часа. Изображения 5B и C показывают световой микроскоп изображения нейронов в четырехклеточной модели до и сразу после протокола OGD, соответственно. На рисунке 5C отчетливо видны скопления нейронов вместе с очевидной фрагментацией нейритов по сравнению с рисунком 5B, показывающим здоровые нейроны до OGD.
Рисунок 5. (A) Влияние протокола 4-часовой кислородно-глюкозной депривации (OGD) на трансэпителиальную резистентность (TEER) как маркер герметичности барьера в трехклеточной модели (HBMEC, астроциты и перициты) и четырехклеточная модель (HBMEC, астроциты, перициты и нейроны).Нейронные изображения, полученные из четырехклеточной модели (B) до OGD 40× и (C) изображений нейронов сразу после OGD 40×. Данные представлены как среднее значение ± стандартная ошибка среднего, n = 3–6 из двух экспериментальных повторов, рассчитанное как процентное изменение от исходных показаний TEER. Статистический анализ был проведен с использованием двухстороннего ANOVA с тестом множественных сравнений Сидака, ∗ P <0,05 и ∗∗ P <0,01 считались значимыми.
Применение дексаметазона
Дексаметазон повышал плотность барьера во всех трех моделях, о чем свидетельствует увеличение TEER и общая значимость в результате взаимодействия лекарственных средств в трехклеточной и четырехклеточной модели, P < 0. 05. Модель с двумя ячейками была самой нестабильной из трех моделей, о чем свидетельствуют большие колебания и изменчивость измерений TEER (рис. 6А). Трехклеточная модель была значительно более стабильной, но различия в TEER между обработанными дексаметазоном и контролем наблюдались только через 2 часа (рис. 6B). Четырехклеточная модель показала самое быстрое увеличение плотности барьера (т. е. увеличение TEER) в результате применения дексаметазона (рис. 6C), и это достигло значимости по сравнению с контрольным носителем через 2 и 24 ч ( P < 0.05).
05. Модель с двумя ячейками была самой нестабильной из трех моделей, о чем свидетельствуют большие колебания и изменчивость измерений TEER (рис. 6А). Трехклеточная модель была значительно более стабильной, но различия в TEER между обработанными дексаметазоном и контролем наблюдались только через 2 часа (рис. 6B). Четырехклеточная модель показала самое быстрое увеличение плотности барьера (т. е. увеличение TEER) в результате применения дексаметазона (рис. 6C), и это достигло значимости по сравнению с контрольным носителем через 2 и 24 ч ( P < 0.05).
Рисунок 6. Влияние дексаметазона на трансэпителиальную резистентность (TEER) как меру плотности барьера в (A) двухклеточном (астроциты и HBMECs), (B) трехклеточном (астроциты, HBMECs и перициты) и (C) четырехклеточная модель (астроциты, HBMEC, перициты и нейроны). Дексаметазон (1 мкМ) добавляли к люминальной стороне и использовали в качестве положительного контроля, который, как известно, снижает проницаемость и, таким образом, увеличивает TEER. Данные представлены как среднее ± SEM, n = 4 из двух экспериментальных повторов.Статистический анализ был проведен с использованием двухстороннего ANOVA с тестом множественных сравнений Сидака, ∗ P <0,05 считалось значимым.
Данные представлены как среднее ± SEM, n = 4 из двух экспериментальных повторов.Статистический анализ был проведен с использованием двухстороннего ANOVA с тестом множественных сравнений Сидака, ∗ P <0,05 считалось значимым.
Обсуждение
ГЭБ может быть нарушен при различных состояниях, включая, помимо прочего, ишемический инсульт, болезнь Альцгеймера, рак и рассеянный склероз (РС). Исследования этих расстройств, влияющих на ГЭБ, затруднены трансляционными трудностями, в результате чего многие потенциальные соединения и / или методы лечения не могут превзойти клинические испытания фазы I / II.Это, по крайней мере частично, связано с отсутствием подходящих моделей in vitro , которые могут предсказывать эффективность лекарств на доклинических этапах. Большинство, если не все, современные модели BBB имеют «подводные камни», будь то стоимость, время или ресурсы. Модели, которые предлагают наиболее близкое представление о ГЭБ, часто сложны и дороги в воспроизведении, что увеличивает стоимость процесса скрининга лекарств. Чтобы улучшить переводимость данных in vitro , мы разработали модель в стиле Transwell, которая включает четыре основных типа клеток человека, представляя NVU больше, чем другие доступные в настоящее время модели BBB.Мы обнаружили, что наша новая четырехклеточная модель лучше моделирует ишемический инсульт и применение лекарств in vitro по сравнению с трехклеточной и двухклеточной моделью, что показано изменениями TEER как меры целостности барьера и применением дексаметазона.
Чтобы улучшить переводимость данных in vitro , мы разработали модель в стиле Transwell, которая включает четыре основных типа клеток человека, представляя NVU больше, чем другие доступные в настоящее время модели BBB.Мы обнаружили, что наша новая четырехклеточная модель лучше моделирует ишемический инсульт и применение лекарств in vitro по сравнению с трехклеточной и двухклеточной моделью, что показано изменениями TEER как меры целостности барьера и применением дексаметазона.
Последствия тестирования на наркотики
Эффект дексаметазона оценивали на трех трансвелл-моделях; модель с двумя, тремя и четырьмя ячейками. Большая нестабильность барьерной силы и более медленный ответ были обнаружены в двухклеточной модели после применения дексаметазона.Это также может свидетельствовать о том, что модели, содержащие только два типа клеток, в данном случае астроциты и HBMEC, также будут по-разному реагировать на применение других лекарств, и поэтому их недостаточно для реального моделирования взаимодействия лекарств на ГЭБ. В то время как модель с тремя клетками имела ту же тенденцию к увеличению прочности барьера, она демонстрировала более стабильные значения TEER по сравнению с моделью с двумя клетками, а лунки, обработанные дексаметазоном, в целом значительно отличались от контрольных лунок с носителем. Кроме того, введение перицитов (создание трехклеточной модели) привело к значительному увеличению базового уровня TEER с 30 до 40 Ом, что еще раз подчеркивает роль перицитов в укреплении стабильности сосудов при ГЭБ и необходимость их присутствия в моделях ГЭБ (Bergers и Song, 2005; Dohgu et al., 2005; Накагава и др., 2007 г.; Ferland-McCollough et al., 2017) Интересно, что модель с четырьмя клетками продемонстрировала значительное увеличение плотности барьера (о чем свидетельствует увеличение TEER) по сравнению с контрольным носителем всего через 2 часа после применения дексаметазона. Хотя нейроны в этой модели напрямую не взаимодействуют с ГЭБ, было показано, что нейроны секретируют ряд вазоактивных веществ, включая VEGF, которые влияют на свойства формирования барьера и ранний ангиогенез (Engelhardt, 2003; Eichmann and Thomas, 2013).
В то время как модель с тремя клетками имела ту же тенденцию к увеличению прочности барьера, она демонстрировала более стабильные значения TEER по сравнению с моделью с двумя клетками, а лунки, обработанные дексаметазоном, в целом значительно отличались от контрольных лунок с носителем. Кроме того, введение перицитов (создание трехклеточной модели) привело к значительному увеличению базового уровня TEER с 30 до 40 Ом, что еще раз подчеркивает роль перицитов в укреплении стабильности сосудов при ГЭБ и необходимость их присутствия в моделях ГЭБ (Bergers и Song, 2005; Dohgu et al., 2005; Накагава и др., 2007 г.; Ferland-McCollough et al., 2017) Интересно, что модель с четырьмя клетками продемонстрировала значительное увеличение плотности барьера (о чем свидетельствует увеличение TEER) по сравнению с контрольным носителем всего через 2 часа после применения дексаметазона. Хотя нейроны в этой модели напрямую не взаимодействуют с ГЭБ, было показано, что нейроны секретируют ряд вазоактивных веществ, включая VEGF, которые влияют на свойства формирования барьера и ранний ангиогенез (Engelhardt, 2003; Eichmann and Thomas, 2013). Эти сравнительные данные подчеркивают различия в данных, полученных на моделях, содержащих разные типы клеток, и их влияние на скрининг наркотиков. Это подчеркивает важность наличия более репрезентативной модели BBB, содержащей дополнительные клетки, присутствующие в NVU.
Эти сравнительные данные подчеркивают различия в данных, полученных на моделях, содержащих разные типы клеток, и их влияние на скрининг наркотиков. Это подчеркивает важность наличия более репрезентативной модели BBB, содержащей дополнительные клетки, присутствующие в NVU.
Последствия для тестирования протокола
В настоящее время имеется широкий спектр доступных моделей in vitro ГЭБ, но, несмотря на многообещающие разработки в моделировании ГЭБ, в разработке моделей все еще существуют пробелы, в первую очередь невозможность включить все типы клеток, присутствующие в NVU.В то время как большинство трансвелловых систем включают астроциты и HBMEC, только в более поздних исследованиях в эти модели были введены перициты или нейроны. Чтобы лучше понять, как эти клетки способствуют разрушению ГЭБ в условиях ишемии, мы подвергли наши трехклеточные и четырехклеточные модели протоколу OGD и измерили TEER в течение долгого времени, чтобы оценить изменения в целостности барьера. Интересно, что мы обнаружили, что при наличии нейронов наша модель демонстрировала большее снижение TEER по сравнению с трехклеточной моделью, которая содержала только астроциты, перициты и HBMEC.Точно так же, в то время как модель с тремя клетками смогла восстановиться через 24 часа после OGD, модель с четырьмя клетками восстановилась лишь незначительно, примерно на 20%, что подчеркивает роль и чувствительность нейронов в уровне повреждения, вызванного протоколом OGD. В целом мы показали, что с добавлением нейронов наша модель стала более уязвимой к повреждениям; демонстрируя большую потерю прочности барьера, показанную снижением TEER, подтверждая предыдущую работу, которая показала, что ишемизированные нейроны разрушают эндотелиальный барьер за счет увеличения секреции VEGF (Li et al., 2014). Таким образом, исключение нейронов из моделирования инсульта ГЭБ привело бы к недооценке вызванного повреждения и вклада нейронов в разрушение ГЭБ после ишемии.
Интересно, что мы обнаружили, что при наличии нейронов наша модель демонстрировала большее снижение TEER по сравнению с трехклеточной моделью, которая содержала только астроциты, перициты и HBMEC.Точно так же, в то время как модель с тремя клетками смогла восстановиться через 24 часа после OGD, модель с четырьмя клетками восстановилась лишь незначительно, примерно на 20%, что подчеркивает роль и чувствительность нейронов в уровне повреждения, вызванного протоколом OGD. В целом мы показали, что с добавлением нейронов наша модель стала более уязвимой к повреждениям; демонстрируя большую потерю прочности барьера, показанную снижением TEER, подтверждая предыдущую работу, которая показала, что ишемизированные нейроны разрушают эндотелиальный барьер за счет увеличения секреции VEGF (Li et al., 2014). Таким образом, исключение нейронов из моделирования инсульта ГЭБ привело бы к недооценке вызванного повреждения и вклада нейронов в разрушение ГЭБ после ишемии.
Ограничения и будущее развитие
Хотя наша модель теперь включает четыре клетки, присутствующие в NVU, наша модель не включает поток, который является важной особенностью для поддержания фенотипа BBB in vitro. Исследования показали, что чистый стресс имеет решающее значение для увеличения продолжительности жизни клеток и влияния на клеточный фенотип, регулирования транспорта ГЭБ, предотвращения дедифференцировки (Desai et al., 2002; Чиу и др., 2005; Партыка и др., 2017). Культивирование HBMECs при физиологическом сдвиговом напряжении особенно важно в условиях ишемического инсульта, поскольку происходит прерывание кровотока. Преимущество микрожидкостных систем, имитирующих физиологический поток, заключается в том, что они могут имитировать непрерывный поток, улучшая трансляцию в окружающую среду (Partyka et al., 2017; Wang et al., 2017).
Исследования показали, что чистый стресс имеет решающее значение для увеличения продолжительности жизни клеток и влияния на клеточный фенотип, регулирования транспорта ГЭБ, предотвращения дедифференцировки (Desai et al., 2002; Чиу и др., 2005; Партыка и др., 2017). Культивирование HBMECs при физиологическом сдвиговом напряжении особенно важно в условиях ишемического инсульта, поскольку происходит прерывание кровотока. Преимущество микрожидкостных систем, имитирующих физиологический поток, заключается в том, что они могут имитировать непрерывный поток, улучшая трансляцию в окружающую среду (Partyka et al., 2017; Wang et al., 2017).
Точно так же появляется все больше доказательств роли клеток микроглии в разрушении ГЭБ.Было показано, что эти резидентные иммунные клетки головного мозга высвобождают провоспалительные медиаторы, которые повышают проницаемость барьера и снижают уровень некоторых TJ, таким образом, играя ключевую роль в разрушении ГЭБ при патологических состояниях (da Fonseca et al. , 2014; Shigemoto-Mogami et al. ., 2018) Таким образом, будущая работа должна оценить, могут ли дополнительные ячейки и напряжение сдвига быть включены в модели типа Transwell.
, 2014; Shigemoto-Mogami et al. ., 2018) Таким образом, будущая работа должна оценить, могут ли дополнительные ячейки и напряжение сдвига быть включены в модели типа Transwell.
Заключение
Общая функция NVU заключается в перфузии мозговой ткани для снабжения нейронов необходимыми питательными веществами и способности нейронов регулировать этот кровоток.Глия, а именно астроциты, выступают посредниками между сосудистым и нервным компартментами (Lo et al., 2015). Перициты обеспечивают дополнительный уровень связи между эндотелием и астроцитами, а также выполняют важную иммунную функцию (Darland et al., 2003; Armulik et al., 2011; Kovac et al., 2011). При церебральной ишемии эти сложные взаимодействия нарушаются, и гомеостаз утрачивается вследствие функциональных, морфологических и метаболических изменений внутри НВУ (Lo et al., 2015).Важно смоделировать, как эти клетки взаимодействуют как в нормоксических, так и в ишемических условиях, чтобы изучить патофизиологию ишемического инсульта. Наконец, системы Transwell предлагают заметные преимущества по сравнению с более сложными моделями, поскольку они поддерживают более простую настройку клеточной культуры и часто используют минимальные ресурсы. Мы считаем, что наша модель предлагает более точное представление о ГЭБ, сохраняя при этом простоту установки трансвелла.
Наконец, системы Transwell предлагают заметные преимущества по сравнению с более сложными моделями, поскольку они поддерживают более простую настройку клеточной культуры и часто используют минимальные ресурсы. Мы считаем, что наша модель предлагает более точное представление о ГЭБ, сохраняя при этом простоту установки трансвелла.
Доступность данных
Наборы данных, созданные для этого исследования, доступны по запросу соответствующему автору.
Вклад авторов
NS выполнил исследование. TE и SO’S разработали исследование. NS и SO’S проанализировали данные. NS, TE и SO’S написали рукопись.
Финансирование
Работа выполнена при поддержке Исследовательского совета по биотехнологии и биологическим наукам (грант № BB/M008770/1).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Abbott, N.J., Patabendige, A.A.K., Dolman, D.E.M., Yusof, S.R., and Begley, D.J. (2010). Структура и функция гематоэнцефалического барьера. Нейробиол. Дис. 37, 13–25. doi: 10.1016/j.nbd.2009.07.030
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Аллен, К.Л., и Байрактутан, У. (2009). Антиоксиданты ослабляют опосредованную гипергликемией дисфункцию эндотелиальных клеток головного мозга и гиперпроницаемость гематоэнцефалического барьера. Диабет Ожирение. Метаб. 11, 480–490. doi: 10.1111/j.1463-1326.2008.00987.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Appelt-Menzel, A., Cubukova, A., Günther, K., Edenhofer, F., Piontek, J., Krause, G., et al. (2017). Создание модели совместной культуры гематоэнцефалического барьера человека, имитирующей нейроваскулярную единицу, с использованием индуцированных плюри- и мультипотентных стволовых клеток. Представитель стволовых клеток 8, 894–906. doi: 10.1016/j.stemcr.2017.02.021
doi: 10.1016/j.stemcr.2017.02.021
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Армулик А., Женове Г. и Бетшольц К. (2011). Перициты: развитие, физиологические и патологические перспективы, проблемы и перспективы. Дев. Ячейка 21, 193–215. doi: 10.1016/j.devcel.2011.07.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Аттвелл, Д., Бьюкен, А.М., Чарпак, С., Лауритцен, М., МакВикар, Б.А., и Ньюман, Э.А. (2010). Глиальный и нейрональный контроль мозгового кровотока. Природа 468, 232–243. doi: 10.1038/nature09613
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Борхес, Н., Ши Ф., Азеведо И. и Аудус К.Л. (1994). Изменения проницаемости монослоя эндотелиальных клеток микрососудов головного мозга под действием адренергических препаратов. евро. Дж. Фармакол. Мол. Фармакол. 269, 243–248. дои: 10.1016/0922-4106(94)
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chiu, J. J., Chen, L.J., Chang, S.F., Lee, P.L., Lee, C.I., Tsai, M.C., et al. (2005). Напряжение сдвига ингибирует экспрессию генов воспаления, индуцированную клетками гладкой мускулатуры, в эндотелиальных клетках: роль NF-κB. Артериосклероз. тромб. Васк. биол. 25, 963–969. doi: 10.1161/01.ATV.0000159703.43374.19
J., Chen, L.J., Chang, S.F., Lee, P.L., Lee, C.I., Tsai, M.C., et al. (2005). Напряжение сдвига ингибирует экспрессию генов воспаления, индуцированную клетками гладкой мускулатуры, в эндотелиальных клетках: роль NF-κB. Артериосклероз. тромб. Васк. биол. 25, 963–969. doi: 10.1161/01.ATV.0000159703.43374.19
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Cho, C.F., Wolfe, J.M., Fadzen, C.M., Calligaris, D., Hornburg, K., Chiocca, E.A., et al. (2017). Сфероиды гематоэнцефалического барьера как платформа для скрининга агентов, проникающих в мозг, in vitro. Нац. коммун. 8:15623. doi: 10.1038/ncomms15623
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
да Фонсека, А.C.C., Matias, D., Garcia, C., Amaral, R., Geraldo, L.H., Freitas, C., et al. (2014). Влияние активации микроглии на гематоэнцефалический барьер при заболеваниях головного мозга. Фронт. Клетка. Неврологи. 8:362. doi: 10.3389/fncel. 2014.00362
2014.00362
Полнотекстовая перекрестная ссылка | Академия Google
Darland, D.C., Massingham, L.J., Smith, S.R., Piek, E., Saint-Geniez, M., и D’Amore, P.A. (2003). Продукция перицитами ассоциированного с клеткой VEGF зависит от дифференцировки и связана с выживаемостью эндотелия. Дев. биол. 264, 275–288. doi: 10.1016/j.ydbio.2003.08.015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Desai, S.Y., Marroni, M., Cucullo, L., Krizanac-Bengez, L., Mayberg, M.R., Hossain, M.T., et al. (2002). Механизмы выживания эндотелия при сдвиговом напряжении. Эндотель. Дж. Эндотель. Сотовый рез. 9, 89–102. дои: 10.1080/10623320212004
Полнотекстовая перекрестная ссылка | Академия Google
Дохгу С., Таката Ф., Ямаути А., Nakagawa, S., Egawa, T., Naito, M., et al. (2005). Перициты головного мозга способствуют индукции и усилению функций гематоэнцефалического барьера за счет продукции трансформирующего фактора роста-β. Мозг Res. 1038, 208–215. doi: 10.1016/j.brainres.2005.01.027
Мозг Res. 1038, 208–215. doi: 10.1016/j.brainres.2005.01.027
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дор-Даффи, П. (2008). Перициты: полипотентные клетки гематоэнцефалического барьера. Курс. фарм. Дес. 14, 1581–1593. дои: 10.2174/138161208784705469
Полнотекстовая перекрестная ссылка | Академия Google
Ферланд-МакКоллоу, Д., Слейтер С., Ричард Дж., Рени К. и Мангиаларди Г. (2017). Перициты, упускаемый из виду игрок в сосудистой патобиологии. Фармакол. тер. 171, 30–42. doi: 10.1016/j.pharmthera.2016.11.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Gaillard, P.J., Voorwinden, L.H., Nielsen, J.L., Ivanov, A., Atsumi, R., Engman, H., et al. (2000). Создание и функциональная характеристика модели гематоэнцефалического барьера in vitro, включающей совместную культуру эндотелиальных клеток капилляров головного мозга и астроцитов. евро. Дж. Фарм. науч. 12, 215–222. doi: 10.1016/S0928-0987(00)00123-8
науч. 12, 215–222. doi: 10.1016/S0928-0987(00)00123-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Харц, А.М.С., Миллер, Д.С., и Бауэр, Б. (2010). Восстановление гематоэнцефалического барьера Р-гликопротеин снижает содержание амилоида в мозге в мышиной модели болезни Альцгеймера. Мол. Фармакол. 77, 715–723. doi: 10.1124/моль.109.061754
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hind, WH (2014). Влияние каннабиноидов на проницаемость гематоэнцефалического барьера in vitro. к.т.н. диссертация, Ноттингемский университет, Ноттингем.
Академия Google
Hind, W.H., England, T.J., и O’Sullivan, S.E. (2016). Каннабидиол защищает модель гематоэнцефалического барьера in vitro от кислородно-глюкозного голодания через рецепторы PPARγ и 5-HT1A. Бр. Дж. Фармакол. 173, 815–825. doi: 10.1111/bph.13368
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хинд, В. Х., Туфарелли, К., Неофиту, М., Андерсон, С.И., Англия, Т.Дж., и О’Салливан, С.Е. (2015). Эндоканнабиноиды модулируют проницаемость гематоэнцефалического барьера человека in vitro. Бр. Дж. Фармакол. 172, 3015–3027. doi: 10.1111/bph.13106
Х., Туфарелли, К., Неофиту, М., Андерсон, С.И., Англия, Т.Дж., и О’Салливан, С.Е. (2015). Эндоканнабиноиды модулируют проницаемость гематоэнцефалического барьера человека in vitro. Бр. Дж. Фармакол. 172, 3015–3027. doi: 10.1111/bph.13106
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Касем К., Лакомб П., Сейлаз Дж. и Бонвенто Г. (1998). Структурная организация периваскулярных концов астроцитов и их взаимосвязь с эндотелиальным переносчиком глюкозы: исследование с помощью конфокальной микроскопии. Глия 23, 1–10.
Реферат PubMed | Академия Google
Ковач, А., Эриксон, М.А., Бэнкс, В.А., Нойвельт, Э., Эбботт, Н., Эбри, Л., и соавт. (2011). Перициты микрососудов головного мозга иммуноактивны в культуре: экспрессия цитокинов, хемокинов, оксида азота и LRP-1 в ответ на липополисахарид. J. Нейровоспаление. 8:139. дои: 10.1186/1742-2094-8-139
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, Ю. Н., Пан, Р., Qin, X.J., Yang, W.L., Qi, Z., Liu, W., et al. (2014). Ишемизированные нейроны активируют астроциты, чтобы разрушить эндотелиальный барьер посредством увеличения экспрессии VEGF. Дж. Нейрохим. 129, 120–129. doi: 10.1111/jnc.12611
Н., Пан, Р., Qin, X.J., Yang, W.L., Qi, Z., Liu, W., et al. (2014). Ишемизированные нейроны активируют астроциты, чтобы разрушить эндотелиальный барьер посредством увеличения экспрессии VEGF. Дж. Нейрохим. 129, 120–129. doi: 10.1111/jnc.12611
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Liebner, S., Corada, M., Bangsow, T., Babbage, J., Taddei, A., Czupalla, C.J., et al. (2008). Передача сигналов Wnt/β-catenin контролирует развитие гематоэнцефалического барьера. Дж. Сотовый. биол. 183, 409–417.doi: 10.1083/jcb.200806024
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ло Э., Менделоу А., Сакко Р. и Вонг Л. (2015). «7. Нервно-сосудистый блок и реакция на ишемию», в Stroke , eds J. Grotta, G. Albers, J. Broderickm, S. Kasner, E. Lo, R. Sacco, et al. (Амстердам: Эльзевир).
Академия Google
Мартини Ф. и Варфоломей Э. Ф. (2017). Основы анатомии и физиологии. Амстердам: Эльзевир.
Амстердам: Эльзевир.
Академия Google
Накагава, С., Дели, М.А., Кавагути, Х., Симизудани, Т., Шимоно, Т., Киттель, А, и др. (2009). Новая модель гематоэнцефалического барьера с использованием первичных эндотелиальных клеток головного мозга крысы, перицитов и астроцитов. Нейрохим. Междунар. 54, 253–263. doi: 10.1016/j.neuint.2008.12.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Накагава С., Дели М.А., Накао С., Хонда М., Хаяши К., Накаоке Р. и др. (2007). Перициты из микрососудов головного мозга усиливают целостность барьера в первичных культурах эндотелиальных клеток головного мозга крысы. Сотовый. Мол. Нейробиол. 27:687. doi: 10.1007/s10571-007-9195-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ниего, Б., и Медкалф, Р.Л. (2013). Усовершенствованный метод подготовки контактной модели гематоэнцефалического барьера на основе клеток человека ∗ . Дж. Вис. Эксп. 81:e50934. дои: 10.3791/50934
Дж. Вис. Эксп. 81:e50934. дои: 10.3791/50934
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нзоу Г., Уикс Р. Т., Уикс Э. Э., Сил С.A., Sane, C.H., Chen, A., et al. (2018). Сфероид коры головного мозга человека с функциональным гематоэнцефалическим барьером для высокопроизводительного скрининга нейротоксичности и моделирования заболеваний. Науч. Респ. 8:7413. doi: 10.1038/s41598-018-25603-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Oberheim, N.A., Takano, T., Han, X., He, W., Lin, J.H.C., Wang, F., et al. (2009). Уникальные гоминидные черты астроцитов взрослого человека. J. Neurosci. 29, 3276–3287. дои: 10.1523/JNEUROSCI.4707-08.2009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Partyka, P.P., Godsey, G.A., Galie, J.R., Kosciuk, M.C., Acharya, N.K., Nagele, R.G., et al. (2017). Механический стресс регулирует транспорт в соответствующей 3D-модели гематоэнцефалического барьера. Биоматериалы 115, 30–39. doi: 10.1016/j.biomaterials.2016.11.012
Биоматериалы 115, 30–39. doi: 10.1016/j.biomaterials.2016.11.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пипер К., Пиелох П. и Галла Х.Дж. (2013). Перициты поддерживают трансмиграцию нейтрофилов через интерлейкин-8 через модель совместного культивирования свиней через гематоэнцефалический барьер. Мозг Res. 1524, 1–11. doi: 10.1016/j.brainres.2013.05.047
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пиргос, В., Миккиен, Д., Сейн, Т., Коттон, М., Франсескони, А., Мизрахи, И., и соавт. (2010). Влияние иммуномодулирующих и ассоциированных с организмом молекул на проницаемость модели гематоэнцефалического барьера in vitro для амфотерицина В и флуконазола. Антимикроб. Агенты Чемотер. 54, 1305–1310. doi: 10.1128/AAC.01263-09
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рисау, В., Холлманн, Р., и Альбрехт, У. (1986). Зависимая от дифференцировки экспрессия белков в эндотелии головного мозга при развитии гематоэнцефалического барьера. Дев. биол. 117, 537–545. дои: 10.1016/0012-1606(86)
Дев. биол. 117, 537–545. дои: 10.1016/0012-1606(86)
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ши, Л.З. и Чжэн В. (2005). Создание эпителиальной транспортной системы барьера головного мозга in vitro для фармакологических и токсикологических исследований. Мозг Res. 1057, 37–48. doi: 10.1016/j.brainres.2005.07.046
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шигемото-Могами Ю., Хошикава К. и Сато К. (2018). Активированная микроглия разрушает гематоэнцефалический барьер и индуцирует хемокины и цитокины в модели крыс in vitro. Фронт. Клетка. Неврологи. 12:494. doi: 10.3389/fncel.2018.00494
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сринивасан, Б., Колли, А.Р., Эш, М.Б., Абачи, Х.Е., Шулер, М.Л., и Хикман, Дж.Дж. (2015). Методы измерения TEER для систем модели барьера in vitro. Дж. Лаб. автомат. 20, 107–126. дои: 10. 1177/2211068214561025
1177/2211068214561025
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Суини, доктор медицинских наук, Айядурай, С., и Злокович, Б.В. (2016).Перициты сосудисто-нервного блока: ключевые функции и сигнальные пути. Нац. Неврологи. 19, 771–783. doi: 10.1038/nn.4288
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Томсен, Л. Б., Беркхарт, А., и Моос, Т. (2015). Тройная культуральная модель гематоэнцефалического барьера с использованием эндотелиальных клеток головного мозга свиньи, астроцитов и перицитов. PLoS One 10:e0134765. doi: 10.1371/journal.pone.0134765
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван Ю., Ван, Н., Цай, Б., Ван, Г.Ю., Ли, Дж., и Пяо, X.X. (2015). In vitro модель гематоэнцефалического барьера, созданная совместным культивированием первичных церебральных микрососудистых эндотелиальных и астроцитарных клеток. Нейронная регенерация. Рез. 10, 2011–2017 гг. дои: 10.4103/1673-5374.172320
Рез. 10, 2011–2017 гг. дои: 10.4103/1673-5374.172320
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Ю. И., Абачи, Х. Э., и Шулер, М. Л. (2017). Модель микрожидкостного гематоэнцефалического барьера обеспечивает барьерные свойства in vivo для скрининга проницаемости лекарств. Биотехнология. биоинж. 114, 184–194. дои: 10.1002/бит.26045
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Уоррен М.С., Зеранге Н., Вудфорд К., Робертс Л.М., Тейт Э.Х., Фенг Б. и соавт. (2009). Сравнительные профили экспрессии генов транспортеров ABC в эндотелиальных клетках микрососудов головного мозга и головном мозге у пяти видов, включая человека. Фармакол. Рез. 59, 404–413. doi: 10.1016/j.phrs.2009.02.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вайденфеллер, К., Свендсен, К.Н., и Шуста, Е.В. (2007). Дифференцирующиеся эмбриональные нейральные клетки-предшественники индуцируют свойства гематоэнцефалического барьера. Дж. Нейрохим. 101, 555–565. doi: 10.1111/j.1471-4159.2006.04394.x
Дж. Нейрохим. 101, 555–565. doi: 10.1111/j.1471-4159.2006.04394.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йон, Дж. Х., На, Д., Чой, К., Рю, С. В., Чой, К., и Пак, Дж. К. (2012). Надежная система анализа проницаемости в микрожидкостном устройстве, имитирующем сосуды головного мозга. Биомед. Микроустройства. 14, 1141–1148.doi: 10.1007/s10544-012-9680-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhang, Y., Sloan, S.A., Clarke, L.E., Caneda, C., Plaza, C.A., Blumenthal, P.D., et al. (2016). Очистка и характеристика астроцитов-предшественников и зрелых астроцитов человека выявила транскрипционные и функциональные различия с мышами. Нейрон 89, 37–53. doi: 10.1016/j.neuron.2015.11.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Зонта, М., Angulo, M.C., Gobbo, S., Rosengarten, B., Hossmann, K.A., Pozzan, T., et al. (2003). Передача сигналов между нейронами и астроцитами занимает центральное место в динамическом контроле микроциркуляции головного мозга.
 Тяжелый
Тяжелый
 0- ГОСТ 19231.1.
0- ГОСТ 19231.1.
 Убедитесь, что на рабочей пластине нет масла, воды, моющих средств, пыли или любых других посторонних веществ, и что она полностью сухая. Стоит запустить его под ультрафиолетовым светом (или солнцем), чтобы быть уверенным, что не осталось жидкой смолы. Любое постороннее вещество отрицательно повлияет на клей.
Убедитесь, что на рабочей пластине нет масла, воды, моющих средств, пыли или любых других посторонних веществ, и что она полностью сухая. Стоит запустить его под ультрафиолетовым светом (или солнцем), чтобы быть уверенным, что не осталось жидкой смолы. Любое постороннее вещество отрицательно повлияет на клей. Снимите примерно 1-2 см с одного конца защитной ленты и начните прикреплять магнитный лист к рабочей пластине. Надавите на него от середины к углам, стараясь не захватить пузырьки. Медленно отклейте еще немного ленты и повторяйте это действие, пока не закончите весь лист.Отшлифуйте поверхность, поместив защитную ленту на магнитную поверхность и очень сильно помассировав ее кончиками пальцев (через ленту), покрывая каждое пятно магнитной поверхности.
Снимите примерно 1-2 см с одного конца защитной ленты и начните прикреплять магнитный лист к рабочей пластине. Надавите на него от середины к углам, стараясь не захватить пузырьки. Медленно отклейте еще немного ленты и повторяйте это действие, пока не закончите весь лист.Отшлифуйте поверхность, поместив защитную ленту на магнитную поверхность и очень сильно помассировав ее кончиками пальцев (через ленту), покрывая каждое пятно магнитной поверхности. Не забудьте ослабить все винты, прежде чем постепенно возвращать принтер в исходное положение, так как во время этой установки вы увеличили объем монтажной пластины и не хотите случайно треснуть экран.
Не забудьте ослабить все винты, прежде чем постепенно возвращать принтер в исходное положение, так как во время этой установки вы увеличили объем монтажной пластины и не хотите случайно треснуть экран. Сторона из матовой стали лучше прилипает к смоле. Если у вас все еще есть проблемы, увеличьте время начального слоя в программном обеспечении слайсера.
Сторона из матовой стали лучше прилипает к смоле. Если у вас все еще есть проблемы, увеличьте время начального слоя в программном обеспечении слайсера.
 servlet.JspServletWrapper.service(JspServletWrapper.java:432)
org.apache.jasper.servlet.JspServlet.serviceJspFile(JspServlet.java:395)
орг.apache.jasper.servlet.JspServlet.service(JspServlet.java:339)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.вызвать (JdbcWrapper.java: 286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
org.springframework.web.servlet.view.InternalResourceView.renderMergedOutputModel(InternalResourceView.java:168)
org.springframework.web.servlet.view.AbstractView.render(AbstractView.java:303)
org.springframework.web.servlet.DispatcherServlet.render(DispatcherServlet.
servlet.JspServletWrapper.service(JspServletWrapper.java:432)
org.apache.jasper.servlet.JspServlet.serviceJspFile(JspServlet.java:395)
орг.apache.jasper.servlet.JspServlet.service(JspServlet.java:339)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.вызвать (JdbcWrapper.java: 286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
org.springframework.web.servlet.view.InternalResourceView.renderMergedOutputModel(InternalResourceView.java:168)
org.springframework.web.servlet.view.AbstractView.render(AbstractView.java:303)
org.springframework.web.servlet.DispatcherServlet.render(DispatcherServlet. java:1257)
org.springframework.web.servlet.DispatcherServlet.processDispatchResult (DispatcherServlet.java:1037)
org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:980)
org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:897)
org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:970)
org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:861)
javax.servlet.http.HttpServlet.service(HttpServlet.java:620)
org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:846)
javax.servlet.http.HttpServlet.service(HttpServlet.ява: 727)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.
java:1257)
org.springframework.web.servlet.DispatcherServlet.processDispatchResult (DispatcherServlet.java:1037)
org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:980)
org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:897)
org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:970)
org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:861)
javax.servlet.http.HttpServlet.service(HttpServlet.java:620)
org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:846)
javax.servlet.http.HttpServlet.service(HttpServlet.ява: 727)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net. bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.java:286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
com.newport.genesis.storefront.filters.RedirectFilter.doFilter(RedirectFilter.java:245)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.CartRestorationFilter.doFilterInternal(CartRestorationFilter.java:123)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.ява: 225)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:317)
org.springframework.security.web.access.intercept.FilterSecurityInterceptor.invoke(FilterSecurityInterceptor.java:127)
org.springframework.security.web.access.intercept.FilterSecurityInterceptor.doFilter(FilterSecurityInterceptor.
bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.java:286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
com.newport.genesis.storefront.filters.RedirectFilter.doFilter(RedirectFilter.java:245)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.CartRestorationFilter.doFilterInternal(CartRestorationFilter.java:123)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.ява: 225)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:317)
org.springframework.security.web.access.intercept.FilterSecurityInterceptor.invoke(FilterSecurityInterceptor.java:127)
org.springframework.security.web.access.intercept.FilterSecurityInterceptor.doFilter(FilterSecurityInterceptor. java:91)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.access.ExceptionTranslationFilter.doFilter(ExceptionTranslationFilter.java:115)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.session.SessionManagementFilter.doFilter(SessionManagementFilter.java:137)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.AnonymousAuthenticationFilter.doFilter(AnonymousAuthenticationFilter.ява:111)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.rememberme.RememberMeAuthenticationFilter.doFilter(RememberMeAuthenticationFilter.java:150)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.
java:91)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.access.ExceptionTranslationFilter.doFilter(ExceptionTranslationFilter.java:115)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.session.SessionManagementFilter.doFilter(SessionManagementFilter.java:137)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.AnonymousAuthenticationFilter.doFilter(AnonymousAuthenticationFilter.ява:111)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.rememberme.RememberMeAuthenticationFilter.doFilter(RememberMeAuthenticationFilter.java:150)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.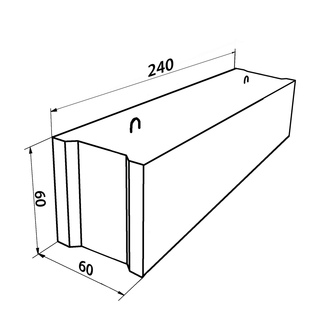 java:331)
org.springframework.security.web.servletapi.SecurityContextHolderAwareRequestFilter.doFilter(SecurityContextHolderAwareRequestFilter.java:169)
орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.savedrequest.RequestCacheAwareFilter.doFilter(RequestCacheAwareFilter.java:63)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.AbstractAuthenticationProcessingFilter.doFilter(AbstractAuthenticationProcessingFilter.java:200)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.logout.LogoutFilter.doFilter(LogoutFilter.java:121)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.header.HeaderWriterFilter.doFilterInternal (HeaderWriterFilter.
java:331)
org.springframework.security.web.servletapi.SecurityContextHolderAwareRequestFilter.doFilter(SecurityContextHolderAwareRequestFilter.java:169)
орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.savedrequest.RequestCacheAwareFilter.doFilter(RequestCacheAwareFilter.java:63)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.AbstractAuthenticationProcessingFilter.doFilter(AbstractAuthenticationProcessingFilter.java:200)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.logout.LogoutFilter.doFilter(LogoutFilter.java:121)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.header.HeaderWriterFilter.doFilterInternal (HeaderWriterFilter. java:66)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.context.request.async.WebAsyncManagerIntegrationFilter.doFilterInternal(WebAsyncManagerIntegrationFilter.java:56)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.context.SecurityContextPersistenceFilter.doFilter(SecurityContextPersistenceFilter.java:105)
орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.access.channel.ChannelProcessingFilter.doFilter(ChannelProcessingFilter.java:157)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.
java:66)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.context.request.async.WebAsyncManagerIntegrationFilter.doFilterInternal(WebAsyncManagerIntegrationFilter.java:56)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.context.SecurityContextPersistenceFilter.doFilter(SecurityContextPersistenceFilter.java:105)
орг.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.access.channel.ChannelProcessingFilter.doFilter(ChannelProcessingFilter.java:157)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org. springframework.security.web.FilterChainProxy.doFilterInternal (FilterChainProxy.java:214)
org.springframework.security.web.FilterChainProxy.doFilter(FilterChainProxy.java:177)
де.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.UrlEncoderFilter.doFilterInternal(UrlEncoderFilter.java:72)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.StorefrontFilter.doFilter(StorefrontFilter.java:99)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.cms.CMSSiteFilter.doFilterInternal(CMSSiteFilter.java:100)
org.springframework.web.filter.OncePerRequestFilter.
springframework.security.web.FilterChainProxy.doFilterInternal (FilterChainProxy.java:214)
org.springframework.security.web.FilterChainProxy.doFilter(FilterChainProxy.java:177)
де.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.UrlEncoderFilter.doFilterInternal(UrlEncoderFilter.java:72)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.StorefrontFilter.doFilter(StorefrontFilter.java:99)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.cms.CMSSiteFilter.doFilterInternal(CMSSiteFilter.java:100)
org.springframework.web.filter.OncePerRequestFilter. doFilter(OncePerRequestFilter.java:107)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
ком.ньюпорт.genesis.storefront.filters.RequestLoggerFilter.doFilter(RequestLoggerFilter.java:89)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.SessionFilter.doFilter(SessionFilter.java:96)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.Log4JFilter.doFilter(Log4JFilter.java:44)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.
doFilter(OncePerRequestFilter.java:107)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
ком.ньюпорт.genesis.storefront.filters.RequestLoggerFilter.doFilter(RequestLoggerFilter.java:89)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.SessionFilter.doFilter(SessionFilter.java:96)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.Log4JFilter.doFilter(Log4JFilter.java:44)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain. doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain.doFilterInternal(AbstractPlatformFilterChain.java:155)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346)
org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:201)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:178)
org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:197)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92)
org.springframework.web.filter.
doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain.doFilterInternal(AbstractPlatformFilterChain.java:155)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346)
org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:201)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:178)
org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:197)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92)
org.springframework.web.filter. template.page_tag._jspx_meth_template_005fmaster_005f0(page_tag.java:203)
org.apache.jsp.tag.webdesktop.template.page_tag.doTag(page_tag.java:166)
org.apache.jsp.WEB_002dINF.представления.desktop.pages.layout.static_jsp._jspx_meth_template_005fpage_005f0(static_jsp.java:142)
org.apache.jsp.WEB_002dINF.views.desktop.pages.layout.static_jsp._jspService(static_jsp.java:110)
org.apache.jasper.runtime.HttpJspBase.service(HttpJspBase.java:70)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
org.apache.jasper.servlet.JspServletWrapper.service(JspServletWrapper.java:432)
org.apache.jasper.servlet.JspServlet.serviceJspFile(JspServlet.java:395)
org.apache.jasper.servlet.JspServlet.сервис (JspServlet.java:339)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.
template.page_tag._jspx_meth_template_005fmaster_005f0(page_tag.java:203)
org.apache.jsp.tag.webdesktop.template.page_tag.doTag(page_tag.java:166)
org.apache.jsp.WEB_002dINF.представления.desktop.pages.layout.static_jsp._jspx_meth_template_005fpage_005f0(static_jsp.java:142)
org.apache.jsp.WEB_002dINF.views.desktop.pages.layout.static_jsp._jspService(static_jsp.java:110)
org.apache.jasper.runtime.HttpJspBase.service(HttpJspBase.java:70)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
org.apache.jasper.servlet.JspServletWrapper.service(JspServletWrapper.java:432)
org.apache.jasper.servlet.JspServlet.serviceJspFile(JspServlet.java:395)
org.apache.jasper.servlet.JspServlet.сервис (JspServlet.java:339)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java. lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.ява: 286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
org.springframework.web.servlet.view.InternalResourceView.renderMergedOutputModel(InternalResourceView.java:168)
org.springframework.web.servlet.view.AbstractView.render(AbstractView.java:303)
org.springframework.web.servlet.DispatcherServlet.render(DispatcherServlet.java:1257)
org.springframework.web.servlet.DispatcherServlet.processDispatchResult (DispatcherServlet.java:1037)
org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.ява: 980)
org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:897)
org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:970)
org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:861)
javax.servlet.http.HttpServlet.
lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.ява: 286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
org.springframework.web.servlet.view.InternalResourceView.renderMergedOutputModel(InternalResourceView.java:168)
org.springframework.web.servlet.view.AbstractView.render(AbstractView.java:303)
org.springframework.web.servlet.DispatcherServlet.render(DispatcherServlet.java:1257)
org.springframework.web.servlet.DispatcherServlet.processDispatchResult (DispatcherServlet.java:1037)
org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.ява: 980)
org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:897)
org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:970)
org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:861)
javax.servlet.http.HttpServlet. service(HttpServlet.java:620)
org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:846)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
орг.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.java:286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
com.newport.genesis.storefront.filters.RedirectFilter.doFilter(RedirectFilter.java:245)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.CartRestorationFilter.doFilterInternal(CartRestorationFilter.java:123)
org.springframework.
service(HttpServlet.java:620)
org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:846)
javax.servlet.http.HttpServlet.service(HttpServlet.java:727)
орг.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
sun.reflect.GeneratedMethodAccessor1424.invoke (неизвестный источник)
sun.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43)
java.lang.reflect.Method.invoke(Method.java:497)
net.bull.javamelody.JspWrapper.invoke(JspWrapper.java:150)
net.bull.javamelody.JdbcWrapper$DelegatingInvocationHandler.invoke(JdbcWrapper.java:286)
com.sun.proxy.$Proxy195.forward(Неизвестный источник)
com.newport.genesis.storefront.filters.RedirectFilter.doFilter(RedirectFilter.java:245)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
com.newport.genesis.storefront.filters.CartRestorationFilter.doFilterInternal(CartRestorationFilter.java:123)
org.springframework. web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.AnonymousAuthenticationFilter.doFilter(AnonymousAuthenticationFilter.java:111)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.rememberme.RememberMeAuthenticationFilter.doFilter(RememberMeAuthenticationFilter.java:150)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.servletapi.SecurityContextHolderAwareRequestFilter.doFilter(SecurityContextHolderAwareRequestFilter.java:169)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.savedrequest.RequestCacheAwareFilter.doFilter(RequestCacheAwareFilter.java:63)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.
web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.AnonymousAuthenticationFilter.doFilter(AnonymousAuthenticationFilter.java:111)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.rememberme.RememberMeAuthenticationFilter.doFilter(RememberMeAuthenticationFilter.java:150)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.servletapi.SecurityContextHolderAwareRequestFilter.doFilter(SecurityContextHolderAwareRequestFilter.java:169)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.savedrequest.RequestCacheAwareFilter.doFilter(RequestCacheAwareFilter.java:63)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy. java:331)
org.springframework.security.web.authentication.AbstractAuthenticationProcessingFilter.doFilter(AbstractAuthenticationProcessingFilter.java:200)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.logout.LogoutFilter.doFilter(LogoutFilter.java:121)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.header.HeaderWriterFilter.doFilterInternal (HeaderWriterFilter.java:66)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.context.request.async.WebAsyncManagerIntegrationFilter.doFilterInternal(WebAsyncManagerIntegrationFilter.java:56)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.
java:331)
org.springframework.security.web.authentication.AbstractAuthenticationProcessingFilter.doFilter(AbstractAuthenticationProcessingFilter.java:200)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.authentication.logout.LogoutFilter.doFilter(LogoutFilter.java:121)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.header.HeaderWriterFilter.doFilterInternal (HeaderWriterFilter.java:66)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.security.web.FilterChainProxy$VirtualFilterChain.doFilter(FilterChainProxy.java:331)
org.springframework.security.web.context.request.async.WebAsyncManagerIntegrationFilter.doFilterInternal(WebAsyncManagerIntegrationFilter.java:56)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.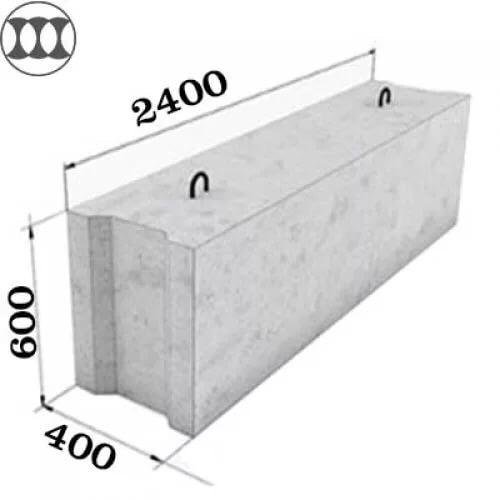 doFilter(AcceleratorAddOnFilter.java:92)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.SessionFilter.doFilter(SessionFilter.java:96)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.Log4JFilter.doFilter(Log4JFilter.java:44)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain.doFilterInternal(AbstractPlatformFilterChain.java:155)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346)
org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262)
org.
doFilter(AcceleratorAddOnFilter.java:92)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.SessionFilter.doFilter(SessionFilter.java:96)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.Log4JFilter.doFilter(Log4JFilter.java:44)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain$InternalFilterChain.doFilter(AbstractPlatformFilterChain.java:225)
de.hybris.platform.servicelayer.web.AbstractPlatformFilterChain.doFilterInternal(AbstractPlatformFilterChain.java:155)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346)
org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262)
org. apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:201)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:178)
org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:197)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92)
org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346)
org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262)
de.hybris.platform.servicelayer.web.XSSFilter.processPatternsAndDoFilter(XSSFilter.java:342)
de.hybris.platform.servicelayer.web.XSSFilter.doFilter(XSSFilter.java:290)
apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:52)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:201)
net.bull.javamelody.MonitoringFilter.doFilter(MonitoringFilter.java:178)
org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:197)
org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107)
com.newport.genesis.storefront.filters.AcceleratorAddOnFilter.doFilter(AcceleratorAddOnFilter.java:92)
org.springframework.web.filter.DelegatingFilterProxy.invokeDelegate(DelegatingFilterProxy.java:346)
org.springframework.web.filter.DelegatingFilterProxy.doFilter(DelegatingFilterProxy.java:262)
de.hybris.platform.servicelayer.web.XSSFilter.processPatternsAndDoFilter(XSSFilter.java:342)
de.hybris.platform.servicelayer.web.XSSFilter.doFilter(XSSFilter.java:290)