ФБС блоки: размеры и характеристики, ГОСТ 13579-78
Конструкция и назначение ФБС
Особенности ФБС
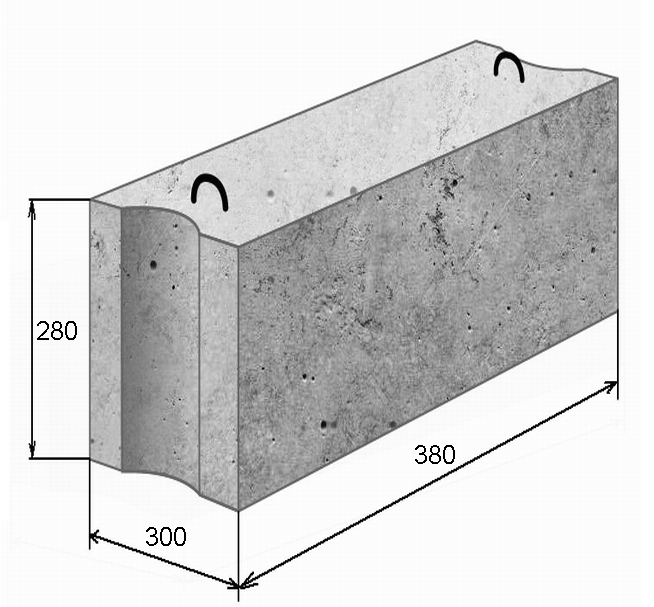
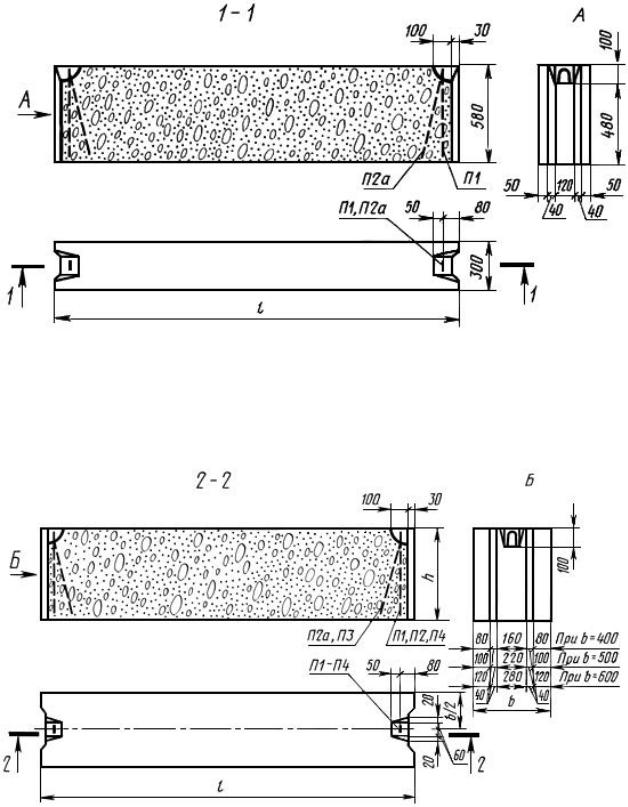
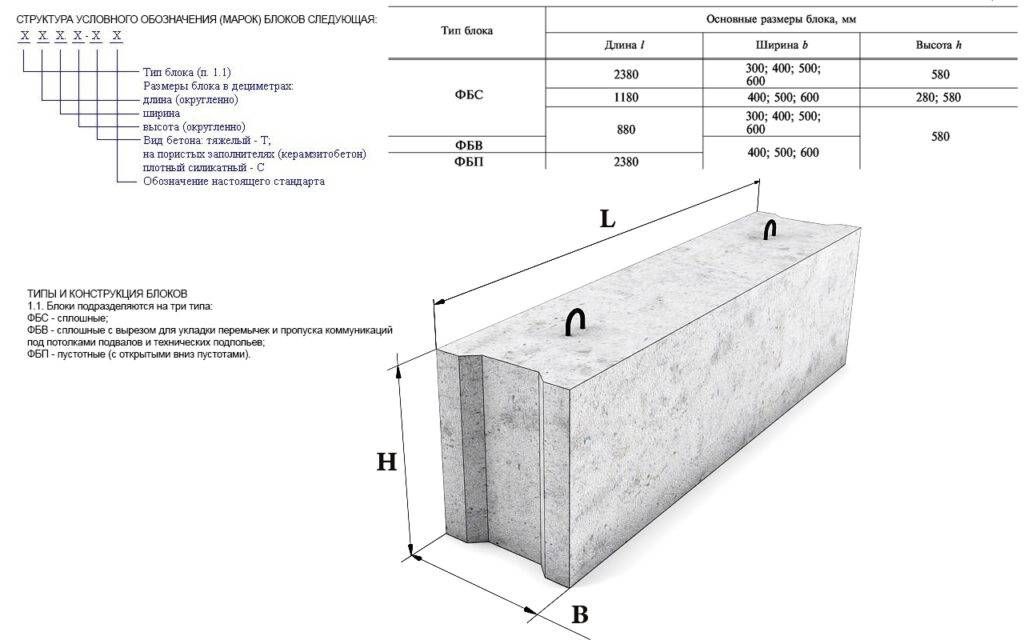
Стандартные размеры ФБС
Схема расчета числа ФБС
Железобетонные строительные конструкции относятся к наиболее распространенным материалам, с помощью которых возводятся как малоэтажные, так и высотные здания, а также промышленные сооружения. Одним из основных изделий является фундаментный блок сплошной или ФБС. ГОСТом также разрешается выпуск ФБВ — блоков с технологическими вырезами, и ФБП — блоков, имеющих прямоугольные полости.Блоки ФБС — это железобетонные параллелепипеды определенных размеров. Бетон, согласно действующим стандартам, должен быть монолитным, без дефектов и без трещин.
Конструкция и назначение ФБС
 Поэтому производство подобных изделий возможно только в заводских условиях и при наличии необходимого комплекта оборудования.
Поэтому производство подобных изделий возможно только в заводских условиях и при наличии необходимого комплекта оборудования.Основной материал для блоков:
- силикатный бетон;
- легкий бетон В100;
- тяжелые бетоны.
Этот строительный материал используется для следующих целей:
- устройство фундаментов ленточного типа;
- возведение стеновых конструкций в подвалах и цокольных этажах при любых типах грунтов;
- создание заградительных элементов;
- устройство технических пустот;
- эстакады, пандусы.
 К тому же работа с бетоном требует многодневного ожидания, пока будет набрана марочная прочность. Блоки не меняют свои прочностные характеристики и не требуют вынужденных остановок при строительстве.
К тому же работа с бетоном требует многодневного ожидания, пока будет набрана марочная прочность. Блоки не меняют свои прочностные характеристики и не требуют вынужденных остановок при строительстве.Прочность ФБС и соответствие стандартам гарантируется заводом-изготовителем. Если монтаж осуществляется с соблюдением технологии, то срок эксплуатации объекта превышает сто лет.
Особенности ФБС
Масса таких железобетонных изделий достигает полутора тонн, поэтому для перемещения и установки на место в конструкции приходится задействовать погрузочно-разгрузочную технику. Доставка такого строительного материала на объект требует соответствующего грузового транспорта.
Теплопроводность блоков ФБС достаточно высока, что требует организации дополнительной теплоизоляции.
Бетонная поверхность блоков ФБС может быть разных типов:
- лицевая, предназначенная для покраски;
- лицевая, предназначенная для отделки плиткой;
- лицевая, не предназначенная для отделки;
- нелицевая, не предназначена для видимых конструкций.
Стандартные размеры ФБС
 Всего существует 15 типоразмеров. Комбинируя элементы разной длины и ширины, можно минимизировать расход материалов для любой постройки.
Всего существует 15 типоразмеров. Комбинируя элементы разной длины и ширины, можно минимизировать расход материалов для любой постройки.Численные значения указываются в маркировке блока ФБС, поэтому при заказе материала сделать ошибку невозможно. Размеры округляются и приводятся в сантиметрах и разделяются точкой:
- первое число — длина;
- второе число — ширина;
- третье число — высота.
Такие обозначения удобны для заказа материалов, для организации складского хранения и для работы с блоками ФБС на стройплощадке.
Требования по отклонениям от проектных значений длин сторон очень жесткие — не превышают нескольких миллиметров.
В ГОСТ 13579-78 приводятся подробные описания типов и конфигурации ФБС, а также их параметров.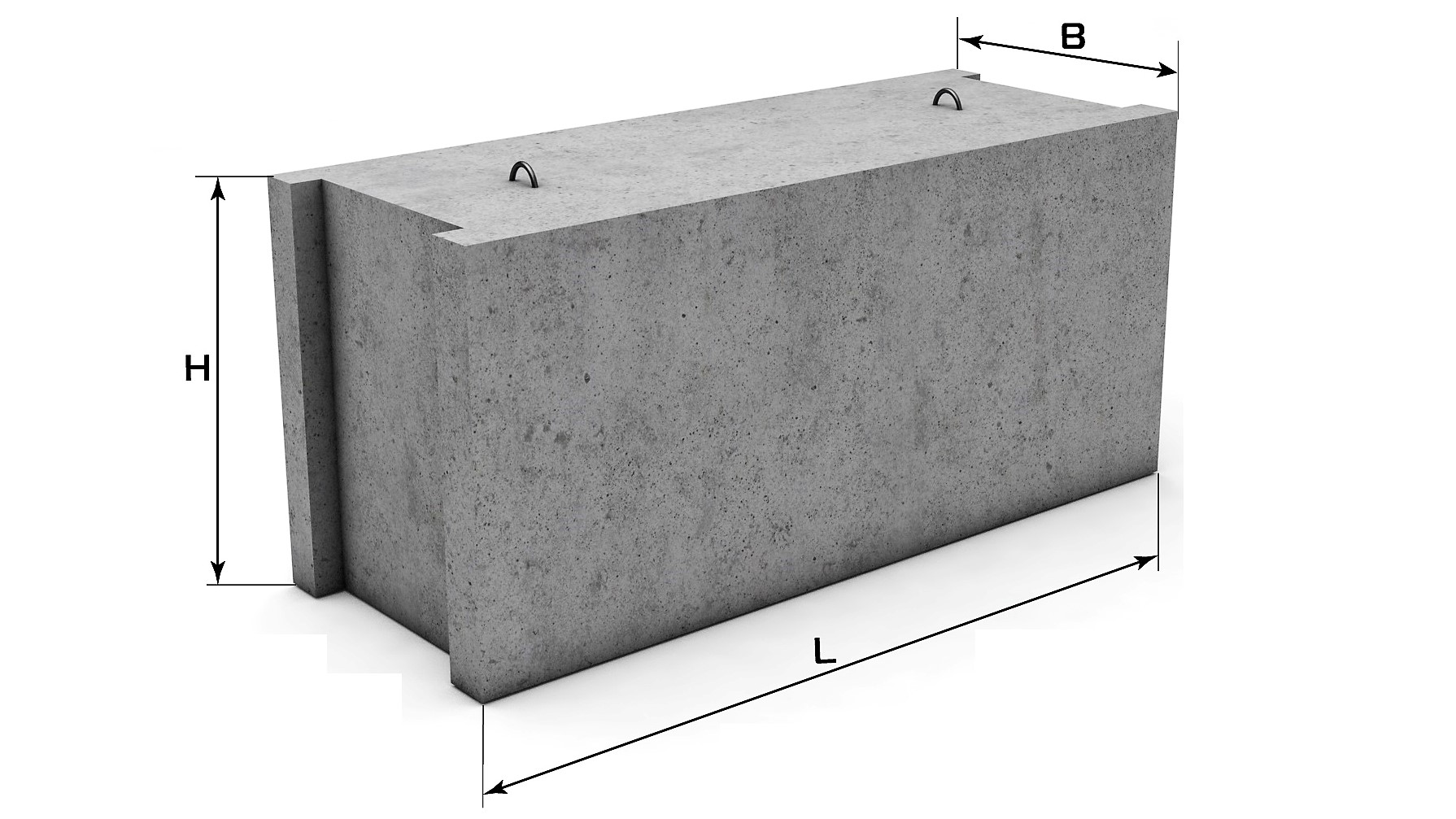 Для удобства данные сведены в таблицы. В этих таблицах приведена более подробная информация о блоках, чем указана в маркировке. В соответствующих столбцах указан класс бетона, масса блока, расход материала, параметра монтажной петли.
Для удобства данные сведены в таблицы. В этих таблицах приведена более подробная информация о блоках, чем указана в маркировке. В соответствующих столбцах указан класс бетона, масса блока, расход материала, параметра монтажной петли.
Данные о влаго- и морозоустойчивости блоков ФБС и другие характеристики приводятся в техническом паспорте товара, который прилагается к приобретенной покупателем партии блоков.
Схема расчета числа ФБС
 Также допускается свешивание с обеих сторон стены в соответствии с действующими правилами.
Также допускается свешивание с обеих сторон стены в соответствии с действующими правилами.Тип ФБС определяется характеристиками почвы в том месте, где возводится постройка. Например, для фундамента в глинистых почвах требуется использование наиболее объемных блоков.
Когда объем будущего фундамента определен, его делят на объем одного стандартного блока и получают искомое число.
Вычислив количество элементов, вычерчивают схему фундамента постройки и разрисовывают расположение блоков ФБС с учетом перевязок, которые должны быть между ними. Чертеж помогает наиболее точно определить, сколько нужно элементов выбранного размера для фундамента.
Дата публикации — 20.06.2022
Понравилась наша статья?
Статьи
19-05-2022
Марки цемента: расшифровка и применение
03-03-2022
Отличие цемента от бетона: различия в составе и сфере применения
03-12-2021
Керамзитобетон: свойства и характеристики
Наша продукция
Мы производим товарный бетон, мостовой бетон, строительный и кладочный раствор
Закажите бетон от производителя
Заполните форму, и мы свяжемся с вами
ФБС 24-6-6 т по стандарту: ГОСТ 13579-78
увеличить изображение
Стандарт изготовления изделия: ГОСТ 13579-78
Фундаментные блоки сплошные ФБС 24-6-6 т – это надежная основа. Прочность, стойкость и долговечность – это лишь часть свойств, которым должна отвечать основа дома. Фундаментные блоки ФБС 24-6-6 т – «суровый» строительный материал, который представляет собой железобетонный краеугольный камень. Широкое применение этих элементов для строительства фундаментных конструкций не оставляет сомнений, что это действительно подходящий для этого материал. Может быть произведено строительство как жилых, так и производственных зданий.
Прочность, стойкость и долговечность – это лишь часть свойств, которым должна отвечать основа дома. Фундаментные блоки ФБС 24-6-6 т – «суровый» строительный материал, который представляет собой железобетонный краеугольный камень. Широкое применение этих элементов для строительства фундаментных конструкций не оставляет сомнений, что это действительно подходящий для этого материал. Может быть произведено строительство как жилых, так и производственных зданий.
1.Варианты написания маркировки.
Обозначение фундаментных блоков ФБС 24-6-6 т осуществляется согласно ГОСТ 13579-78
1. ФБС 24-6-6 т т ;
2. ФБС 24-6-6 т п ;
3. ФБС 24-6-6 т ш ;
4. ФБС 24-6-6 т с ;
ФБС 24-6-6 т с ;
2.Основная сфера применения.
Блоки сплошного сечения ФБС 24-6-6 т используются для строительства сборных фундаментов для зданий различного назначения. Это могут быть как жилые дома, так и производственные строения. Блоки данного вида могут быть использованы и для дачного строительства, где заливка фундаментной конструкции не может быть произведена вручную. За счет особой формы этих железобетонных изделий строительство объекта сокращается по срокам вдвое.
Технология укладки блоков ФБС 24-6-6 т в качестве фундамента и стен подвального или технического подземного помещения полностью оправдывает себя на практике, как наиболее простая и быстровозводимая. Подвалы могут иметь различную глубину. Фундаментные блоки ФБС 24-6-6 т могут быть применены для возведения технических зданий и неотапливаемых помещений. Монтаж фундаментных элементов производится при помощи спецтехники, для подъема на высоту используют монтажные петли. В качестве захватов используют однорогие крюки с защелкой.
В качестве захватов используют однорогие крюки с защелкой.
3.Обозначение маркировки изделий
Фундаментные блоки сплошного сечения ФБС 24-6-6 т маркируют согласно ГОСТ 13579-78. В группе обозначений указывают тип изделия, размерный ряд. Габаритные размеры блока составляют
Рассмотрим обозначение ФБС 24-6-6 т, где маркированы следующие параметры:
1. ФБС – фундаментный блок сплошной;
2. 24 – длина, указывается в дц.;
3. 6 – ширина, указывается в дц.;
4. 6 – высота, указывается в дц.
Дополнительные данные для характеристики фундаментных блоков сплошного сечения:
1. Масса – 1960 ;
2. Геометрический объем изделия – 0,8282 ;
Геометрический объем изделия – 0,8282 ;
3. Объем бетона, расходуемый на один элемент – 0,82 ;
Маркировочные знаки, дата изготовления и вес изделий должны быть нанесены на торцевую грань несмываемой черной краской. Дополнительно может быть указан товарный знак компании-производителя.4.Основные материалы для изготовления и характеристики.
В качестве основного материала для изготовления блоков сплошного сечения ФБС 24-6-6 т используется пористый бетон. Это прочный и долговечный материал, который проявляет высокие свойства стойкости к действию различных сред. Пористая структура изделий обеспечивает их высокую теплопроводность. Малый вес позволяет не обустраивать внушительное основание для фундамента. Высокая несущая способность (могут быть построены стены в 1,5 кирпича) значительно расширяет сферу использования фундаментных блоков сплошного сечения. Так как «работа» производится под действием постоянных сдавливающих и сжимающих деформаций, блоки должны быть армированы. Плотность должна соответствовать величине – не менее чем 1800 кг/м3. Марка по прочности на сжатие должна соответствовать пределам М100, допускается применять марки М50 и М200. Бетон должен также отвечать требованиям по водонепроницаемости и морозостойкости (температурный диапазон достигает до -70 градусов), так как эксплуатация осуществляется в достаточно жестких условиях. Не допускается к закладке в фундамент элементов с трещинами, наплывами, сколами и торчащими элементами арматурной сетки. Армируется в редких случаях, используется стальная углеродистая проволока класса А1 и А111. Подобные дефекты снижают несущую способность готового элемента и приводят к его быстрой негодности (под действием пучения грунтов и в условиях постоянного действия грунтовых вод). На выходе
Так как «работа» производится под действием постоянных сдавливающих и сжимающих деформаций, блоки должны быть армированы. Плотность должна соответствовать величине – не менее чем 1800 кг/м3. Марка по прочности на сжатие должна соответствовать пределам М100, допускается применять марки М50 и М200. Бетон должен также отвечать требованиям по водонепроницаемости и морозостойкости (температурный диапазон достигает до -70 градусов), так как эксплуатация осуществляется в достаточно жестких условиях. Не допускается к закладке в фундамент элементов с трещинами, наплывами, сколами и торчащими элементами арматурной сетки. Армируется в редких случаях, используется стальная углеродистая проволока класса А1 и А111. Подобные дефекты снижают несущую способность готового элемента и приводят к его быстрой негодности (под действием пучения грунтов и в условиях постоянного действия грунтовых вод). На выходе

5.Хранение и транспортировка.
Хранение блоков сплошных ФБС 24-6-6 т производится в штабелях. Послойно укладывают деревянные подкладки. Под штабель обустраивается щебенчато-песчаная подушка. Предпочтительна сортировка по видам и сортам изделий. Транспортирование железобетонных блоков для фундаментов производится посредством спецтранспорта с надежным закреплением каждого изделия. Не допускается перегрузка транспорта, обязательно учитывается грузоподъемность машины.
Уважаемые покупатели! Сайт носит информационный характер. Указанные на сайте информация не являются публичной офертой (ст.435 ГК РФ). Стоимость и наличие товара просьба уточнять в офисе продаж или по телефону 8 (800) 500-22-52
Усадка пегилированных и непегилированных липосом в сыворотке
Коллоиды Surf B Biointerfaces. Авторская рукопись; доступно в PMC 2015 1 февраля. 2014 1 февраля; 114: 10.1016/j.colsurfb.2013.10.009.
Опубликовано в Интернете 24 октября 2013 г.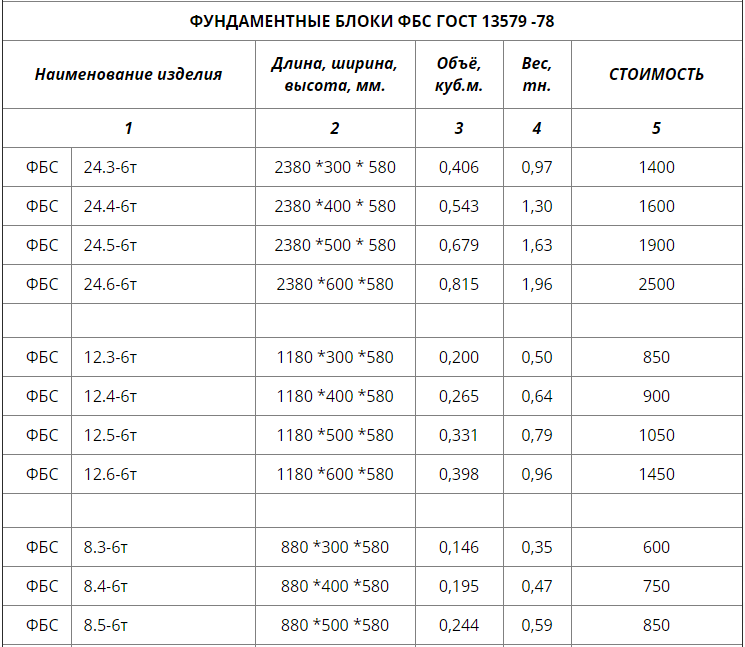 doi: 10.1016/j.colsurfb.2013.10.009
doi: 10.1016/j.colsurfb.2013.10.009PMCID: PMC3884810
NIHMSID: NIHMS534594
PMID: 24216620
, а, б, *, 1 , б, 1 , б , б, в , б, г , д , а , f , b, g и b, h, *
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
90 002 Существенным требованием для проектирования систем нанодоставки является возможность охарактеризовать размер, однородность и дзета-потенциал наночастиц. Такие свойства могут быть адаптированы для создания наиболее эффективных платформ доставки лекарств. Важный вопрос заключается в том, изменяются ли эти характеристики при системном введении. Здесь мы изучили поведение липосом фосфатидилхолина/холестерина, подвергшихся воздействию белков сыворотки. Результаты показывают индуцированное сывороткой уменьшение размера и гомогенности как пегилированных, так и непегилированных липосом, что указывает на возможную роль осмотических сил.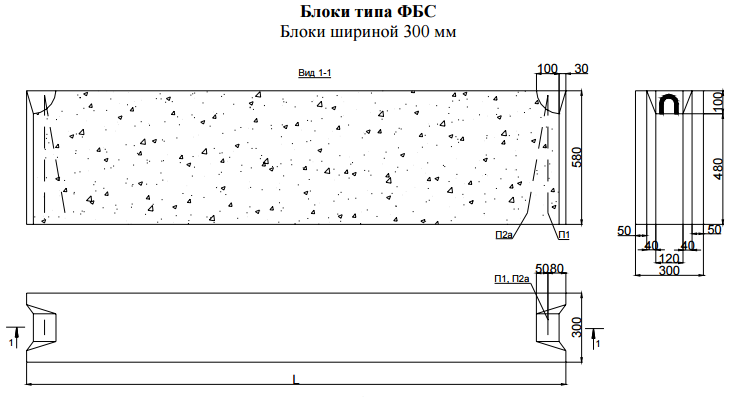 Кроме того, при воздействии на липосомы сыворотки наблюдались изменения дзета-потенциала. Липосомы с полиэтиленгликолем демонстрировали другие характеристики, чем их неполимерные аналоги, что предполагает потенциальное образование более плотной белковой короны вокруг непэгилированных липосом.
Кроме того, при воздействии на липосомы сыворотки наблюдались изменения дзета-потенциала. Липосомы с полиэтиленгликолем демонстрировали другие характеристики, чем их неполимерные аналоги, что предполагает потенциальное образование более плотной белковой короны вокруг непэгилированных липосом.Ключевые слова: Липосомы, Динамическое светорассеяние, Размер, Сыворотка, Индекс полидисперсности, Дзета-потенциал
Несколько систем нанодоставки уже получили клиническое одобрение, и многие другие в настоящее время проходят клинические испытания [1]. Липосомы составляют большую часть продуктов наномедицины на рынке. В настоящее время одобрено 13 липосомальных препаратов, и многие другие проходят клинические испытания [2,3]. Липосомы состоят из амфипатических фосфолипидов, образующих двухслойную структуру, позволяющую захватывать как гидрофильные, так и гидрофобные агенты [4]. Изменяя состав фосфолипидов, можно изменять характеристики липосом [5]. Кроме того, полимеры, такие как полиэтиленгликоль (ПЭГ), могут самостоятельно собираться в липидный бислой, образуя тем самым «невидимые липосомы» [6,7]. ПЭГ создает стерический барьер вокруг поверхности липосомы, который препятствует связыванию белков плазмы, тем самым защищая липосому от иммунологического распознавания и потери стабильности. Стелс-эффект приводит к увеличению времени циркуляции крови, что может улучшить терапевтическую эффективность [8].
ПЭГ создает стерический барьер вокруг поверхности липосомы, который препятствует связыванию белков плазмы, тем самым защищая липосому от иммунологического распознавания и потери стабильности. Стелс-эффект приводит к увеличению времени циркуляции крови, что может улучшить терапевтическую эффективность [8].
Свойства наночастиц, такие как размер и заряд, играют ключевую роль в преодолении биологических барьеров и достижении целевой области [9]. Следовательно, точное измерение и адаптация таких свойств на основе предполагаемого терапевтического эффекта может стать ключевым фактором успеха липосом. В настоящее время в научном сообществе продолжаются споры о том, как свойства наночастиц изменяются в жидкостях организма. Даже в присутствии ПЭГ возможно образование биомолекулярной короны вокруг наночастиц [10,11]. Эта корона воздействует и диктует поведение наночастиц в биологической среде [12–17]. Появляется идея, что наночастицы следует классифицировать на основе их взаимодействия с в среде in vivo, вместо того, чтобы характеризоваться по голым свойствам частиц [13–15].
В этой работе мы сосредоточились на выяснении того, как свойства пегилированных и непегилированных липосом фосфатидилхолина (ФХ)/холестерина изменяются в присутствии сыворотки. Здесь мы смоделировали физиологические условия, инкубируя липосомы в сыворотке плода крупного рогатого скота при температуре тела (FBS). Для характеристики частиц на основе липидов использовали динамическое светорассеяние, так как это наиболее удобный метод для определения размеров частиц в растворе [18]. Размер липосом, гомогенность и дзета-потенциал измеряли в зависимости от различных концентраций сыворотки. Изменения этих параметров также отслеживались с течением времени. Были проанализированы различные измерения, чтобы увидеть, можно ли наблюдать тенденции, зависящие от концентрации или времени.
2.1. Материалы
Холестерин был приобретен у Sigma Aldrich, а 1,2-дипальмитоил- sn -глицеро-3-фосфоэтаноламин (DPPE) и конъюгат 1,2-дистеароил-фосфатидилэтаноламин-метил-полиэтиленгликоль-2000 (DPPEmPEG2000) были получены у Полярные липиды Avanti (#850705P и #880160P). фосфатидилхолин (ФХ) был получен от Lipoid (#S100). Наносферы кремнезема были приобретены у Microspheres-Nanospheres (№141112-10).
фосфатидилхолин (ФХ) был получен от Lipoid (#S100). Наносферы кремнезема были приобретены у Microspheres-Nanospheres (№141112-10).
2.2. Липосомный препарат
Были приготовлены два различных состава липосом: (i) PC, холестерин, DPPEmPEG-2000 (молярное соотношение 6:3:1) и (ii) PC, холестерин, DPPE (молярное соотношение 6:3:1). Элементы композиции растворяли в круглодонной колбе с использованием смеси хлороформа и метанола (2:1, объем/объем). Липидные пленки были сформированы с помощью Rotovapor (R-215, Buchi Corporation) при 180 об/мин и 200 мбар с водяной баней при 50°C. Пленкам давали высохнуть в течение ночи и затем гидратировали фосфатно-солевым буфером (PBS; 1 мл/20 мг фосфолипидов). Гидратация проводилась путем трехкратного нагревания состава на водяной бане при 60°C (3 мин) с последующим перемешиванием в вортексе (3 мин). Для повышения гомогенности и сбора липосом разного размера препараты экструдировали через поликарбонатные мембраны со следующими размерами пор: (i) 400, 200 и 100 нм, (ii) 400, 200, 100 и 80 нм и (iii) 400 нм. , 200, 100 и 50 нм с использованием экструзионного устройства от Lipex Biomembranes (Northern Lipids Inc., Ванкувер, Британская Колумбия, Канада).
, 200, 100 и 50 нм с использованием экструзионного устройства от Lipex Biomembranes (Northern Lipids Inc., Ванкувер, Британская Колумбия, Канада).
2.3. Инкубация сыворотки
Изменения характеристик липосом оценивали в 100%, 60% и 20% FBS (разбавленных в PBS) при 37 °C. Гранулы кремнезема (25 мг/мл) инкубировали в 100% FBS. 200 мкл липосомальной композиции или шариков кремнезема добавляли к 1 мл раствора FBS. Исследования во времени продолжительностью до 12 дней проводили с 60% и 100% FBS при 37 °C с перемешиванием (700 об/мин). Стерильные условия поддерживались на протяжении всего эксперимента, чтобы избежать бактериального загрязнения, которое могло повлиять на показания образцов.
2.4. Динамическое светорассеяние
Для анализа динамического светорассеяния готовили образцы в разведении 1:50 и измеряли с помощью Zetasizer Nano ZS (ZEN 3600, Malvern Instruments). Измеряемыми переменными были размер ( Z avg , разбавленный водой Milli- Q или PBS), индекс полидисперсности (PDI, разбавленный водой Milli- Q или PBS) и дзета-потенциал ( ζ , разводят в фосфатном буфере). Для каждого образца было проведено пять измерений по 15 циклов на измерение. Размер представлен в пересчете на Z avg , который представляет собой средний гидродинамический диаметр по отношению к диапазону интенсивностей, измеренному с использованием динамического светорассеяния. Значение Z avg получено с использованием анализа кумулянтов, в котором размер частиц рассчитывается по уравнению Стокса-Эйнштейна: это Постоянная Больцмана, T – температура, η 0 — вязкость воды при данной температуре, а r ч — гидродинамические радиусы. Это уравнение связывает рассеяние света, наблюдаемое из-за броуновского движения, с размером частиц. После получения диапазона интенсивностей обратного рассеяния корреляционная кривая применяется к следующему выражению экспоненциальной аппроксимации для получения значений Z avg и PDI: 0005 А [1 + B exp(−2 Γ τ )
Для каждого образца было проведено пять измерений по 15 циклов на измерение. Размер представлен в пересчете на Z avg , который представляет собой средний гидродинамический диаметр по отношению к диапазону интенсивностей, измеренному с использованием динамического светорассеяния. Значение Z avg получено с использованием анализа кумулянтов, в котором размер частиц рассчитывается по уравнению Стокса-Эйнштейна: это Постоянная Больцмана, T – температура, η 0 — вязкость воды при данной температуре, а r ч — гидродинамические радиусы. Это уравнение связывает рассеяние света, наблюдаемое из-за броуновского движения, с размером частиц. После получения диапазона интенсивностей обратного рассеяния корреляционная кривая применяется к следующему выражению экспоненциальной аппроксимации для получения значений Z avg и PDI: 0005 А [1 + B exp(−2 Γ τ )
где τ – время задержки, A – амплитуда корреляционной функции, B 900 06 — базовая линия, а × скорость затухания.
Дзета-потенциал (ζ) определяли по значениям электрофоретической подвижности, полученным с помощью лазерной доплеровской велосиметрии (LDV). Прибор рассчитал значения дзета-потенциала по уравнению Генри:
UE=2εzf(ka)3η
, где U E — электрофоретическая подвижность, z — дзета-потенциал, η — вязкость, ε — диэлектрическая проницаемость и f(ka) — функция Генри. Поскольку измерения дзета-потенциала проводились в складчатой капиллярной ячейке в водной среде, применялось значение приближения Смолуховского f(ka) (1,5).
3.1. Пегилированные и непегилированные липосомы разных размеров
Экструзия через мембраны с порами 100 нм, 80 нм и 50 нм позволила получить липосомы трех различных категорий размеров (). Непегилированные липосомы были больше по размеру, чем их пегилированные аналоги. Все препараты показали низкие значения PDI (<0,06), что свидетельствует об однородном распределении по размерам. Дзета-потенциал непегилированных липосом составлял около -5 мВ, в то время как пегилированные липосомы имели немного более низкий дзета-потенциал, приблизительно -10 мВ. При хранении при 4 °C липосомы оставались стабильными, о чем свидетельствовали относительно одинаковые размеры, значения PDI и дзета-потенциала (). Динамическое светорассеяние показало, что PDI и размер липосом были одинаковыми при разбавлении Milli-9.0005 Q вода или PBS ().
Дзета-потенциал непегилированных липосом составлял около -5 мВ, в то время как пегилированные липосомы имели немного более низкий дзета-потенциал, приблизительно -10 мВ. При хранении при 4 °C липосомы оставались стабильными, о чем свидетельствовали относительно одинаковые размеры, значения PDI и дзета-потенциала (). Динамическое светорассеяние показало, что PDI и размер липосом были одинаковыми при разбавлении Milli-9.0005 Q вода или PBS ().
Открыть в отдельном окне
Стабильность липосом при хранении при 4 °C. Непегилированные (non-peg) и пегилированные (peg) липосомы экструдировали через фильтры с порами 100 нм, 80 нм и 50 нм. (а) Размер, (б) индекс полидисперсности (PDI) и (в) дзета-потенциал (ζ). Данные представлены как среднее ± стандартное отклонение пяти измерений.
Открыть в отдельном окне
Сравнение воды и фосфатно-солевого буфера (PBS) в качестве разбавителей для динамического светорассеяния. Непегилированные (non-peg) и пегилированные (peg) липосомы экструдировали через фильтры с порами 100 нм, 80 нм и 50 нм. (а, б) размер, (в, г) индекс полидисперсности (PDI). Для линейных графиков данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Для столбчатых диаграмм данные представлены как среднее ± стандартное отклонение липосом разного размера.
(а, б) размер, (в, г) индекс полидисперсности (PDI). Для линейных графиков данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Для столбчатых диаграмм данные представлены как среднее ± стандартное отклонение липосом разного размера.
Таблица 1
Характеристика непегилированных (не-привязка) и пегилированных (привязка) липосом. Экструзия через фильтры с порами 100 нм, 80 нм и 50 нм. Данные представлены как среднее значение ± стандартное отклонение для липосом, приготовленных в течение трех отдельных дней.
| Образец | Размер (нм) | Индекс полидисперсности | Дзета-потенциал (мВ) |
|---|---|---|---|
| 112,7 ± 1,5 | 0,056 ± 0,008 | −4,9± 1,3 | |
| Без штифта 80 | 100,7 ± 0,7 | 0,058 ± 0,008 | −5,1 ± 0,2 | Без штифта 50 | 76,3 ± 1 | 0,054 ± 0,003 | −5,8 ± 1,4 |
| Штифт 100 | 106,5 ± 1,3 | 0,041 ± 0,006 | −10,9 ± 1,2 |
| 95,7 ± 2,4 | 0,035 ± 0,002 | −10,8 ± 2 | |
| Штифт 50 | 72,8 ± 1,4 | 0,034 ± 0,002 | −9,3 ± 0,8 |
Открыть в отдельном окне
3.
 2. Индуцированные сывороткой изменения размера липосом
2. Индуцированные сывороткой изменения размера липосомПри контакте с сывороткой непегилированные и пегилированные липосомы уменьшались в размерах. Пегилированные липосомы продемонстрировали более резкое уменьшение размера (16 нм в 100% FBS) по сравнению с их непегилированными аналогами (11 нм в 100% FBS) (). Все составы показали один пик интенсивности, который необходим для точной интерпретации Z среднее . Интересно, что уменьшение размера не зависело от размера липосом, так как все составы одного и того же состава демонстрировали почти одинаковое уменьшение диаметра при воздействии сыворотки. Однако уменьшение размера зависело от концентрации в сыворотке (100%, 60% или 20%), где липосомы, подвергшиеся воздействию 100% FBS, демонстрировали наибольшее изменение размера (1).
Открыть в отдельном окне
Сравнение размеров липосом в фосфатно-солевом буфере (PBS) и эмбриональной бычьей сыворотке (FBS). Непегилированные (non-peg) и пегилированные (peg) липосомы экструдировали через фильтры с порами 100 нм, 80 нм и 50 нм. (a) 20% FBS, (b) 60% FBS, (c) 100% FBS, (d) обобщающий график. Для линейных графиков данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Для столбчатых диаграмм данные представлены как среднее ± стандартное отклонение липосом разного размера.
(a) 20% FBS, (b) 60% FBS, (c) 100% FBS, (d) обобщающий график. Для линейных графиков данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Для столбчатых диаграмм данные представлены как среднее ± стандартное отклонение липосом разного размера.
Существует несколько способов взаимодействия белков сыворотки с липосомами. Один из способов – формирование короны, что влечет за собой связывание биомолекул с поверхностью наночастиц [12,13,15,16]. Этот эффект, вероятно, вызывает увеличение размера липосом. Другим способом воздействия сыворотки на липосомы является осмотическое давление, вызванное белками, непроницаемыми для липосомальной мембраны, что приводит к выходу воды из ядра липосомы и последующему сжатию везикулы. Возможно, что последний эффект отвечает за индуцированное сывороткой уменьшение размера липосом. Ранее было показано, что липосомы, подвергшиеся воздействию раствора ионов, уменьшаются в размерах из-за осмотического давления [19].–21], поддерживая представление о том, что осмотическое давление действует на липосомы. Менее резкое уменьшение размера, наблюдаемое с непегилированными липосомами, по сравнению с пегилированными, может быть связано с более обширной белковой короной, формирующейся вокруг неполимерных липосом, что приводит к утолщению липосомальной поверхности и последующему увеличению. в диаметре. Пегилированные поверхности, напротив, могут проявлять силы отталкивания по отношению к белкам сыворотки [22–24], препятствуя тем самым формированию плотной белковой короны.
Менее резкое уменьшение размера, наблюдаемое с непегилированными липосомами, по сравнению с пегилированными, может быть связано с более обширной белковой короной, формирующейся вокруг неполимерных липосом, что приводит к утолщению липосомальной поверхности и последующему увеличению. в диаметре. Пегилированные поверхности, напротив, могут проявлять силы отталкивания по отношению к белкам сыворотки [22–24], препятствуя тем самым формированию плотной белковой короны.
Из-за методологических ограничений образцы не могут быть измерены непосредственно в FBS, так как только сыворотка показывает множественные пики интенсивности. Поэтому перед считыванием образцов методом динамического светорассеяния их разводили в воде Milli- Q (1:50). Следовательно, фактическая концентрация FBS при измерении образцов была значительно меньше (~ 2%, ~ 1% и 0,4%), что позволяет предположить, что реальное изменение размера, вызванное сывороткой, может быть другим и даже более драматичным, чем показано здесь. Также возможно, что присутствие компонентов сыворотки может влиять на картину светорассеяния. Поэтому для дальнейшего изучения влияния сывороточных белков был проведен дополнительный контрольный эксперимент с использованием наносфер кремнезема, которые не склонны к изменению размера из-за осмотического стресса. Результаты показывают, что гранулы кремнезема, в отличие от липосом, увеличиваются в размерах при воздействии 100% FBS (100%). Этот результат свидетельствует о том, что наблюдаемое сжатие липосом не является следствием влияния белков сыворотки на картину светорассеяния.
Также возможно, что присутствие компонентов сыворотки может влиять на картину светорассеяния. Поэтому для дальнейшего изучения влияния сывороточных белков был проведен дополнительный контрольный эксперимент с использованием наносфер кремнезема, которые не склонны к изменению размера из-за осмотического стресса. Результаты показывают, что гранулы кремнезема, в отличие от липосом, увеличиваются в размерах при воздействии 100% FBS (100%). Этот результат свидетельствует о том, что наблюдаемое сжатие липосом не является следствием влияния белков сыворотки на картину светорассеяния.
Открыть в отдельном окне
Сравнение наносфер кремнезема в фосфатно-солевом буфере (PBS) и 100% эмбриональной телячьей сыворотке (FBS). (а) Размер, (б) индекс полидисперсности (PDI). Данные представлены как среднее значение ± стандартное отклонение для 5 измерений.
3.3. Индуцированные сывороткой изменения гомогенности и дзета-потенциала
PDI непегилированных и пегилированных липосом увеличилось в сыворотке, что свидетельствует о снижении гомогенности. По мере того, как концентрация в сыворотке повышалась, PDI становился больше (). Индуцированное сывороткой изменение не зависело от размера липосом. Пегилированные липосомы демонстрировали большее изменение PDI по сравнению с непегилированными липосомами (12). Дзета-потенциал непегилированных липосом снижался в сыворотке, в то время как он оставался относительно постоянным для пегилированных липосом (1), что, возможно, связано с образованием белковой короны вокруг неполимерных липосом.
По мере того, как концентрация в сыворотке повышалась, PDI становился больше (). Индуцированное сывороткой изменение не зависело от размера липосом. Пегилированные липосомы демонстрировали большее изменение PDI по сравнению с непегилированными липосомами (12). Дзета-потенциал непегилированных липосом снижался в сыворотке, в то время как он оставался относительно постоянным для пегилированных липосом (1), что, возможно, связано с образованием белковой короны вокруг неполимерных липосом.
Открыть в отдельном окне
Сравнение индекса полидисперсности (PDI) липосом в фосфатно-солевом буфере (PBS) и эмбриональной бычьей сыворотке (FBS). Непегилированные (non-peg) и пегилированные (peg) липосомы экструдировали через фильтры с порами 100 нм, 80 нм и 50 нм. (a) 20% FBS, (b) 60% FBS, (c) 100% FBS, (d) обобщающий график. Для линейных графиков данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Для столбчатых диаграмм данные представлены как среднее ± стандартное отклонение липосом разного размера.
Открыть в отдельном окне
Сравнение дзета-потенциала (ζ) липосом в фосфатно-солевом буфере (PBS) и эмбриональной бычьей сыворотке (FBS). Непегилированные (non-peg) и пегилированные (peg) липосомы экструдировали через фильтры с порами 100 нм, 80 нм и 50 нм. (a) 20% FBS, (b) 60% FBS, (c) 100% FBS, (d) обобщающий график. Для линейных графиков данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Для столбчатых диаграмм данные представлены как среднее ± стандартное отклонение липосом разного размера.
3.4. Исследования динамики сыворотки
Липосомы инкубировали в 100% и 60% сыворотке в течение 12 дней. В течение первых нескольких часов липосомы продемонстрировали уменьшение размера и увеличение PDI, после чего эти значения стабилизировались (). Через 12 дней PDI для пегилированных и непегилированных липосом увеличилось. Точно так же дзета-потенциал для непегилированных липосом резко снизился на 12-й день, в то время как для пегилированных липосом он оставался относительно стабильным. Эти изменения были более значительными, когда липосомы инкубировали в 100% FBS (100%) по сравнению с 60% FBS (49). Обе липосомальные композиции не подвергались агрегации или расщеплению в сыворотке крови, о чем свидетельствуют последовательные Z avg значений и наличие одного пика интенсивности в измерениях динамического светорассеяния. Ранее было показано, что холестерин повышает стабильность липосом [25], что может объяснить, почему непегилированные липосомы оставались интактными в FBS.
Эти изменения были более значительными, когда липосомы инкубировали в 100% FBS (100%) по сравнению с 60% FBS (49). Обе липосомальные композиции не подвергались агрегации или расщеплению в сыворотке крови, о чем свидетельствуют последовательные Z avg значений и наличие одного пика интенсивности в измерениях динамического светорассеяния. Ранее было показано, что холестерин повышает стабильность липосом [25], что может объяснить, почему непегилированные липосомы оставались интактными в FBS.
Открыть в отдельном окне
Динамика липосом, инкубированных в эмбриональной телячьей сыворотке (FBS). Непегилированные (non-peg) и пегилированные (peg) липосомы экструдировали через фильтры с порами 100 нм, 80 нм и 50 нм. (а) 100% ФБС, (б) 60% ФБС. Измеряли размер (верхняя панель), индекс полидисперсности (PDI, средняя панель) и дзета-потенциал (ζ, нижняя панель). Данные представлены как среднее значение ± стандартное отклонение для 5 измерений. Невидимые полосы ошибок расположены внутри символов.
Представление о том, что некоторые липосомы уменьшаются в размерах в присутствии сыворотки, может иметь значение для разработки терапевтических систем нанодоставки. Основной проблемой для успешной доставки лекарств in vivo является преодоление множества биологических барьеров [9]. Многие из этих биологических барьеров имеют ограничение по размеру. А именно, успешное проникновение наночастиц через сосудистую сеть и предотвращение клиренса органами, такими как печень и почки, сильно зависят от размера. Например, ранее было показано, что наночастицы размером более 50 нм не способны проникать в сосудистую сеть опухолей поджелудочной железы [26]. Кроме того, частицы в диапазоне 100 нм имеют более высокую вероятность накопления в печени, в то время как почки выводят частицы размером менее 5,5 нм [26,27]. Поскольку размер играет важную роль в успехе наноносителей, важно знать точные размеры наночастиц после системного введения.
Кроме того, сокращение липосом в ответ на осмотические силы может иметь последствия для высвобождения лекарственного средства. Лекарства, загруженные в водное ядро, потенциально могут высвобождаться, когда вода вытекает из пузырька. Неизменно уменьшение размера липосом также вызывает сжатие липидного двойного слоя. Следовательно, гидрофобные лекарственные вещества, встроенные в бислой, также могут высвобождаться в ответ на сжатие. Следовательно, возможно, что липосомы могут демонстрировать резкое высвобождение лекарства в течение нескольких секунд после воздействия белков в жидкостях организма. Кроме того, одновременно вокруг поверхности липосомы может образоваться белковая корона, увеличивающая размер наночастиц. В этих опытах уменьшение размеров липосом, предположительно вызванное осмотическим давлением, было больше, чем вероятное увеличение размеров, возникающее в результате образования белковой короны. Действительно, непегилированные липосомы демонстрировали меньшее уменьшение размера, что потенциально свидетельствует о наличии более толстой биомолекулярной короны. По сути, это исследование служит для иллюстрации того, что липосомы могут резко измениться в размере в течение нескольких секунд после взаимодействия с белками сыворотки, сохраняя при этом стабильность и однородность подтверждения.
Лекарства, загруженные в водное ядро, потенциально могут высвобождаться, когда вода вытекает из пузырька. Неизменно уменьшение размера липосом также вызывает сжатие липидного двойного слоя. Следовательно, гидрофобные лекарственные вещества, встроенные в бислой, также могут высвобождаться в ответ на сжатие. Следовательно, возможно, что липосомы могут демонстрировать резкое высвобождение лекарства в течение нескольких секунд после воздействия белков в жидкостях организма. Кроме того, одновременно вокруг поверхности липосомы может образоваться белковая корона, увеличивающая размер наночастиц. В этих опытах уменьшение размеров липосом, предположительно вызванное осмотическим давлением, было больше, чем вероятное увеличение размеров, возникающее в результате образования белковой короны. Действительно, непегилированные липосомы демонстрировали меньшее уменьшение размера, что потенциально свидетельствует о наличии более толстой биомолекулярной короны. По сути, это исследование служит для иллюстрации того, что липосомы могут резко измениться в размере в течение нескольких секунд после взаимодействия с белками сыворотки, сохраняя при этом стабильность и однородность подтверждения. Следовательно, следует учитывать липосомальные характеристики в присутствии белков сыворотки при разработке средств доставки для систематического введения.
Следовательно, следует учитывать липосомальные характеристики в присутствии белков сыворотки при разработке средств доставки для систематического введения.
Мы показали, что характеристики липосом могут изменяться при воздействии FBS. Пегилированные и непегилированные составы продемонстрировали индуцированное сывороткой независимое от размера и зависящее от концентрации уменьшение размера и гомогенности. Дзета-потенциал непегилированных липосом снижался в присутствии сыворотки, в то время как дзета-потенциал пегилированных липосом оставался относительно постоянным. За исключением начального увеличения размера, все составы были стабильны в сыворотке до 12 дней, что свидетельствует о том, что как ПЭГ, так и холестерин могут действовать как стабилизирующие агенты. Изменения, вызванные FBS, вероятно, обусловлены осмотическим давлением и образованием белковой короны вокруг липосом.
Исследование проводилось при финансовой поддержке Научно-исследовательского института методистской больницы. Частичные средства были получены от: почетного председателя Эрнеста Кокрелла-младшего (MF), Министерства обороны США (W81XWH-09-1-0212) (MF), Национального института здравоохранения (U54CA143837, U54CA151668) (MF), Nylands Nation Finland (JW), грант Министерства обороны W81XWH-12-1-0414 (MF) и грант CPRIT штата Техас RP121071 (MF и HS). Мы благодарим Мэтью Лэндри за помощь с цифрами.
Частичные средства были получены от: почетного председателя Эрнеста Кокрелла-младшего (MF), Министерства обороны США (W81XWH-09-1-0212) (MF), Национального института здравоохранения (U54CA143837, U54CA151668) (MF), Nylands Nation Finland (JW), грант Министерства обороны W81XWH-12-1-0414 (MF) и грант CPRIT штата Техас RP121071 (MF и HS). Мы благодарим Мэтью Лэндри за помощь с цифрами.
1. Вагнер В., Дуллаарт А., Бок А.К., Цвек А. Новый ландшафт наномедицины. Нац биотехнолог. 2006; 24:1211–1217. [PubMed] [Google Scholar]
2. Chang HI, Yeh MK. Клиническая разработка препаратов на основе липосом: рецептура, характеристика и терапевтическая эффективность. Int J Nanomed. 2012;7:49–60. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Koudelka S, Turánek J. Составы липосомального паклитаксела. J Контролируемое высвобождение. 2012; 163:322–334. [PubMed] [Академия Google]
4. Чжан Л., Гу Ф.Х., Чан Дж.М., Ван А.З., Лангер Р.С., Фарохзад О.К. Наночастицы в медицине: терапевтические применения и разработки.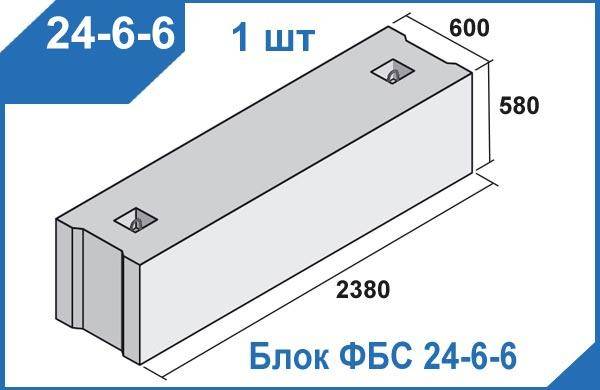 Клин Фармакол Тер. 2008; 83: 761–769. [PubMed] [Google Scholar]
Клин Фармакол Тер. 2008; 83: 761–769. [PubMed] [Google Scholar]
5. Allen TM, Cullis PR. Липосомальные системы доставки лекарств: от идеи до клинического применения. Adv Drug Deliv Rev. 2013; 65:36–48. [PubMed] [Google Scholar]
6. Pasut G, Veronese FM. Современное состояние пегилирования: большая универсальность, достигнутая после сорока лет исследований. J Управление выпуском. 2012; 161:461–472. [PubMed] [Академия Google]
7. Иммордино М.Л., Досио Ф., Кэттел Л. Липосомы-невидимки: обзор фундаментальной науки, обоснование и клиническое применение, существующее и потенциальное. Int J Nanomed. 2006; 1: 297–315. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Сен К., Мандал М. Липосомальная терапия рака второго поколения: переход от лаборатории к клинике. Инт Дж Фарм. 2013; 448:28–43. [PubMed] [Google Scholar]
9. Феррари М. Раковые нанотехнологии: возможности и проблемы. Нат Рев Рак. 2005; 5: 161–171. [PubMed] [Академия Google]
10. Хамад И. , Аль-Ханбали О., Хантер А.С., Рутт К.Дж., Андресен Т.Л., Могими С.М. Особая структура полимера обеспечивает переключение путей активации комплемента на границе раздела наносфера-сыворотка: значение для инженерии невидимых наночастиц. АКС Нано. 2010;4:6629–6638. [PubMed] [Google Scholar]
, Аль-Ханбали О., Хантер А.С., Рутт К.Дж., Андресен Т.Л., Могими С.М. Особая структура полимера обеспечивает переключение путей активации комплемента на границе раздела наносфера-сыворотка: значение для инженерии невидимых наночастиц. АКС Нано. 2010;4:6629–6638. [PubMed] [Google Scholar]
11. Kim HR, Andrieux K, Delomenie C, Chacun H, Appel M, Desmaële D, et al. Анализ адсорбции белков плазмы на пегилированных наночастицах дополнительными методами: 2-DE, CE и система Protein Lab-on-chip. Электрофорез. 2007; 28: 2252–2261. [PubMed] [Академия Google]
12. Гаспар Р. Наночастицы отталкиваются от мишени с помощью белков. Нац Нанотехнолог. 2013; 8: 79–80. [PubMed] [Google Scholar]
13. Лундквист М., Стиглер Дж., Элиа Г., Линч И., Седервалл Т., Доусон К.А. Размер наночастиц и свойства поверхности определяют белковую корону с возможными последствиями для биологических воздействий. Proc Nat Acad Sci USA. 2008;105:14265–14270. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Mahon E, Salvati A, Baldelli Bombelli F, Lynch I, Dawson KA. Разработка интерфейса наночастицы-биомолекулы для нацеливания и терапевтической доставки. J Управление выпуском. 2012; 161:164–174. [PubMed] [Академия Google]
Mahon E, Salvati A, Baldelli Bombelli F, Lynch I, Dawson KA. Разработка интерфейса наночастицы-биомолекулы для нацеливания и терапевтической доставки. J Управление выпуском. 2012; 161:164–174. [PubMed] [Академия Google]
15. Монополи М.П., Аберг С., Сальвати А., Доусон К.А. Биомолекулярные короны обеспечивают биологическую идентичность наноразмерных материалов. Нац Нанотехнолог. 2012;7:779–786. [PubMed] [Google Scholar]
16. Monopoli MP, Walczyk D, Campbell A, Elia G, Lynch I, Bombelli FB, et al. Физико-химические аспекты белковой короны: отношение к биологическим воздействиям наночастиц in vitro и in vivo. J Am Chem Soc. 2011;133:2525–2534. [PubMed] [Google Scholar]
17. Salvati A, Pitek AS, Monopoli MP, Prapainop K, Bombelli FB, Hristov DR, et al. Наночастицы, функционализированные трансферрином, теряют свои способности к нацеливанию, когда корона биомолекулы адсорбируется на поверхности. Нац Нанотехнолог. 2013; 8: 137–143. [PubMed] [Академия Google]
18. Мерфи Р.М. Статическое и динамическое светорассеяние биологических макромолекул: чему мы можем научиться? Курр Опин Биотехнолог. 1997; 8: 25–30. [PubMed] [Google Scholar]
Мерфи Р.М. Статическое и динамическое светорассеяние биологических макромолекул: чему мы можем научиться? Курр Опин Биотехнолог. 1997; 8: 25–30. [PubMed] [Google Scholar]
19. Pencer J, White GF, Hallett FR. Осмотически индуцированные изменения формы больших однослойных везикул, измеренные с помощью динамического светорассеяния. Биофиз Дж. 2001; 81: 2716–2728. [Статья бесплатно PMC] [PubMed] [Google Scholar]
20. Hupfeld S, Moen HH, Ausbacher D, Haas H, Brandl M. Анализ фракционирования и размера липосом с помощью асимметричного фракционирования поля потока/рассеяния света под разными углами: влияние ионной силы и осмотического давления жидкости-носителя. Хим. физ. липиды. 2010; 163:141–147. [PubMed] [Академия Google]
21. Sabın J, Prieto G, Ruso JM, Hidalgo-Alvarez R, Sarmiento F. Размер и стабильность липосом: возможная роль гидратации и осмотических сил. Eur Phys JE Soft Matter. 2006; 20:401–408. [PubMed] [Google Scholar]
22. Ансворт Л.Д., Ширдаун Х.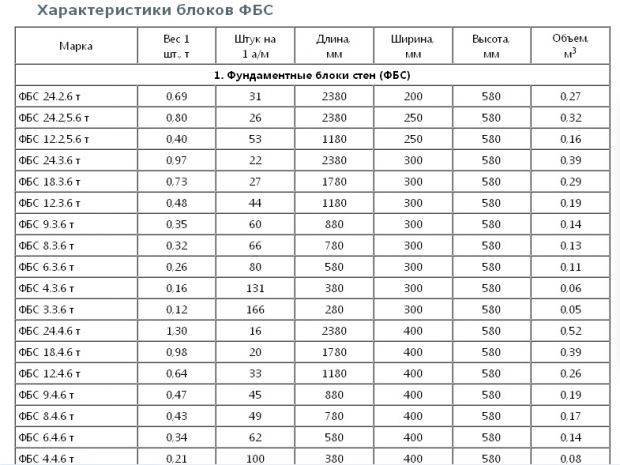 , Браш Дж.Л. Белковая устойчивость поверхностей, полученных сорбцией концевого тиолированного полиэтиленгликоля к золоту: влияние поверхностной плотности цепи. Ленгмюр. 2005; 21:1036–1041. [PubMed] [Google Scholar]
, Браш Дж.Л. Белковая устойчивость поверхностей, полученных сорбцией концевого тиолированного полиэтиленгликоля к золоту: влияние поверхностной плотности цепи. Ленгмюр. 2005; 21:1036–1041. [PubMed] [Google Scholar]
23. Wei J, Ravn DB, Gram L, Kingshott P. Нержавеющая сталь, модифицированная полиэтиленгликолем, может предотвратить адсорбцию белка, но не бактериальную адгезию. Коллоиды Surf B: Биоинтерфейсы. 2003; 32: 275–29.1. [Google Scholar]
24. Чжан Ф., Канг Э.Т., Неох К.Г., Ван П., Тан К.Л. Модификация поверхности нержавеющей стали путем прививки полиэтиленгликоля для уменьшения адсорбции белка. Биоматериалы. 2001; 22:1541–1548. [PubMed] [Google Scholar]
25. Tierney KJ, Block DE, Longo ML. Эластичность и фазовое поведение мембраны DPPC, модулированные холестерином, эргостеролом и этанолом. Биофиз Дж. 2005; 89: 2481–2493. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Cabral H, Matsumoto Y, Mizuno K, Chen Q, Murakami M, Kimura M, et al. Накопление полимерных мицелл размером менее 100 нм в плохо проницаемых опухолях зависит от их размера. Нац Нанотехнолог. 2011; 6: 815–823. [PubMed] [Академия Google]
Нац Нанотехнолог. 2011; 6: 815–823. [PubMed] [Академия Google]
27. Soo Choi H, Liu W, Misra P, Tanaka E, Zimmer JP, Itty Ipe B, et al. Почечный клиренс квантовых точек. Нац биотехнолог. 2007; 25:1165–1170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Руководство по выбору контрольных и блокирующих реагентов.
Экспериментальные протоколы с использованием иммунотехнологий часто можно улучшить за счет оптимального использования блокирующих реагентов, разбавителей и контролей. Прочтите дополнительную информацию о том, как выбрать подходящие разбавители и этапы блокировки для предотвращения нежелательного фона, а также о том, как экспериментальные элементы управления могут помочь определить источник нецелевого сигнала.
Оптимизируйте свои экспериментальные протоколы с помощью контрольных, разбавляющих и блокирующих реагентов.
При разработке иммунотехнологии важно учитывать анализ результатов. Добавление правильных блокирующих реагентов и экспериментальных контролей может улучшить качество анализа и его интерпретацию.
Используйте это руководство, чтобы узнать больше о выборе соответствующих контрольных, разбавляющих и блокирующих реагентов в ряде иммунометодов для:
- Уменьшить фон
- Устранение неполадок с нецелевыми сигналами
- Облегчить анализ.
Проточная цитометрия
| Проблемы | Решение | Указанный продукт |
|---|---|---|
| Фон антител, связывающих Fc-рецепторы | Блокирует Fc-рецепторы. | Нормальная сыворотка хозяина меченого антитела |
| Использовать F(abʹ) 2 форматируют вторичное антитело, чтобы избежать захвата Fc-рецепторами. | F(abʹ) 2 вторичные антитела | |
| Подтверждение того, что первичное связывание антител обусловлено антигенной специфичностью | Используйте изотипический отрицательный контроль (неспецифический IgG того же вида, что и первичное антитело), чтобы продемонстрировать специфическое связывание первичного антитела.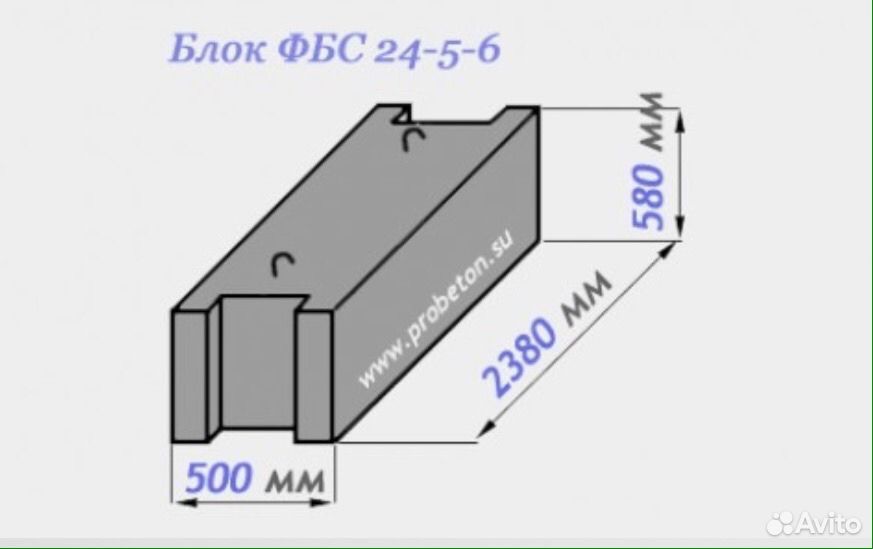 | Очищенные белки ChromPure™ |
| Подтверждение того, что вторичное антитело не влияет на нецелевой сигнал | Используйте изотипический отрицательный контроль (конъюгированный неспецифический IgG того же вида, что и вторичное антитело), чтобы продемонстрировать специфическое связывание вторичного антитела. | Очищенные белки ChromPure™ |
| Недостаток времени и отсутствие прямого конъюгированного первичного | Fab пометьте ваши первичные антитела перед инкубацией с образцом. | ФабуЛайт™ |
Вестерн-блоттинг
| Проблемы | Решение | Указанный продукт |
|---|---|---|
| Фон (неспецифический сигнал, перекрывающий интересующие полосы) | Используйте соответствующий блокирующий реагент для блокирования мембраны перед инкубацией с первичным антителом. | Нормальная сыворотка (5% об. /об.) вида-хозяина меченого антитела или БСА (5% об./об.) (без IgG и без протеазы) /об.) вида-хозяина меченого антитела или БСА (5% об./об.) (без IgG и без протеазы) |
| Избегайте использования молока или БСА, если используются первичные антитела, полученные от коз, лошадей или овец. Бычий IgG может взаимодействовать с антителом за счет гомологичных эпитопов близкородственных видов. | Нормальная сыворотка (5% об./об.) вида-хозяина меченого антитела | |
| Интерференция из-за сниженного количества иммунопреципитирующих (IP) антител при обнаружении белков 50 или 25 кДа | Чтобы избежать обнаружения тяжелых цепей IP-антител с молекулярной массой 50 кДа, проведите блот-зонд с конъюгированным антителом, специфичным к легким цепям. | Антитела против легких цепей |
Чтобы избежать обнаружения легких цепей IP-антитела с молекулярной массой 25 кДа, проведите блот-зонд с конъюгированным анти-IgG, Fc-фрагментом, специфичным после блокирования моновалентным Fab-фрагментом анти-Fc (FabuLight™). | Анти-Fc-специфические антитела Фрагменты Fab (FabuLight™) |
Для подтверждения активности репортерного фермента добавьте небольшой образец конъюгированного вторичного фермента непосредственно к субстрату и наблюдайте за ожидаемой реакцией. |
ИФА
| Проблемы | Решение | Указанный продукт |
|---|---|---|
| Фон | Используйте соответствующий объем блокирующего реагента, чтобы полностью заблокировать лунки перед инкубацией с первичным антителом. | Нормальная сыворотка (5% об./об.) вида-хозяина меченого антитела или БСА (5% вес./об.) (без IgG и без протеазы) |
| Нет сигнала | Используйте положительный контроль, чтобы продемонстрировать активность меченого вторичного антитела, покройте изотипом первичного антитела и непосредственно определите с помощью вторичного антитела | Очищенные белки ChromPure™ |
Меры предосторожности при блокировании бычьим сывороточным альбумином (БСА) или молоком: Бычий сывороточный альбумин (БСА) и сухое молоко иногда содержат бычий IgG. Дополнительная информация о БСА, не содержащем IgG и протеаз, от Jackson ImmunoResearch. |
IHC
| Проблемы | Решение | Указанный продукт |
|---|---|---|
| Подтверждение того, что первичное связывание антител обусловлено антигенной специфичностью | Используйте изотипический отрицательный контроль (неспецифический IgG того же вида, что и первичное антитело), чтобы продемонстрировать специфическое связывание первичного антитела. | Протеины ChromPure™ |
| Фон (общий) | Блокирует эндогенные сайты связывания, которые могут взаимодействовать с экспериментальными реагентами. | Нормальная сыворотка от хозяина меченого антитела. |
| Развести антитела в буфере без белков-носителей. Отцентрифугировать рабочий раствор для удаления агрегатов. | Правильный разбавитель и подготовка, т.е. PBS/Твин 20 | |
| Фон (распознавание гомологичного Ig) | Используйте перекрестно-адсорбированные вторичные антитела с минимальной перекрестной реактивностью к анализируемым видам клеток или тканей. | Вторичные антитела Min X |
| Блокируют эндогенные иммуноглобулины. | Фрагменты Fab | |
| Множественное мечение первичных антител от одного и того же вида хозяина (например, мышь на мыши) | Используйте Fab-фрагменты в предлагаемых протоколах для выполнения множественной маркировки (см. онлайн). | Фрагменты Fab |
| Иммунологическая метка первичного антитела перед инкубацией. | ФабуЛайт™ | |
| Эндогенные ферменты | Инактивация эндогенных пероксидаз перекисью водорода.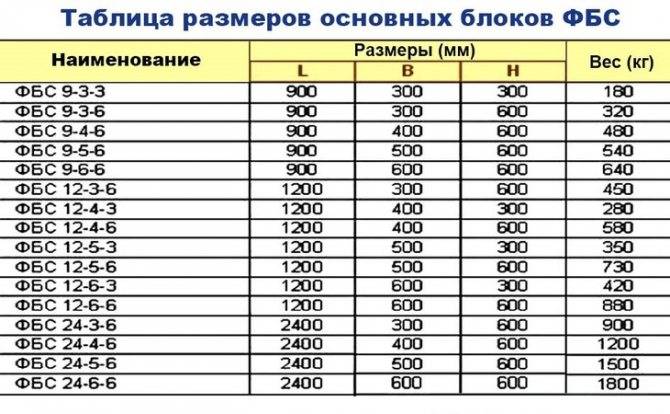 | Перекись водорода |
| Инактивация эндогенных фосфатаз левамизолом. | Левамизол | |
| Эндогенный биотин | Блокирует эндогенный биотин. | Инкубируйте со стрептавидином, а затем со свободным биотином. |
| Ионные или гидрофобные взаимодействия | Включите моющее средство в буферы, оптимизируйте концентрацию соли и pH. | Tween 20 и/или Triton X-100 |
Иммунореагенты
Компания Jackson ImmunoResearch предлагает широкий спектр иммунореагентов, предназначенных для повышения эффективности и простоты анализа. Приведенные ниже иммунореагенты выделены в этом руководстве. Посетите наш веб-сайт или ознакомьтесь с нашим каталогом для получения дополнительной информации о широком ассортименте вторичных антител и конъюгатов, производимых компанией Jackson ImmunoResearch.
- Нормальные сыворотки
- Очищенные белки ChromPure™ из нормальных сывороток
- Антитела моновалентного Fab-фрагмента, очищенные методом аффинной очистки
- Бычий сывороточный альбумин, не содержащий IgG и протеазы
Если вам требуется дополнительная поддержка при выборе антител или у вас возникли проблемы с экспериментом, свяжитесь с нашей технической командой по адресу tech@jacksonimmuno. |
Нормальные сыворотки
Нормальные сыворотки получают от неиммунизированных животных и, следовательно, не обнаруживают какой-либо специфический антиген. Обычная сыворотка, разбавленная до 5% (об./об.) в PBS (или аналогичном буфере), настоятельно рекомендуется в качестве блокирующего агента для снижения фона от неспецифического связывания с консервативной последовательностью и/или Fc-рецептором. Наилучшие результаты получаются с разбавленной нормальной сывороткой того же хозяина, что и меченое антитело, используемой в качестве отдельного этапа инкубации перед добавлением первичного антитела.
Просмотр нормальных сывороток
Очищенные белки ChromPure™ из нормальных сывороток
Белки ChromPure™ в основном используются в качестве экспериментальных контролей первичных или вторичных антител. Их также можно использовать в качестве блокирующих реагентов для Вестерн-блоттинга, IHC и IF. Белки ChromPure™ получают из сыворотки неиммунизированных животных и не распознают какие-либо известные антигены.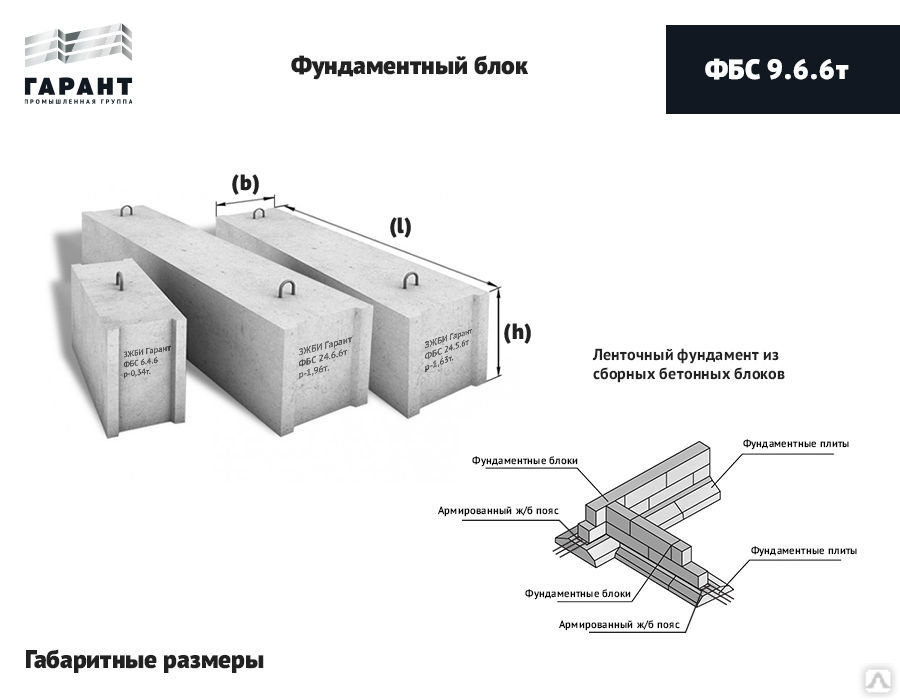 Их готовят с использованием различных хроматографических методов, чтобы получить материал без загрязняющих молекул вплоть до концентрации 20 мг/мл, что делает их идеальными для использования в качестве экспериментальных контролей для наиболее чувствительных анализов. Белки ChromPure™ доступны в различных форматов для многих видов, включая цельный иммуноглобулин, F(ab’) 2 и Fab-фрагменты.
Их готовят с использованием различных хроматографических методов, чтобы получить материал без загрязняющих молекул вплоть до концентрации 20 мг/мл, что делает их идеальными для использования в качестве экспериментальных контролей для наиболее чувствительных анализов. Белки ChromPure™ доступны в различных форматов для многих видов, включая цельный иммуноглобулин, F(ab’) 2 и Fab-фрагменты.
Также доступны человеческий IgM, сывороточный IgA и другие белки. Компания Jackson ImmunoResearch предлагает широкий спектр конъюгатов для этой линейки продуктов, в том числе ряд флуоресцентных красителей и репортерных ферментов, позволяющих изолировать сигнал, полученный в результате неспецифических взаимодействий.
Обзор ChromPure™ Purified Proteins
Моновалентные Fab-фрагменты
Affinity-Purified AntibodiesFab-фрагменты можно использовать для блокирования эндогенных иммуноглобулинов с целью снижения фонового окрашивания и двойного мечения первичных антител одного и того же вида-хозяина. В следующем примере показано, как можно использовать Fab-фрагменты для блокирования эндогенных иммуноглобулинов при использовании мышиных первичных антител на ткани мыши.
В следующем примере показано, как можно использовать Fab-фрагменты для блокирования эндогенных иммуноглобулинов при использовании мышиных первичных антител на ткани мыши.
Просмотреть фрагменты моновалентных Fab-фрагментов
Бычий сывороточный альбумин, не содержащий IgG и протеаз
Бычий сывороточный альбумин (БСА) широко используется в качестве белка-носителя для разбавления антител и в качестве общего блокатора белка в иммуноанализах и протоколах иммунодетекции. Если BSA является желательным разбавителем или блокирующим реагентом для вашего анализа, важно использовать BSA, подходящий для этой цели.
Большинство продуктов BSA, в том числе те, которые продаются как не содержащие обнаруживаемых IgG, загрязнены низкими уровнями бычьего IgG.
Бычьи IgG имеют много общих эпитопов с козьими, овечьими и лошадиными IgG и могут стать мишенью для вторичных антител, направленных против этих видов (исключение составляют бычьи антикозьи IgG). Это может произойти и с другими антителами, которые перекрестно реагируют с бычьим IgG. Взаимодействие может привести к потере активности антител и/или увеличению фона. Фон может возникать из-за липких, растворимых иммунных комплексов или из-за неспецифического связывания контаминирующего бычьего IgG, привлекающего перекрестно реагирующие меченые вторичные антитела.
Это может произойти и с другими антителами, которые перекрестно реагируют с бычьим IgG. Взаимодействие может привести к потере активности антител и/или увеличению фона. Фон может возникать из-за липких, растворимых иммунных комплексов или из-за неспецифического связывания контаминирующего бычьего IgG, привлекающего перекрестно реагирующие меченые вторичные антитела.
Бычий сывороточный альбумин Jackson ImmunoResearch не содержит IgG и протеазы. Он не содержит загрязняющих IgG, что устраняет общие проблемы иммуноанализа, связанные со многими коммерческими препаратами БСА высокой чистоты. БСА без IgG поставляется в виде чистого белка, высушенного вымораживанием из деионизированной воды, в упаковках по 10 г, 50 г и 250 г.
Просмотр Бычий сывороточный альбумин
Ссылки :
- Alberts B et al (1994) Molecular biology of the Cell. 3-е изд. Гирлянда Пресс. Лондон.
- Калюжный А. (2016) Иммуногистохимия – основные элементы и не только.

 За исключением Bovine Anti-Goat IgG компании Jackson ImmunoResearch, многие вторичные антитела, такие как Anti-Bovine, Anti-Goat и Anti-Sheep, будут реагировать с бычьим IgG. Следовательно, использование БСА или сухого молока для блокирования или разбавления может значительно увеличить фон и/или снизить титр антител. Для блокировки используйте обычную сыворотку (5% об./об.) вида-хозяина меченого вторичного антитела.
За исключением Bovine Anti-Goat IgG компании Jackson ImmunoResearch, многие вторичные антитела, такие как Anti-Bovine, Anti-Goat и Anti-Sheep, будут реагировать с бычьим IgG. Следовательно, использование БСА или сухого молока для блокирования или разбавления может значительно увеличить фон и/или снизить титр антител. Для блокировки используйте обычную сыворотку (5% об./об.) вида-хозяина меченого вторичного антитела.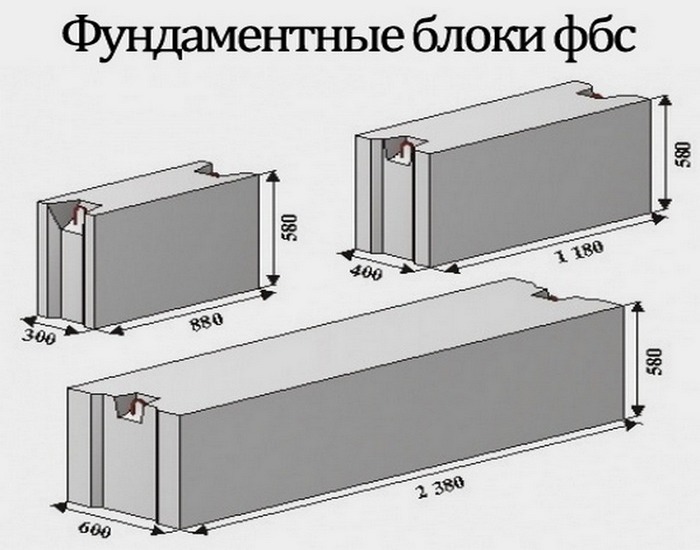 com.
com.