Уравнения равновесия [wiki.eduVdom.com]
Проекция силы на ось — характеризует действие этой силы вдоль этой оси.
То есть Проекция силы на ось Ох ($ P_x = \sum X_i $ ) характеризует действие этой силы вдоль оси Ох.
А проекция силы на ось Оу ($ P_y = \sum Y_i $ ) характеризует действие этой силы вдоль оси Оу.
И если сумма проекций всех сил на ось Ох равна нулю ($ \sum X_i = 0 $ )– значит действие этих сил вдоль этой оси Ох нет , силы вдоль этой оси друг друга уравновешивают.
И если сумма проекций всех сил на ось Оу равна нулю ($ \sum Y_i = 0 $ )- значит действие этих сил вдоль этой оси Оу нет , силы друг друга вдоль этой оси Оу уравновешивают.
Вращательное действие силы относительно точки О характеризует момент этой силы относительно этой точки О ($ M_0(P)=0 $) .
И если сумма моментов всех сил относительно точки О равно нулю ($ \sum M_O =0 $), то вращательного действия всех этих сил на тело относительно точки О нет, они его не производят, или их вращательные действия их взаимно уравновешены.
Теперь — если проекции всех сил на оси Ох и Оу равны нулю , и сумма моментов всех сил относительно любой — какой угодно — точки равны нулю, то тело находится в равновесии.
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$
Это и есть условия равновесия тела под действием произвольной плоской системы тел:
Система сил, действующих на тело, называется сходящейся, если линии действия этих сил пересекается в одной точке.
Условие равновесия системы сходящихся сил
Для того, чтобы система сходящихся сил была уравновешенной, то есть под действием ее тело будет находится в равновесии — условие равновесия системы сходящихся сил,
может быть записано :
$$ \sum X_i = 0
\\ \sum Y_i = 0
$$
Или другими словами — для плоской системы сходящихся сил, лежащих в плоскости Oxy, соответствующие уравнения равновесия примут вид:
$$ \sum X_i = 0 \\ \sum Y_i = 0 $$
Проекция силы на ось
Определение. Проекцией силы $\vec{Р}$ на ось Ox называется взятая с знаком $\pm$
длина отрезка этой оси, заключенная между проекциями на неё начала и конца
вектора силы.
Эту проекцию обычно обозначают как Рx или X. В соответствии с определением она равна:
$$ P_x = X = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{i}) = P \cdot \cos \alpha $$
$$ P_y = Y = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{j}) = P \cdot \sin \alpha $$
, где $\vec{i}$ – единичный вектор оси /Ox/, а $\alpha$ – угол между ним и силой $\vec{Р}$ (Рис.1).
Рис.1
Таким образом:
$$ P_x > 0\text{, если }0 \leq \alpha < \frac{\pi}{2} $$ $$ P_x = 0\text{, если } \alpha = \frac{\pi}{2} $$ $$ P_x < 0\text{, если } \frac{\pi}{2} < \alpha \leq \pi $$
Проекция силы на ось равна нулю, если сила перпендикулярно оси.
Аналогично находится проекция силы Р на ось Oy. 2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
Момент силы относительно центра
Приложим в точке А силу P и выясним — чем определяется момент силы относительно точки О, который характеризует вращательное действие этой силы относительно точки О(Рис.1).
Рис.1
Очевидно, что воздействие силы на тело будет зависеть не только от ее величины, но и от того, как она направлена, и в конечном итоге будет определяться ее моментом относительно центра О.
Рассмотренное определение момента силы подходит только для плоской системы сил.
Определение 1. Моментом силы Р относительно центра О называется
взятое со знаком $\pm$ произведение модуля силы на ее плечо – то есть длину
перпендикуляра, опущенного из моментной точки на линию действия силы.
Правило знаков: момент силы считается положительным, если сила
стремится повернуть тело против хода часовой стрелки и отрицательным, если
она вращает тело по ходу часовой стрелки.
В соответствии с данным определением момент силы численно равен удвоенной площади треугольника OAB, построенного на векторе силы P с вершиной в моментной точке: $M_0(P) = P\cdot d = 2S\Delta_{OAB}$ .
Отметим, что момент силы относительно точки О равен нулю, если линия действия силы проходит через моментную точку.
Уравнения равновесия плоской системы сил
Уравнения равновесия плоской системы сил,
которые можно записать в трех различных формах:
Первая форма:
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$Вторая форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum Y=0 $$ , где ось Oy не перпендикулярна отрезку АВТретья форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum M_C=0 $$ , где точки А, В и С не лежат на одной прямой.
Таким образом, любая из этих трех форм эквивалентна условию равновесия плоской системы сил и наоборот.
Центр тяжести
Центр тяжести — точка, через которую проходит равнодействующая сил тяжести при любом пространственном расположении тела.Если тело имеет ось или центр симметрии, то центр тяжести лежит там.
Центр тяжести квадрата и прямоугольника — точка пересечения его диагоналей.
Центр тяжести круга — в его центре.
Центр тяжести треугольника — в точке пересечения медиан.
Задачи и опыты
Задачи
Опыты с пояснением — физика 9 кл.
Рекомендуем
subjects/physics/уравнения_равновесия.txt · Последние изменения: 2020/12/18 18:40 — ¶
Уравнения равновесия [wiki.eduVdom.com]
Проекция силы на ось — характеризует действие этой силы вдоль этой оси.
То есть Проекция силы на ось Ох ($ P_x = \sum X_i $ ) характеризует действие этой силы вдоль оси Ох.
А проекция силы на ось Оу ($ P_y = \sum Y_i $ ) характеризует действие этой силы вдоль оси Оу.
И если сумма проекций всех сил на ось Ох равна нулю ($ \sum X_i = 0 $ )– значит действие этих сил вдоль этой оси Ох нет , силы вдоль этой оси друг друга уравновешивают.
И если сумма проекций всех сил на ось Оу равна нулю ($ \sum Y_i = 0 $ )- значит действие этих сил вдоль этой оси Оу нет , силы друг друга вдоль этой оси Оу уравновешивают.
Вращательное действие силы относительно точки О характеризует момент этой силы относительно этой точки О ($ M_0(P)=0 $) .
И если сумма моментов всех сил относительно точки О равно нулю ($ \sum M_O =0 $), то вращательного действия всех этих сил на тело относительно точки О нет, они его не производят, или их вращательные действия их взаимно уравновешены.
Теперь — если проекции всех сил на оси Ох и Оу равны нулю , и сумма моментов всех сил относительно любой — какой угодно — точки равны нулю, то тело находится в равновесии.
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$
Это и есть условия равновесия тела под действием произвольной плоской системы тел:
Система сил, действующих на тело, называется сходящейся, если линии действия этих сил пересекается в одной точке.
Условие равновесия системы сходящихся сил
Для того, чтобы система сходящихся сил была уравновешенной, то есть под действием ее тело будет находится в равновесии — условие равновесия системы сходящихся сил,
может быть записано :
$$ \sum X_i = 0
\\ \sum Y_i = 0
$$
Или другими словами — для плоской системы сходящихся сил, лежащих в плоскости Oxy, соответствующие уравнения равновесия примут вид:
$$ \sum X_i = 0 \\ \sum Y_i = 0 $$
Проекция силы на ось
Определение. Проекцией силы $\vec{Р}$ на ось Ox называется взятая с знаком $\pm$
длина отрезка этой оси, заключенная между проекциями на неё начала и конца
вектора силы.
Эту проекцию обычно обозначают как Рx или X. В соответствии с определением она равна:
$$ P_x = X = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{i}) = P \cdot \cos \alpha $$
$$ P_y = Y = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{j}) = P \cdot \sin \alpha $$
, где $\vec{i}$ – единичный вектор оси /Ox/, а $\alpha$ – угол между ним и силой $\vec{Р}$ (Рис.1).
Рис.1
Таким образом:
$$ P_x > 0\text{, если }0 \leq \alpha < \frac{\pi}{2} $$ $$ P_x = 0\text{, если } \alpha = \frac{\pi}{2} $$ $$ P_x < 0\text{, если } \frac{\pi}{2} < \alpha \leq \pi $$
Проекция силы на ось равна нулю, если сила перпендикулярно оси.
Аналогично находится проекция силы Р на ось Oy.
Вектор $ \vec{Р} $ может быть выражен:
$$\vec{Р} = P_x \cdot \vec{i} + P_y \cdot \vec{j} = X \cdot \vec{i} + Y \cdot \vec{j}$$
А равнодействующая плоской системы двух
сходящихся сил равна диагонали параллелограмма, построенного на
этих силах, как на сторонах. 2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
Момент силы относительно центра
Приложим в точке А силу P и выясним — чем определяется момент силы относительно точки О, который характеризует вращательное действие этой силы относительно точки О(Рис.1
Рис.1
Очевидно, что воздействие силы на тело будет зависеть не только от ее величины, но и от того, как она направлена, и в конечном итоге будет определяться ее моментом относительно центра О.
Рассмотренное определение момента силы подходит только для плоской системы сил.
Определение 1. Моментом силы Р относительно центра О называется
взятое со знаком $\pm$ произведение модуля силы на ее плечо – то есть длину
перпендикуляра, опущенного из моментной точки на линию действия силы.
Правило знаков: момент силы считается положительным, если сила
стремится повернуть тело против хода часовой стрелки и отрицательным, если
она вращает тело по ходу часовой стрелки.
В соответствии с данным определением момент силы численно равен удвоенной площади треугольника OAB, построенного на векторе силы P с вершиной в моментной точке: $M_0(P) = P\cdot d = 2S\Delta_{OAB}$ .
Отметим, что момент силы относительно точки О равен нулю, если линия действия силы проходит через моментную точку.
Уравнения равновесия плоской системы сил
Уравнения равновесия плоской системы сил,
которые можно записать в трех различных формах:
Первая форма:
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$Вторая форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum Y=0 $$ , где ось Oy не перпендикулярна отрезку АВТретья форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum M_C=0 $$ , где точки А, В и С не лежат на одной прямой.
Таким образом, любая из этих трех форм эквивалентна условию равновесия плоской системы сил и наоборот.
Центр тяжести
Центр тяжести — точка, через которую проходит равнодействующая сил тяжести при любом пространственном расположении тела.
Если тело имеет ось или центр симметрии, то центр тяжести лежит там.
Центр тяжести квадрата и прямоугольника — точка пересечения его диагоналей.
Центр тяжести круга — в его центре.
Центр тяжести треугольника — в точке пересечения медиан.
Задачи и опыты
Задачи
Опыты с пояснением — физика 9 кл.
Рекомендуем
subjects/physics/уравнения_равновесия.txt · Последние изменения: 2020/12/18 18:40 — ¶
Уравнения равновесия [wiki.eduVdom.com]
Проекция силы на ось — характеризует действие этой силы вдоль этой оси.
То есть Проекция силы на ось Ох ($ P_x = \sum X_i $ ) характеризует действие этой силы вдоль оси Ох.
А проекция силы на ось Оу ($ P_y = \sum Y_i $ ) характеризует действие этой силы вдоль оси Оу.
И если сумма проекций всех сил на ось Ох равна нулю ($ \sum X_i = 0 $ )– значит действие этих сил вдоль этой оси Ох нет , силы вдоль этой оси друг друга уравновешивают.
И если сумма проекций всех сил на ось Оу равна нулю ($ \sum Y_i = 0 $ )- значит действие этих сил вдоль этой оси Оу нет , силы друг друга вдоль этой оси Оу уравновешивают.
Вращательное действие силы относительно точки О характеризует момент этой силы относительно этой точки О ($ M_0(P)=0 $) .
И если сумма моментов всех сил относительно точки О равно нулю ($ \sum M_O =0 $), то вращательного действия всех этих сил на тело относительно точки О нет, они его не производят, или их вращательные действия их взаимно уравновешены.
Теперь — если проекции всех сил на оси Ох и Оу равны нулю , и сумма моментов всех сил относительно любой — какой угодно — точки равны нулю, то тело находится в равновесии.
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$
Это и есть условия равновесия тела под действием произвольной плоской системы тел:
Система сил, действующих на тело, называется сходящейся, если линии действия этих сил пересекается в одной точке.
Условие равновесия системы сходящихся сил
Для того, чтобы система сходящихся сил была уравновешенной, то есть под действием ее тело будет находится в равновесии — условие равновесия системы сходящихся сил,
может быть записано :
$$ \sum X_i = 0
\\ \sum Y_i = 0
$$
Или другими словами — для плоской системы сходящихся сил, лежащих в плоскости Oxy, соответствующие уравнения равновесия примут вид:
$$ \sum X_i = 0 \\ \sum Y_i = 0 $$
Проекция силы на ось
Определение. Проекцией силы $\vec{Р}$ на ось Ox называется взятая с знаком $\pm$
длина отрезка этой оси, заключенная между проекциями на неё начала и конца
вектора силы.
Эту проекцию обычно обозначают как Рx или X. В соответствии с определением она равна:
$$ P_x = X = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{i}) = P \cdot \cos \alpha $$
$$ P_y = Y = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{j}) = P \cdot \sin \alpha $$
, где $\vec{i}$ – единичный вектор оси /Ox/, а $\alpha$ – угол между ним и силой $\vec{Р}$ (Рис.1).
Рис.1
Таким образом:
$$ P_x > 0\text{, если }0 \leq \alpha < \frac{\pi}{2} $$ $$ P_x = 0\text{, если } \alpha = \frac{\pi}{2} $$ $$ P_x < 0\text{, если } \frac{\pi}{2} < \alpha \leq \pi $$
Проекция силы на ось равна нулю, если сила перпендикулярно оси.
Аналогично находится проекция силы Р на ось Oy.
Вектор $ \vec{Р} $ может быть выражен:
$$\vec{Р} = P_x \cdot \vec{i} + P_y \cdot \vec{j} = X \cdot \vec{i} + Y \cdot \vec{j}$$
А равнодействующая плоской системы двух
сходящихся сил равна диагонали параллелограмма, построенного на
этих силах, как на сторонах. 2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
Момент силы относительно центра
Приложим в точке А силу P и выясним — чем определяется момент силы относительно точки О, который характеризует вращательное действие этой силы относительно точки О(Рис.1).
Рис.1
Очевидно, что воздействие силы на тело будет зависеть не только от ее величины, но и от того, как она направлена, и в конечном итоге будет определяться ее моментом относительно центра О.
Рассмотренное определение момента силы подходит только для плоской системы сил.
Определение 1. Моментом силы Р относительно центра О называется
взятое со знаком $\pm$ произведение модуля силы на ее плечо – то есть длину
перпендикуляра, опущенного из моментной точки на линию действия силы.
Правило знаков: момент силы считается положительным, если сила
стремится повернуть тело против хода часовой стрелки и отрицательным, если
она вращает тело по ходу часовой стрелки.
В соответствии с данным определением момент силы численно равен удвоенной площади треугольника OAB, построенного на векторе силы P с вершиной в моментной точке: $M_0(P) = P\cdot d = 2S\Delta_{OAB}$ .
Отметим, что момент силы относительно точки О равен нулю, если линия действия силы проходит через моментную точку.
Уравнения равновесия плоской системы сил
Уравнения равновесия плоской системы сил,
которые можно записать в трех различных формах:
Первая форма:
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$Вторая форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum Y=0 $$ , где ось Oy не перпендикулярна отрезку АВТретья форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum M_C=0 $$ , где точки А, В и С не лежат на одной прямой.
Таким образом, любая из этих трех форм эквивалентна условию равновесия плоской системы сил и наоборот.
Центр тяжести
Центр тяжести — точка, через которую проходит равнодействующая сил тяжести при любом пространственном расположении тела.
Если тело имеет ось или центр симметрии, то центр тяжести лежит там.
Центр тяжести квадрата и прямоугольника — точка пересечения его диагоналей.
Центр тяжести круга — в его центре.
Центр тяжести треугольника — в точке пересечения медиан.
Задачи и опыты
Задачи
Опыты с пояснением — физика 9 кл.
Рекомендуем
subjects/physics/уравнения_равновесия.txt · Последние изменения: 2020/12/18 18:40 — ¶
Уравнения равновесия [wiki.eduVdom.com]
Проекция силы на ось — характеризует действие этой силы вдоль этой оси.
То есть Проекция силы на ось Ох ($ P_x = \sum X_i $ ) характеризует действие этой силы вдоль оси Ох.
А проекция силы на ось Оу ($ P_y = \sum Y_i $ ) характеризует действие этой силы вдоль оси Оу.
И если сумма проекций всех сил на ось Ох равна нулю ($ \sum X_i = 0 $ )– значит действие этих сил вдоль этой оси Ох нет , силы вдоль этой оси друг друга уравновешивают.
И если сумма проекций всех сил на ось Оу равна нулю ($ \sum Y_i = 0 $ )- значит действие этих сил вдоль этой оси Оу нет , силы друг друга вдоль этой оси Оу уравновешивают.
Вращательное действие силы относительно точки О характеризует момент этой силы относительно этой точки О ($ M_0(P)=0 $) .
И если сумма моментов всех сил относительно точки О равно нулю ($ \sum M_O =0 $), то вращательного действия всех этих сил на тело относительно точки О нет, они его не производят, или их вращательные действия их взаимно уравновешены.
Теперь — если проекции всех сил на оси Ох и Оу равны нулю , и сумма моментов всех сил относительно любой — какой угодно — точки равны нулю, то тело находится в равновесии.
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$
Это и есть условия равновесия тела под действием произвольной плоской системы тел:
Система сил, действующих на тело, называется сходящейся, если линии действия этих сил пересекается в одной точке.
Условие равновесия системы сходящихся сил
Для того, чтобы система сходящихся сил была уравновешенной, то есть под действием ее тело будет находится в равновесии — условие равновесия системы сходящихся сил,
может быть записано :
$$ \sum X_i = 0
\\ \sum Y_i = 0
$$
Или другими словами — для плоской системы сходящихся сил, лежащих в плоскости Oxy, соответствующие уравнения равновесия примут вид:
$$ \sum X_i = 0 \\ \sum Y_i = 0 $$
Проекция силы на ось
Определение. Проекцией силы $\vec{Р}$ на ось Ox называется взятая с знаком $\pm$
длина отрезка этой оси, заключенная между проекциями на неё начала и конца
вектора силы.
Эту проекцию обычно обозначают как Рx или X. В соответствии с определением она равна:
$$ P_x = X = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{i}) = P \cdot \cos \alpha $$
$$ P_y = Y = |\vec{Р}| \cdot \cos (\vec{Р}, \vec{j}) = P \cdot \sin \alpha $$
, где $\vec{i}$ – единичный вектор оси /Ox/, а $\alpha$ – угол между ним и силой $\vec{Р}$ (Рис.1).
Рис.1
Таким образом:
$$ P_x > 0\text{, если }0 \leq \alpha < \frac{\pi}{2} $$ $$ P_x = 0\text{, если } \alpha = \frac{\pi}{2} $$ $$ P_x < 0\text{, если } \frac{\pi}{2} < \alpha \leq \pi $$
Проекция силы на ось равна нулю, если сила перпендикулярно оси.
Аналогично находится проекция силы Р на ось Oy.
Вектор $ \vec{Р} $ может быть выражен:
$$\vec{Р} = P_x \cdot \vec{i} + P_y \cdot \vec{j} = X \cdot \vec{i} + Y \cdot \vec{j}$$
А равнодействующая плоской системы двух
сходящихся сил равна диагонали параллелограмма, построенного на
этих силах, как на сторонах. 2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
2}
\\ \cos (\vec{Р}, \vec{i}) = \frac{X}{P}
\\ \cos (\vec{Р}, \vec{j}) = \frac{Y}{P}
$$
Момент силы относительно центра
Приложим в точке А силу P и выясним — чем определяется момент силы относительно точки О, который характеризует вращательное действие этой силы относительно точки О(Рис.1).
Рис.1
Очевидно, что воздействие силы на тело будет зависеть не только от ее величины, но и от того, как она направлена, и в конечном итоге будет определяться ее моментом относительно центра О.
Рассмотренное определение момента силы подходит только для плоской системы сил.
Определение 1. Моментом силы Р относительно центра О называется
взятое со знаком $\pm$ произведение модуля силы на ее плечо – то есть длину
перпендикуляра, опущенного из моментной точки на линию действия силы.
Правило знаков: момент силы считается положительным, если сила
стремится повернуть тело против хода часовой стрелки и отрицательным, если
она вращает тело по ходу часовой стрелки.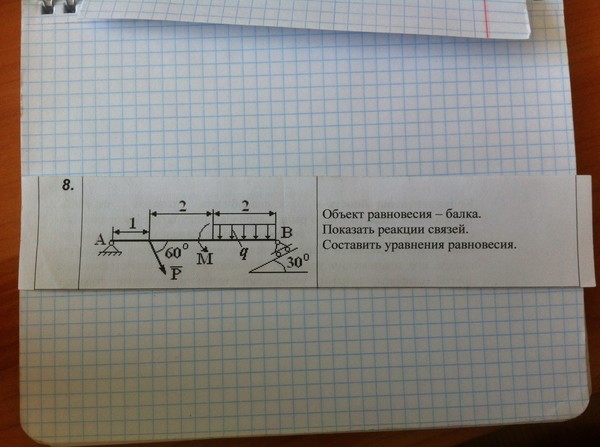
В соответствии с данным определением момент силы численно равен удвоенной площади треугольника OAB, построенного на векторе силы P с вершиной в моментной точке: $M_0(P) = P\cdot d = 2S\Delta_{OAB}$ .
Отметим, что момент силы относительно точки О равен нулю, если линия действия силы проходит через моментную точку.
Уравнения равновесия плоской системы сил
Уравнения равновесия плоской системы сил,
которые можно записать в трех различных формах:
Первая форма:
$$ \sum X=0 \\ \sum Y=0 \\ \sum M_A=0 $$Вторая форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum Y=0 $$ , где ось Oy не перпендикулярна отрезку АВТретья форма:
$$ \sum M_A=0 \\ \sum M_B=0 \\ \sum M_C=0 $$ , где точки А, В и С не лежат на одной прямой.
Таким образом, любая из этих трех форм эквивалентна условию равновесия плоской системы сил и наоборот.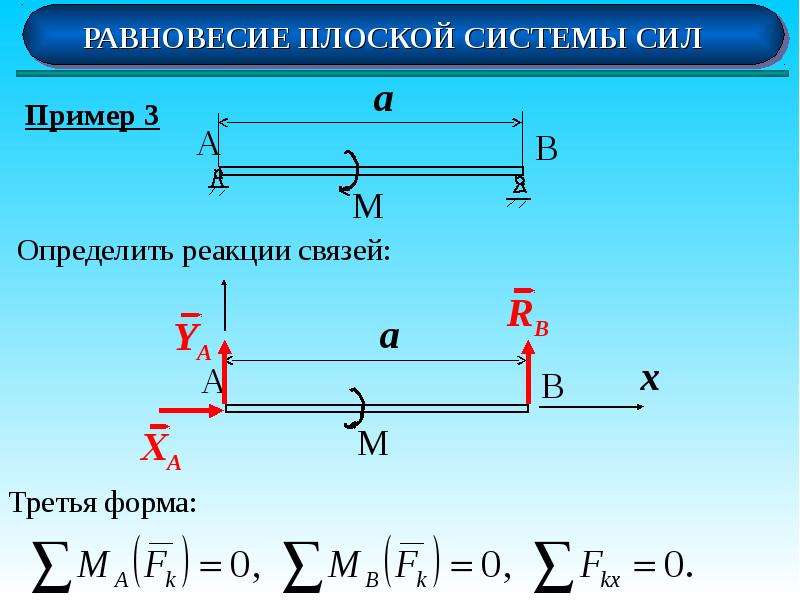
Центр тяжести
Центр тяжести — точка, через которую проходит равнодействующая сил тяжести при любом пространственном расположении тела.
Если тело имеет ось или центр симметрии, то центр тяжести лежит там.
Центр тяжести квадрата и прямоугольника — точка пересечения его диагоналей.
Центр тяжести круга — в его центре.
Центр тяжести треугольника — в точке пересечения медиан.
Задачи и опыты
Задачи
Опыты с пояснением — физика 9 кл.
Рекомендуем
subjects/physics/уравнения_равновесия.txt · Последние изменения: 2020/12/18 18:40 — ¶
§ 3. Уравнения равновесия произвольной системы сил.
Запишем полученные в предыдущем § е векторные условия равновесия произвольной системы сил:
Но
Замечаем, что условия равновесия произвольной системы сил в координатной форме запишутся:
Система уравнений
(1 — 6) называется уравнениями равновесия
произвольной системы сил в координатной
форме. Эти уравнения содержат как
задаваемые силы и моменты, так и силы и
моменты от сил реакции связей. В задачах
статики часть этих сил и моментов не
задана и подлежит определению. Естественно,
что число неизвестных сил и моментов
не должно превышать числа уравнений
равновесия. В противном случае говорят,
что задача становится статически
неопределимой.
Эти уравнения содержат как
задаваемые силы и моменты, так и силы и
моменты от сил реакции связей. В задачах
статики часть этих сил и моментов не
задана и подлежит определению. Естественно,
что число неизвестных сил и моментов
не должно превышать числа уравнений
равновесия. В противном случае говорят,
что задача становится статически
неопределимой.
§ 4. Теорема Вариньона.
При решении некоторых задач статики удобно пользоваться теоремой Вариньона.
Теорема: Если некоторая система сил в точке О приводится к равнодействующей (2-й случай приведения), то момент этой равнодействующей относительно другой точки О1 равен сумме моментов сил системы относительно точки О1.
Действительно:
Для силы системы Fi справедливы
соотношения:
o1i=oiii=oii
Так как заданная система
сил в точке О сводится
к равнодействующей, то Представив,найдём сумму моментов сил системы относительно точки О1:
Теорема Вариньона
позволяет упростить задачу вычисления
момента силы F относительно полюса О в
тех случаях, когда определение плеча
силы затруднительно. Например задан
полюс О и вектор силы F с точкой приложения
А, координаты которой XA и YA (рис.20,а).
Например задан
полюс О и вектор силы F с точкой приложения
А, координаты которой XA и YA (рис.20,а).
y
Рис.20.
Представив силу F как равнодействующую двух взаимно перпендикулярных сил
вычислим момент силы F относительно полюса О:
MO(F)=F*h=-Fx*YA+Fy*XA=-F*cos*YA+F*sin*XA.
§ 5.Уравнения равновесия системы сил в некоторых частных случаях.
а) Уравнения равновесия сходящейся системы сил.
Определение: Система сил называется сходящейся, если линии действия всех сил пересекаются (сходятся) в одной точке. Учитывая, что вектор силы есть скользящий вектор, все силы можно перенести в точку пересечения их линий действия и получить пучок сил.
Из рис. 21 очевидно,
что сходящаяся
21 очевидно,
что сходящаяся
система сил в точке О приводится к
равнодействующей
Рис.21.
Сумма моментов этих сил относительно точки их пересечения О тождественно равна нулю.
Следовательно, векторным условием равновесия сходящейся системы сил является
В проекциях на прямоугольные оси координат это условие перепишется в виде трёх уравнений:
Уравнения (1-3) называются уравнениями равновесия сходящейся системы сил в координатной форме. Заметим, что если сходящаяся система сил лежит в плоскости XY, то уравнение (3) превращается в тождество.
Отметим также, что уравнение (1-3) легко получаются из общих уравнений равновесия (1-6) для произвольной системы сил (см. § 3), если учесть особенности сходящихся сил. Исходя из сказанного, легко наметить план решения задач на равновесие сходящейся системы сил:
1. Выбрать систему
координат XYZ .
Выбрать систему
координат XYZ .
2.Освободиться от связей, заменив их силами реакции.
3.Найти проекции всех сил на координатные оси.
4.Составить и решить уравнения равновесия относительно неизвестных сил.
Примечание: В ряде случаев исследование равновесия сходящихся сил удобнее производить геометрическим способом, учитывая, что у равновесной системы сходящихся сил силовой многоугольник замкнут.
Рис.22.
Пример:
Определить усилия в шарнирных стержнях АС и ВС от действия вертикальной нагрузки P.
Обозначим усилия в стержнях SA и SB, приняв их растянутыми, составим уравнения равновесия
Решая систему уравнений в цифрах, получим:
SB=-11,6
Н(сжат) SA=5,8
Н(растянут).
Рис. 23.
б) Уравнения равновесия плоской системы сил. Система сил называется плоской, если линии действия всех сил располагаются в одной плоскости
Уравнения равновесия плоской системы
сил могут быть получены из уравнений
равновесия произвольной системы сил
(см.§ 3), если учесть аналитические
условия, определяющие особенности
плоской системы сил, например,
расположенной в плоскости XY:
(рис.24 )
Так для всех сил плоской системы, проекции их на ось Z равны нулю (FZ i=0). Кроме того, нулю равны и Z-е координаты всех точек приложения сил. Таким образом, будем иметь:
Система
уравнений(1-3)называется уравнениями
равновесия плоской системы сил. Отметим,
что при составлении этих уравнений
равновесия выбор координатных осей
произволен. Однако решение задачи
значительно упростится, если назначенные
оси координат окажутся перпендикулярными
или параллельными большинству сил
системы, а начало координат лежит на
пересечении возможно большего числа
линий действия неизвестных сил.
Однако решение задачи
значительно упростится, если назначенные
оси координат окажутся перпендикулярными
или параллельными большинству сил
системы, а начало координат лежит на
пересечении возможно большего числа
линий действия неизвестных сил.
При решении задач на исследование равновесия тел, наряду с сосредоточенными силами, приложенными в одной точке, могут действовать и распределённые нагрузки. Примерами распределённых нагрузок могут служить массовые силы, аэродинамические силы и др.
Распределённые нагрузки на схемах задаются:
— эпюрой распределения нагрузки;
— интенсивностью распределённой нагрузки;
— протяжённостью распределённой нагрузки(рис.25)
а)Прямоугольная эпюра б)Треугольная эпюра
q, н/м-интенсивность qmax., н/м — максимальная интенсивность
а, м-протяжённость а, м — протяжённость
Q=q*a, Q
— условная сосредо-
Q=0. 5*qmax*a,
Q
— условная сосредеточен-
5*qmax*a,
Q
— условная сосредеточен-
точенная сила ная сила
Рис.25.
Перед составлением уравнений равновесия следует распределённые нагрузки заменять условно сосредоточенными силами. Величина условно сосредоточенной силы пропорциональна площади эпюры, а линия её действия проходит через центр тяжести эпюры.
В этом § е уместно рассмотреть ещё один тип связей, не вошедший в таблицу 1 (см. § 3). Этот тип связей называется защемлённая или жёсткая заделка, схематически изображённая на рис. 26.
Жёсткая заделка А в плоской задаче
не позволяет задаваемым силам F
перемещать тело в направлении
координатных осей X и Y и не
позволяет поворачивать его
относительно точки А(оси Z).
Рис.26.
Следовательно, в жёсткой заделке возникают две составляющие силы реакции
AX и AY,
а также момент реакции MA (MZ).
Исходя из всего сказанного, можно наметить план решения задач на равновесие плоской системы сил:
1.Выбрать систему координат XY.
2.Освободиться от связей, заменив их силами и моментами реакций.
3.Заменить распределённые нагрузки условно сосредоточенными силами.
4.Составить и решить уравнения равновесия относительно неизвестных сил и моментов.
Пример: Однородная консольная балка длиной l=2 м и погонной массовой нагрузкой q=10кг/м нагружена сосредоточенной силой F=20Н и парой сил
M=10Н*м.Определить опорные реакции балки в точке защемления А.
Решение.
1.Вводим оси координат XY c
началом в точке А.
2.Освобождаемся от связи в виде
искомых реакций AX;AY;MA.
3.Заменяем массовую погонную
нагрузку балки q условно
сосредоточенной силой G
(силой тяжести), приложить её в
центре балки
Рис.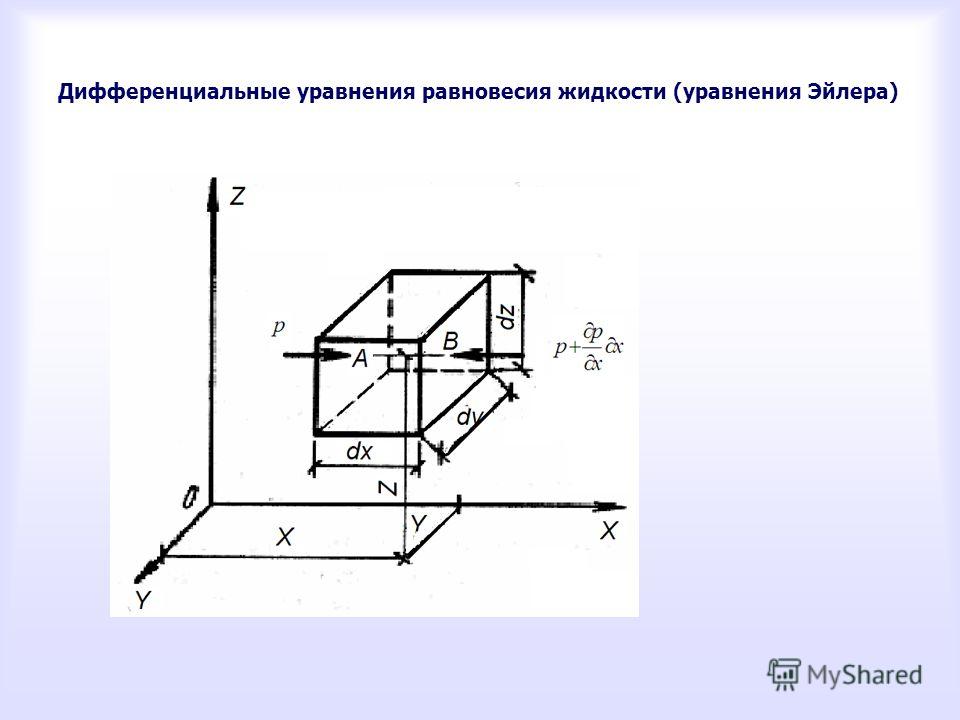 27.
27.
G=q * g * l=10*9,8*2=19,6 Н.
4.Составляем уравнения равновесия:
или в цифрах: Решаем:
АX+20*0,7=0; AX=-14 H
АY-19,6-20*0,7=0; AY=33,6Н
MA-10-19,6*1-20*0,7*2=0 МА=57,6 Нм.
Уравнения равновесия твёрдого тела (Лекция 3)
Пусть О – начало координат; – результирующая сила; – момент результирующей пары. Пусть точка О1 – новый центр приведения (рис.15).
Рис.15.
и : .
Новая система сил:
Заметим:
.
При изменении точки приведения => меняется только (в одну сторону с одним знаком, в другую – с другим). То есть точка: совпадают линии и
Аналитически: (колинеарность векторов)
Или:
; координаты точки О1.
Рис.16.
Это уравнение прямой линии, для всех точек которой направление результирующего вектора совпадает с направлением момента результирующей пары – прямая называется динамой.
Если на оси динамы => , то система эквивалентна одной результирующей силе, которую называют равнодействующей силой системы. При этом всегда , то есть .
Четыре случая приведения сил:
1.) ; — динама.
2.) ; — равнодействующая.
3.) ; — пара.
4.) ; — равновесие.
Два векторных уравнения равновесия: главный вектор и главный момент равны нулю
, .
Или шесть скалярных уравнений в проекциях на декартовые оси координат:
Здесь:
Сложность вида уравнений зависит от выбора точки приведения => искусство расчётчика.
Нахождение условий равновесия системы твёрдых тел, находящихся во взаимодействии задача о равновесии каждого тела в отдельности, причём на тело действуют внешние силы и силы внутренние (взаимодействие тел в точках соприкосновения с равными и противоположно направленными силами – аксиома IV, рис.17).
Выберем для всех тел системы один центр приведения. Тогда для каждого тела с номером условия равновесия:
, , ( = 1, 2, …, k)
где , — результирующая сила и момент результирующей пары всех сил, кроме внутренних реакций.
, — результирующая сила и момент результирующей пары сил внутренних реакций.
Формально суммируя по и учитывая по IV аксиоме
получаем необходимые условия равновесия твёрдого тела:
,
Пример.
Равновесие: = ?
Рис.18.
Контрольные вопросы:
1. Назовите все случаи приведения системы сил к одной точке.
2. Что такое динама?
3. Сформулируйте необходимые условия равновесия системы твёрдых тел.
Дальше…
Условия и уравнения равновесия твердого тела
Привет! Меня зовут Константин Вавилов и в этой статье я рассказу об условиях, при которых любая система сил, твердое тело, элемент конструкции или конструкция в целом находится в равновесии. А также напишу про уравнения равновесия, которые вытекают из этих условий. Рассмотрим три основные формы этих уравнений.
Условия равновесия произвольной системы сил
Еще Ньютон говорил, что если геометрическая сумма сил, действующая на тело, равна нулю, то тело:
- либо находится в состоянии покоя;
- либо движется равномерно прямолинейно.
Из теоретической механики известно, что действие нескольких сил, просуммировав, можно заменить равнодействующей силой:
\[ \bar { { R }_{ 1 } } +\bar { { R }_{ 2 } } +\bar { { R }_{ 3 } } +\bar { { R }_{ n } } =\bar { R } \]
Тогда обязательное условие равновесия можно записать так:
\[ \bar { R } =0 \]
Однако для полного равновесия, часто, этого условия недостаточно, если тело имеет возможность вращаться относительно какой-то точки или оси, то для равновесия такой системы, необходимо, чтобы выполнялось условие:
\[ \bar { M } =0 \]
где M — главные момент системы, который эквивалентен сумме моментов системы относительно некоторого центра.
Условия равновесия плоской системы сил
Выше описанные условия означают, что система будет находится в равновесии, когда все силы, действующие на систему, будут взаимно уравновешиваться и момент относительно любой произвольной точки будет равен нулю, отсюда вытекает первая и основная форма условий равновесия для плоской системы сил:
\[ \begin{cases} { ΣM }_{ A }=0 \\ { ΣF }_{ kx }=0 \\ { ΣF }_{ ky }=0 \end{cases} \]
Вторая форма условий равновесия записывается следующим образом:
\[ \begin{cases} { ΣM }_{ A }=0 \\ { ΣM }_{ B }=0 \\ { ΣF }_{ ky }=0 \end{cases} \]
Из данного условия следует, что для равновесия системы достаточно равенство нулю суммы моментов относительно двух точек (A и B), а также суммы проекций всех сил относительно некоторой оси.
Важно! Ось не должна быть перпендикулярна прямой AB.
И, наконец, третья форма условий равновесия выглядит так:
\[ \begin{cases} { ΣM }_{ A }=0 \\ { ΣM }_{ B }=0 \\ { ΣM }_{ С }=0 \end{cases} \]
Из данной системы уравнений следует, что для равновесия системы достаточно равенства нулю суммы моментов относительно трех точек.
Важно! Точки, относительно которых записываются уравнения не должны лежать на одной прямой.
Уравнения равновесия для плоской системы сил
Рассмотрим на примере плоской балки, как записываются уравнения равновесия. Использовать будет классическую (первую) форму условия равновесия:
\[ \begin{cases} { ΣM }_{ A }=0 \\ { ΣF }_{ kx }=0 \\ { ΣF }_{ ky }=0 \end{cases} \]
Сумма моментов относительно точки A:
\[ { ΣM }_{ A }=-q\cdot 4\cdot 4-M+{ R }_{ B }\cdot 8=0 \]
Сумма проекций всех сил на вертикальную ось (y):
\[ { ΣF }_{ ky }=-q\cdot 4+{ R }_{ A }+{ R }_{ B }-F=0 \]
Сумма проекций всех сил на горизонтальную ось(x):
\[ { ΣF }_{ kx }={ H }_{ A }=0 \]
Условие равновесия пространственной системы сил
Для пространственной системы сил условие равновесие выглядит вот так:
\[ \begin{cases} \begin{matrix} { ΣF }_{ kx }=0 \\ { ΣF }_{ ky }=0 \\ { ΣF }_{ kz }=0 \end{matrix} \\ \begin{matrix} { ΣM }_{ x }=0 \\ { ΣM }_{ y }=0 \\ { ΣM }_{ z }=0 \end{matrix} \end{cases} \]
Таким образом, пространственная система будет находиться в равновесии, если суммы проекций сил на координатные оси, а также суммы моментов относительно осей будут равны нулю.
Уравнения равновесия для пространственной системы сил
В качестве примера рассмотрим пространственную раму, закруженную сосредоточенными силами. Составим для нее шесть уравнений равновесия:
\[ { ΣF }_{ kx }=F=0 \]
\[ { ΣF }_{ ky }=P=0 \]
\[ { ΣF }_{ kz }=T-G=0 \]
\[ { ΣM }_{ x }=-T\cdot b+G\cdot b=0 \]
\[ { ΣM }_{ y }=-T\cdot a+G\cdot (a+c)=0 \]
\[ { ΣM }_{ z }=P\cdot a=0 \]
Выражений равновесия
Выражения равновесия
Равновесие Постоянные выражения
Реакции не прекращаются, когда приходят в равновесие. Но
прямая и обратная реакции находятся в равновесии, поэтому
нет чистого изменения концентраций реагентов или
продукты, и реакция, кажется, останавливается на макроскопическом
шкала. Химическое равновесие — это пример динамического баланс между противодействующими силами прямая и обратная реакции
не
статический баланс.
Давайте посмотрим на логические следствия предположения, что реакция между ClNO 2 и NO в конечном итоге достигает равновесие.
| ClNO 2 ( г ) | + | НЕТ ( г ) | НЕТ 2 ( г ) | + | ClNO ( г ) |
Скорость прямой и обратной реакции одинакова. когда эта система находится в равновесии.
| В состоянии равновесия: | ставка вперед | = | скорость обратная |
Замена законов ставок для прямого и обратного реакции на это равенство дает следующий результат.
| В состоянии равновесия: | k f (ClNO 2 ) (НЕТ) | = | k r (NO 2 ) (ClNO) |
Но это уравнение действительно только тогда, когда система находится на
равновесие, поэтому мы должны заменить (ClNO 2 ), (NO),
(NO 2 ) и (ClNO) с символами, обозначающими
что реакция находится в равновесии. По соглашению мы используем квадрат
скобки для этого. Уравнение, описывающее баланс
между прямой и обратной реакциями, когда система находится на
равновесие поэтому следует записать следующим образом.
По соглашению мы используем квадрат
скобки для этого. Уравнение, описывающее баланс
между прямой и обратной реакциями, когда система находится на
равновесие поэтому следует записать следующим образом.
| В состоянии равновесия: | k f [ClNO 2 ] [NO] | = | k r [NO 2 ] [ClNO] |
Преобразование этого уравнения дает следующий результат.
Начиная с k f и k r являются константами, отношение k f делится на k r также должно быть константой. Это соотношение — равновесие .
константа для реакции, K c .
Соотношение концентраций реагентов и продуктов составляет
известное как выражение константы равновесия .
Независимо от того, какое сочетание концентраций реагентов и продуктов, с которых мы начинаем, реакция достигнет равновесия, когда соотношение концентраций, определяемое равновесным постоянное выражение равно константе равновесия для реакция.Мы можем начать с большого количества ClNO 2 и очень мало НЕТ или много НЕТ и очень мало ClNO 2 . Это не имеет значения. Когда реакция достигает равновесия, соотношение между концентрациями реагентов и продукты, описываемые выражением константы равновесия, будут всегда быть таким же. При 25 o C эта реакция всегда достигает равновесия при соотношении этих концентраций 1,3 х 10 4 .
Процедура, используемая в этом разделе для получения равновесия постоянное выражение работает только с реакциями, которые происходят в одностадийный, такой как перенос атома хлора из ClNO 2 к НЕТ.Многие реакции требуют ряда шагов для преобразования реагентов. в продукты. Но любая реакция, которая достигает равновесия, нет независимо от того, простой или сложный, имеет константу равновесия выражение, удовлетворяющее правилам следующего раздела.
Правила письма Выражения констант равновесия
- Даже если химические реакции, которые достигают равновесия происходят в обоих направлениях, реагенты на правой стороне уравнения считаются «продукты» реакции и реагенты на левая часть уравнения считается «реактивы.«
- Продукты реакции всегда указываются над строка в числителе.
- Реагенты всегда записываются под строкой в знаменатель.
- Для однородных систем константа равновесия выражение содержит термин для каждого реагента и каждого продукт реакции.
- Числитель выражения константы равновесия: произведение концентраций «продукты» реакции возведены в степень равный коэффициенту для этого компонента в сбалансированное уравнение реакции.
- Знаменатель равновесия постоянное выражение — произведение концентраций «реагентов» возведены в степень, равную коэффициент для этого компонента в сбалансированном уравнение реакции.
Газофазные реакции были выбраны для этого введения в кинетика и равновесие, потому что они одни из самых простых химические реакции. Однако некоторые могут спросить, почему Выражения констант равновесия в предыдущем упражнении: выражается через концентрации газов в единицах моль на литр.
Единицы концентрации использовались, чтобы подчеркнуть взаимосвязь между химическим равновесием и скоростью химических реакций, которые представлены в виде концентраций реактивы и продукты. Этот выбор единиц обозначается значком добавление нижнего индекса « c» к символам для константы равновесия, чтобы показать, что они были рассчитаны из концентрации компонентов реакции.
Изменение или Объединение равновесных реакций
Что происходит с величиной константы равновесия для реакция, когда мы переворачиваем уравнение? Рассмотрим следующая реакция, например.
| ClNO 2 ( г ) | + | НЕТ ( г ) | НЕТ 2 ( г ) | + | ClNO ( г ) |
Выражение константы равновесия для этого уравнения имеет вид написано следующим образом.
Поскольку это обратимая реакция, она также может быть представлен уравнением, написанным в обратном направлении.
| НЕТ 2 ( г ) | + | ClNO ( г ) | ClNO 2 ( г ) | + | НЕТ ( г ) |
Теперь выражение константы равновесия записывается следующим образом.
Каждое из этих выражений константы равновесия является обратным другого.Таким образом, мы можем рассчитать K c путем деления K c на 1.
Мы также можем вычислить константы равновесия, объединив два или более реакций, для которых значение K c известен. Предположим, например, что мы знаем равновесие константы для следующих газофазных реакций при 200 o C.
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) | К c1 = 2,3 x 10 -19 | ||
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НО 2 ( г ) | К c2 = 3 x 10 6 |
Мы можем объединить эти реакции, чтобы получить общее уравнение для реакции между N 2 и O 2 с образованием НЕТ 2 .
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) | ||
| + | 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НО 2 ( г ) | |
| ______________________________________________________________ | |||||
| N 2 ( г ) | + | 2 O 2 ( г ) | 2 НО 2 ( г ) | ||
Легко показать, что выражение для константы равновесия для общей реакции равен произведению выражения констант равновесия для двух шагов в этом реакция.
Следовательно, константа равновесия для всей реакции равна равным произведению констант равновесия для отдельные шаги.
K c = K c1 x K c2 = (2.3 x 10 -19 ) (3 x 10 6 ) = 7 x 10 -13
Реакция Коэффициенты: способ определить, находится ли реакция в состоянии равновесия
У нас есть модель, которая описывает, что происходит, когда реакция достигает равновесия: на молекулярном уровне скорость прямая реакция равна скорости обратной реакции.Поскольку реакция идет в обоих направлениях с одинаковой скоростью, нет видимого изменения в концентрациях реагенты или продукты в макроскопическом масштабе уровень объекты, видимые невооруженным глазом. Эту модель также можно использовать для предсказать направление, в котором должна сместиться реакция, чтобы достичь равновесие.
Если концентрации реагентов слишком велики для реакция находится в равновесии, скорость прямой реакции будет быстрее, чем обратная реакция, и некоторые из реагенты будут превращаться в продукты до тех пор, пока не установится равновесие. достигнуто.И наоборот, если концентрации реагентов равны слишком мала, скорость обратной реакции превысит скорость прямая реакция, и реакция преобразует некоторые из избыток продуктов обратно в реагенты, пока система не достигнет равновесие.
Мы можем определить направление, в котором должна произойти реакция. сдвиг для достижения равновесия путем расчета реакции частное ( Q c ) для реакция.Коэффициент реакции определяется как произведение концентрации продуктов реакции, деленные на продукт концентрации реагентов в любой момент в время.
Чтобы проиллюстрировать, как используется коэффициент реакции, давайте рассмотрим следующую газофазную реакцию.
| H 2 ( г ) | + | I 2 ( г ) | 2 HI ( г ) |
Выражение константы равновесия для этой реакции: написано следующим образом.
По аналогии можно записать выражение для реакции частное следующим образом.
Q c может принимать любое значение между ноль и бесконечность. Если в системе много HI и очень мало H 2 и я 2 , реакция частное очень велико. Если в системе относительно мало HI и множество H 2 и I 2 , коэффициент реакции очень мал.
В любой момент времени есть три возможности.
1. Q c меньше K c . Система содержит слишком много реагента и недостаточно продукта для быть в равновесии. Стоимость Q c должен увеличиваться, чтобы реакция достигла равновесия. Таким образом, реакция должна превратить некоторые реагенты в продукты, чтобы прийти в равновесие.
2. Q c равно K c . Если это правда, то реакция находится в равновесии.
3. Q c больше K c . Система содержит слишком много продукта и недостаточно реагента для быть в равновесии.Стоимость Q c должен стать меньше, прежде чем реакция может прийти в равновесие. Таким образом, реакция должна превратить некоторые продукты в реагенты для достижения равновесия.
| Практическая задача 2: Предположим что концентрации H 2 , I 2 , и HI можно измерить для следующей реакции при любом момент во времени. H 2 ( г ) + I 2 ( г ) 2 HI ( г ) К в = 60 Для каждого из следующих наборов концентраций определить, находится ли реакция в равновесии. Если это нет, решите, в каком направлении он должен идти, чтобы достичь равновесие. (а) (H 2 ) = (I 2 ) = (HI) = 0.010 М (б) (HI) = 0,30 M ; (H 2 ) = 0,01 M ; (I 2 ) = 0,15 M (c) (H 2 ) = (HI) = 0,10 M ; (I 2 ) = 0,0010 M Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Изменения в Концентрация, возникающая в результате реакции, приходящей к равновесию
Относительный размер Q c и K c поскольку реакция говорит нам, находится ли реакция в равновесии при в любой момент времени.Если это не так, относительный размер Q c и K c говорят нам направление в который реакция должна сместиться, чтобы достичь равновесия. Теперь нам нужен способ предсказать, как далеко должна зайти реакция равновесие. Предположим, вы столкнулись со следующим проблема.
Пентахлорид фосфора разлагается до фосфора
трихлорид и хлор при нагревании.
Константа равновесия для этого реакция составляет 0,030 при 250 o C. Предполагая, что начальная концентрация PCl 5 равна 0.100 моль на литр и нет PCl 3 или Cl 2 в системе, когда мы начнем, давайте посчитаем концентрации PCl 5 , PCl 3 и Cl 2 в равновесии. |
Первым шагом к решению этой проблемы является организация информацию, чтобы она подсказывала, как действовать дальше. Задача содержит четыре блока информации: (1) сбалансированный уравнение, (2) константа равновесия реакции, (3) a описание начальных условий и (4) указание цель расчета равновесных концентраций три компонента реакции.
Следующий формат предлагает полезный способ резюмировать это Информация.
|
Начнем с уравновешенного уравнения и равновесия константу для реакции, а затем добавьте то, что мы знаем о начальные и равновесные концентрации различных компонентов реакции.Изначально колба содержит 0,100 моль на литр PCl 5 и не PCl 3 или Cl 2 . Наша цель — вычислить равновесные концентрации этих три вещества.
Прежде чем делать что-либо еще, мы должны решить, реакция находится в равновесии. Мы можем сделать это, сравнив коэффициент реакции для начальных условий с равновесием константа для реакции.
Хотя константа равновесия мала ( K c = 3.0 x 10 -2 ), коэффициент реакции еще меньше ( Q c = 0). Единственный способ достичь равновесия для этой реакции — это часть PCl 5 разложить на PCl 3 и Класс 2 .
Поскольку реакция не находится в равновесии, одно можно сказать наверняка концентрации PCl 5 , PCl 3 и Cl 2 все будет меняться по мере того, как реакция приходит к равновесию.Поскольку реакция должна сместиться вправо, чтобы достичь равновесия, PCl 5 концентрация станет меньше, в то время как PCl 3 и Концентрация Cl 2 станет больше.
На первый взгляд эта проблема кажется имеют три неизвестных: равновесные концентрации PCl 5 , PCl 3 и Cl 2 . Потому что трудно решить проблему с тремя неизвестными, мы должны искать отношения, которые могут уменьшить сложность проблемы.В одну сторону достижения этой цели состоит в том, чтобы посмотреть на взаимосвязь между изменения, происходящие в концентрациях PCl 5 , PCl 3 , и Cl 2 , когда реакция приближается к равновесию.
| Практическая задача 3: Рассчитать увеличение PCl 3 и Cl 2 концентрации, которые возникают при наступлении следующей реакции к равновесию, если концентрация PCl 5 уменьшается на 0.042 моль на литр. PCl 5 ( г ) PCl 3 ( г ) + Cl 2 ( г ) Нажмите здесь, чтобы проверить свой ответ на практическую задачу 3 |
Существует простая связь между изменением в концентрации трех компонентов реакции, так как это приходит в равновесие из-за стехиометрии реакция.
Было бы полезно иметь символ для обозначения изменения что происходит при концентрации одного из компонентов реакция по мере перехода от начальных условий к равновесию. А функция состояния — это свойство системы, значение которого зависит только от состояния системы. Изменение стоимости функции состояния определяется следующим уравнением.
X = X окончательный — X начальный
Мы можем распространить этот аргумент на обсуждение химических реакции, которые приходят в равновесие, определяя ( X ) как величина изменения, которое происходит в концентрации X по мере того, как реакция приходит к равновесию.Мы можем определить (PCl 5 ), например, как величина изменения концентрации PCl 5 , который возникает, когда это соединение разлагается до форма PCl 3 и Cl 2 .
| (PCl 5 ) | = | (PCl 5 ) | – | [PCl 5 ] | |
| PCl 5 израсходовано как реакция приходит на равновесие | начальный концентрация | концентрация в равновесие |
Преобразуя это уравнение, находим, что концентрация PCl 5 в состоянии равновесия равна начальной концентрация PCl 5 за вычетом количества PCl 5 расходуется по мере того, как реакция приходит к равновесию.
| [PCl 5 ] | = | (PCl 5 ) | – | (PCl 5 ) | |
| концентрация в равновесие | начальный концентрация | PCl 5 израсходовано как реакция приходит на равновесие |
Затем мы можем определить (PCl 3 ) и (Cl 2 ) как изменения, происходящие в PCl 3 и Cl 2 концентрации по мере того, как реакция приходит к равновесию.В концентрации обоих этих веществ в равновесии будут больше, чем их начальные концентрации.
| [PCl 3 ] | = | (PCl 3 ) | + | (PCl 3 ) | |
| [класс 2 ] | = | (класс 2 ) | + | (класс 2 ) |
Величина изменения концентраций этих три вещества, поскольку реакция приходит к равновесию, будут тоже самое.Из-за стехиометрии реакции 1: 1: 1 величина изменения концентрации PCl 5 по мере того, как реакция приходит к равновесию, равна величине изменение концентраций PCl 3 и Cl 2 .
(PCl 5 ) = (PCl 3 ) = (класс 2 )
Таким образом, мы можем переписать уравнения, определяющие равновесные концентрации PCl 5 , PCl 3 , и Cl 2 с точки зрения единственного неизвестного: C.
[PCl 5 ] = (PCl 5 ) — C
[PCl 3 ] = (PCl 3 ) + C
[класс 2 ] = (класс 2 ) + C
Подставляя то, что мы знаем о начальных концентрациях PCl 5 , PCl 3 и Cl 2 в эти уравнений дает следующий результат.
[PCl 5 ] = 0,100 — C
[PCl 3 ] = [Cl 2 ] = 0 + C
Теперь мы можем резюмировать то, что мы знаем об этой реакции, как следует.
|
Теперь у нас есть только одно неизвестное C, и нам нужно только одно уравнение для решения один неизвестный.Очевидное уравнение, к которому следует обратиться, — это равновесие постоянное выражение этой реакции.
Подставляем то, что мы знаем о равновесных концентрациях из PCl 5 , PCl 3 и Cl 2 в эту уравнение дает следующий результат.
Это уравнение можно расширить, а затем изменить, чтобы получить квадратное уравнение
С 2 + 0.030 С — 0,0030 = 0
, которое можно решить с помощью формулы корней квадратного уравнения.
C = 0,042 или -0,072
Хотя из этого расчета можно получить два ответа, только положительный корень имеет любой физический смысл, потому что у нас не может быть отрицательная концентрация. Таким образом, величина изменения концентрации PCl 5 , PCl 3 и Cl 2 когда эта реакция приходит в равновесие, 0.042 моль на литр.
C = 0,042 M
Подставляя это значение обратно в уравнения, определяющие равновесные концентрации PCl 5 , PCl 3 , и Cl 2 дает следующие результаты.
[PCl 5 ] = 0,100 — 0,042 = 0,058 M
[PCl 3 ] = [Cl 2 ] = 0 + 0,042 = 0,042 M
Другими словами, чуть меньше половины PCl 5 настоящее время сначала разлагается на PCl 3 и Cl 2 когда эта реакция приходит к равновесию.
Чтобы проверить, соответствуют ли результаты этого расчета допустимые значения равновесных концентраций трех компоненты этой реакции, мы можем подставить эти значения в выражение константы равновесия.
Эти результаты должны быть законными, потому что константа равновесия, рассчитанная по этим концентрациям, равна равно значению K c , указанному в проблема, в пределах экспериментальной ошибки.
Скрытые предположения упрощающие расчет равновесия
Предположим, вас попросили решить немного сложную проблема.
|
Первым шагом в решении этой проблемы является создание представление информации в задаче.
|
Затем мы сравниваем коэффициент реакции для начального условия с константой равновесия для реакции.
Т.к. начальные концентрации SO 2 и O 2 равны нулю, реакция должна сместиться вправо, чтобы достичь равновесие. Как и следовало ожидать, некоторые из SO 3 имеют разложить на SO 2 и O 2 .
Стехиометрия этой реакции сложнее, чем у реакция в предыдущем разделе, но изменения в концентрации трех компонентов реакции все еще связанные с.На каждые два моля разлагающегося SO 3 мы получить два моля SO 2 и один моль O 2 , так как показано на рисунке ниже. Мы можем включить эти отношения в формат, который мы использовали ранее, с помощью сбалансированного уравнения для реакции в качестве ориентира.
Определены признаки условий C в данной задаче тем, что реакция должна сдвигаться слева направо, чтобы достичь равновесия.Коэффициенты в терминах C отражают коэффициенты в сбалансированном уравнении для реакция. Потому что вдвое больше молей SO 2 произведено как моль O 2 , изменение концентрация SO 2 по мере того, как реакция доходит до равновесие должно быть вдвое больше, чем изменение концентрация O 2 . Потому что два моля SO 3 расходуются на каждый моль произведенного O 2 , изменение в SO 3 концентрация должна быть вдвое больше, чем изменение концентрации O 2 .
Подставляя то, что мы знаем о проблеме, в выражение константы равновесия для реакции дает следующее уравнение.
Это уравнение немного сложнее расширить, но оно можно преобразовать в следующее кубическое уравнение.
4 C 3 — 6,4 x 10 -10 C 2 + 6,4 x 10 -11 C — 1,6 x 10 -12 = 0
Однако решить кубические уравнения сложно.Эта проблема поэтому пример семейства сложных проблем, если не невозможно, решить точно. Эти проблемы решены с общей стратегией, которая состоит из предположений или приближение, которое превращает их в более простые задачи. В следуя общим правилам, мы будем руководствоваться при обсуждении методов приближение.
| ПРАВИЛА ИСПОЛЬЗОВАНИЯ АППРОКСИМАЦИИ
МЕТОДЫ 1. Нет ничего плохого в том, чтобы сделать предположение. 2. Есть два главных греха: (a) Забыть, какие предположения были сделаны. (b) Забыть проверить правильность допущений. действительный. |
Какие предположения можно сделать, чтобы упростить эту задачу? Пошли вернемся к первому, что мы сделали после создания представительства для проблемы. Мы начали наш расчет со сравнения коэффициент реакции для начальных концентраций с константа равновесия реакции.
Затем мы пришли к выводу, что коэффициент реакции ( Q c = 0) была меньше константы равновесия ( K c = 1,6 x 10 -10 ) и решил, что некоторые из SO 3 должен был бы разложиться, чтобы эта реакция равновесие.
А как насчет относительных величин коэффициента реакции и константа равновесия реакции? Начальные значения Q c и K c являются относительно небольшими, что означает, что начальные условия достаточно близки к равновесие, как показано на рисунке ниже.В результате реакции не нужно далеко идти, чтобы достичь равновесия. это поэтому разумно предположить, что C является относительно небольшой в этой проблеме.
Важно понимать природу допущения. Быть сделанным. Мы не предполагаем, что C является нуль. Если бы мы сделали это, все неизвестное исчезло бы из уравнение! Мы только предполагаем, что C небольшой.Настолько мала по сравнению с исходной концентрацией SO 3 что не имеет значения, когда 2 C вычитается из этого числа. Мы можем записать это предположение в виде следует.
0,100 — 2 С 0,100
Давайте теперь вернемся к уравнению, которое мы пытаемся решить.
Принимая допущение, что 2 C является намного меньше, чем 0,100, мы можем заменить это уравнение на следующее приближенное уравнение.
Расширение этого дает уравнение, которое намного проще решить. для .
4 C 3 1,6 x 10 -12
C 7,4 x 10 -5 M
Прежде чем мы продолжим, мы должны проверить наше предположение. та 2 C настолько мал по сравнению с 0,100, что не дает существенная разница при вычитании из этого числа.Является это предположение верно? 2 C достаточно мал по сравнению с 0,100 до игнорировать?
0,100 — 2 (0,000074) 0,100
Да, 2 C на порядок меньше экспериментальной ошибки участвует в измерении начальной концентрации SO 3 .
Таким образом, мы можем использовать это приблизительное значение от C до рассчитать равновесные концентрации SO 3 , SO 2 , и О 2 .
[SO 3 ] = 0,100 — 2 C 0,100 M
[SO 2 ] = 2 C 1,5 x 10 -4 M
[O 2 ] = C 7,4 x 10 -5 M
Равновесие между SO 3 и смесями SO 2 и O 2 , следовательно, сильно поддерживает SO 3 , а не СО 2 .
Мы можем проверить результаты нашего расчета, подставив это приводит к выражению константы равновесия для реакция.
Значение константы равновесия, которое получается из этого расчет соответствует значению, указанному в задаче, в пределах экспериментальная ошибка. Наше предположение, что 2 C равно пренебрежимо мала по сравнению с исходной концентрацией SO 3 поэтому действительна, и мы можем быть уверены в ответах на нее. обеспечивает.
Практическое правило для Проверка правильности предположений
Не было сомнений в справедливости предположения, что C было малым по сравнению с исходной концентрацией SO 3 в предыдущий раздел.Значение C было настолько маленьким, что 2 C было на порядок меньше, чем ошибка эксперимента при измерении начальной концентрации SO 3 .
В общем, мы можем получить некоторое представление о том, может ли C быть достаточно маленький, чтобы его можно было игнорировать, сравнивая первоначальную реакцию частное с константой равновесия для реакции. Если Q c и K c оба намного меньше 1, или оба намного больше 1, реакция не будет очень далека от идти, чтобы достичь равновесия, и предположение, что C мало достаточно, чтобы игнорировать, вероятно, законно.
Возникает интересный вопрос: как решаем ли мы, действительно ли предположить, что это достаточно мало игнорировать? Ответ на этот вопрос зависит от того, сколько ошибку, которую мы готовы допустить в наши вычисления, прежде чем мы откажемся от больше доверяю результатам. Как показывает практика, химики обычно предположим, что C пренебрежимо мало до тех пор, пока добавляется или вычитается из начальных концентраций реагентов или продуктов составляет менее 5% от начального концентрация.Наилучший способ решить, действительно ли предположение соответствует этому эмпирическому правилу в конкретном вычислении — это попробовать и посмотрите, работает ли это.
| Практическая задача 5: Аммиак производится из азота и водорода следующими способами обратимая реакция. N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г ) Предположим, что начальная концентрация N 2 равно 0.050 моль на литр и начальная концентрация H 2 составляет 0,100 моль на литр. Рассчитать равновесные концентрации трех компонентов эта реакция при 500 o C, если равновесие Константа реакции при этой температуре составляет 0,040. Нажмите здесь, чтобы проверить свой ответ на практическую задачу 5 Нажмите здесь, чтобы увидеть решение практической задачи 5 |
Что делать, когда приближение не удается?
Легко представить себе проблему, в которой предположение, что C мало по сравнению с начальными концентрациями не может быть достоверным.Все, что нам нужно сделать, это построить проблему, в которой есть большая разница между значениями Q c для начальных концентраций и K c для реакции в равновесии. Рассмотрим следующую задачу: Например.
|
Мы снова начинаем с представления информации в проблема в следующем.
|
Первый шаг всегда один и тот же: сравните начальное значение коэффициента реакции с равновесным постоянный.
Связь между исходным коэффициентом реакции ( Q c = 0) и константа равновесия ( K c = 3 x 10 6 ) говорит нам о том, что мы, возможно, уже имеем подозревается, реакция должна сместиться вправо, чтобы достичь равновесие.
Кто-то может спросить: «Зачем рассчитывать начальное значение коэффициент реакции для этой реакции? Разве не очевидно, что реакция должна сместиться вправо, чтобы получить хоть какой-то NO 2 ? » Да, это.Но вычисляя значение Q c потому что реакция не просто говорит нам, в каком направлении она сдвинуть, чтобы достичь равновесия. Это также дает нам представление о как далеко должна зайти реакция, чтобы достичь равновесия.
В данном случае Q c это очень много менее K c для реакции что мы должны сделать вывод, что начальные условия очень далеки от равновесия.Поэтому было бы ошибкой предположить, что маленький.
Мы не можем предположить, что это ничтожно мало в этой задаче, но мы можем переопределить проблему так, чтобы это предположение стало действительный. Ключ к достижению этой цели — помнить условия, при которых мы можем считать, что это достаточно мало, чтобы быть игнорируется. Это предположение действительно только тогда, когда Q c имеет тот же порядок величины, что и K c .(Когда Q c и K c оба намного больше 1 или намного меньше 1.) Мы можем решить проблемы, для которых Q c не близок к K c путем переопределения начального условия так, что Q c становится близким к K c (см. рисунок ниже).
Чтобы показать, как это можно сделать, вернемся к задаче. приведено в этом разделе.
Константа равновесия реакции NO с O 2 для формирования NO 2 намного больше 1 ( K c = 3 х 10 6 ). Это означает, что равновесие благоприятствует продукты реакции. Лучший способ справиться с этой проблемой — загнать реакцию как можно дальше вправо, а затем пусть он вернется к равновесию. Поэтому давайте определим промежуточный набор условий, соответствующих тому, что произойдет, если мы сдвинем реакцию как можно дальше вправо.
|
Мы можем увидеть, к чему это приведет, посчитав реакцию частное для промежуточных условий.
Коэффициент реакции теперь больше, чем равновесный постоянный, и реакция должна сместиться обратно влево, чтобы достичь равновесие. Некоторые из NO 2 должны теперь разложиться на форма NO и O 2 .Связь между изменениями в концентрации трех компонентов этой реакции определяется стехиометрией реакции, как показано на рисунок ниже.
(NO 2 ) вдвое больше (O 2 ).
Теперь мы подставляем то, что мы знаем о реакции, в выражение константы равновесия.
Поскольку коэффициент реакции для промежуточных условий и константа равновесия относительно велики, мы можем предположить, что реакции не так уж и далеко, чтобы достичь равновесие. Другими словами, мы предполагаем, что 2 C является малая по сравнению с промежуточной концентрацией NO 2 и выведите следующее приближенное уравнение.
Затем мы решаем это уравнение для приблизительного значения C.
Теперь проверим наше предположение, что 2 C является Достаточно малая по сравнению с промежуточной концентрацией NO 2 быть проигнорированным.
Значение 2C меньше 2% от промежуточного концентрация NO 2 , что означает, что он может быть законно игнорируется в этом расчете.
Поскольку аппроксимация верна, мы можем использовать новое значение для расчета равновесных концентраций NO, NO 2 , и О 2 .
Результаты этого расчета дают представление о химия загрязняющих веществ, образующихся при внутреннем сгорании двигатель. При сгорании смеси бензина и воздуха N 2 и O 2 в воздухе реагируют с образованием NO, который затем может реагировать с кислородом с образованием NO 2 .
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) | ||
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НО 2 ( г ) |
Хотя продукт этих реакций часто описывается как NO x , чтобы указать, что это смесь NO и NO 2 это Расчет предполагает, что доминирующий продукт реакции будет NO 2 , если эта реакция придет к равновесию.
Мы можем проверить наши расчеты, подставив эти концентрации обратно в выражение константы равновесия.
Еще раз, мы можем принять справедливость предположения, которое мы пришлось сделать, чтобы получить эти равновесные концентрации, потому что значение константы равновесия, которое получается из этого Расчет соответствует значению K c приведено в задаче, в пределах ошибки эксперимента.
В общем, предположение, что C мало по сравнению с начальные концентрации реагентов или продуктов работают лучше всего при следующих условиях.
1. Когда K c << 1 и мы приближаются к равновесию слева направо. (Начнем с лишнего реагентов и образуют некоторые продукты.)
2. Когда K c >> 1 и мы подходить к равновесию справа налево. (Начнем с лишнего продукты и образуют некоторые реагенты.)
Равновесие Выражается в парциальных давлениях
Химики обычно изучают газовое равновесие, следуя парциальные давления газов в реакции.Мы можем понять почему это возможно, переписав уравнение идеального газа на дают следующую зависимость между давлением газа и его концентрация в молях на литр.
Таким образом, мы можем охарактеризовать следующую реакцию
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) |
с константой равновесия, определенной в единицах концентрация
или константа равновесия, определенная в терминах частичного давления.
Какая связь между K p и K c для газофазной реакции? Согласно переформулированной версии уравнения идеального газа, давление газа равно концентрации газа умноженное на произведение постоянной идеального газа и температуры в единицах кельвина.
Таким образом, мы можем рассчитать значение K p для реакции путем умножения каждого члена на K c выражение по RT .
Сбор терминов в этом примере дает следующий результат.
K p = K c х ( РТ ) -2
В целом стоимость К р для реакции можно рассчитать из K c со следующим уравнением.
В этом уравнении n — это разница между количеством молей продуктов и количество молей реагентов в сбалансированной уравнение.
Техника решения рабочих задач с использованием K p выражения такие же, как и для K c проблемы, за исключением того, что вместо концентрации для представления количества исходных материалов и продукты, которые присутствуют как в исходном состоянии, так и в состоянии равновесия.
Влияние Температура химической реакции
Если константа равновесия действительно постоянна, почему мы имеем беспокоиться о температуре реакции?
Ответ прост.Оба K c и K p для реакции — константы при заданная температура, но они могут меняться в зависимости от температуры. Рассмотреть возможность равновесие между NO 2 и его димером, N 2 O 4 , Например.
| 2 НЕТ 2 ( г ) | N 2 O 4 ( г ) |
На рисунке ниже показано влияние температуры на это равновесие.При охлаждении герметичной трубки, содержащей NO 2 в бане сухой лед / ацетон при -78 o C, интенсивность коричневая окраска газа NO 2 значительно уменьшается. Если прогреваем трубку на водяной бане, коричневый цвет становится более интенсивным, чем при комнатной температуре.
Константа равновесия этой реакции изменяется с изменением температуры, как показано в таблице ниже. При низких температурах равновесие благоприятствует димеру, N 2 O 4 .В при высоких температурах равновесие благоприятствует NO 2 . В тот факт, что константы равновесия зависят от температуры объясняет, почему вы можете найти разные значения для равновесия константа для той же химической реакции.
| Температура Зависимость константы равновесия Димеризация NO 2 | ||||
| Температура ( o C) | К п | К в | ||
| 100 | 0.067 | 2,1 | ||
| 25 | 7,1 | 170 | ||
| 0 | 63 | 1400 | ||
| -78 | 25 000 000 | 400 000 000 | ||
Уравнение равновесия — обзор
Уравнения равновесия могут быть записаны для каждого сустава по очереди в терминах коэффициентов натяжения и координат сустава, относящихся к некоторой удобной системе осей.Решение этих уравнений дает t AB и т. Д., Откуда T AB = t AB L AB , в котором можно вычислить L AB , если не указано иное. используя теорему Пифагора, т.е. LAB = (xB − xA) 2+ (yB − yA) 2. Опять же, исходное предположение о растяжении в элементе приводит к отрицательным значениям, соответствующим сжатию. Обратите внимание на порядок суффиксов в уравнениях (4.3) и (4.4).
Пример 4.6Определите силы в элементах фермы с шарнирным соединением, показанной на рис.4.21.
Рисунок 4.21. Расчет фермы с использованием коэффициентов натяжения (Пример 4.6).
Сначала рассчитываются опорные реакции, которые показаны на рис. 4.21.
Следующим шагом является выбор системы осей xy , а затем вставка координат соединения в диаграмму. На рис. 4.21 мы выберем точку опоры A в качестве начала осей, хотя на самом деле достаточно любого соединения; тогда совместные координаты будут такими, как показано.
Опять же, как и в методе соединений, решение может начаться только в соединении, в котором существует не более двух неизвестных сил стержня, в данном случае соединения A и E.Теоретически неважно, в каком из этих соединений начинается анализ, но поскольку A является началом осей, мы начнем с A. Обратите внимание, что нет необходимости вставлять стрелки, чтобы указать направления сил стержня, поскольку предполагается, что элементы находятся в напряжение и направления составляющих сил стержня автоматически задаются при записи в терминах коэффициентов натяжения и координат соединения (уравнения (4.3) и (4.4)).
Уравнения равновесия в сочленении A:
(i) xdirection: tAB (xB − xA) + tAC (xC − xA) −RA, H = 0
(ii) ydirection: tAB (yB − yA) + tAC (yC − yA) −RA, V = 0
Подставляя значения R A, H , R A, V и совместные координаты в уравнения (i) и (ii), получаем , из уравнения.(i),
tAB (0−0) + tAC (1.5−0) –3 = 0
, откудаtAC = + 2.0
и из уравнения. (ii)tAB (1.5−0) + tAC (0−0) + 1 = 0
, так чтоtAB = −0.67
. Из вывода уравнений (4.3) и (4.4) видно, что единицы измерения Коэффициент натяжения — это сила на единицу длины, в данном случае кН / м. Однако, как правило, мы опускаем единицы измерения.
Теперь мы можем перейти к стыку B, в котором, поскольку было вычислено t BA (= t AB ), есть два неизвестных
(iii) xdirection: tBA (xA − xB) + tBC (xC − xB) + tBD (xD – xB) + 3 = 0
(iv) направление y: tBA (yA − yB) + tBC (yC − yB) + tBD (yD − yB) = 0
Подстановка значений совместных координат и t BA в уравнениях (iii) и (iv) мы имеем, из уравнения.(iii)-0,67 (0-0) + tBC (1,5-0) + tBD (1,5-0) + 3 = 0
, что упрощается до(v) 1,5tBC + 1,5tBD + 3 = 0
и из уравнения . (iv)-0,67 (0-1,5) + tBC (0-1,5) + tBD (1,5-1,5) = 0
, откудаtBC = + 0,67
Следовательно, из уравнения. (v)
tBD = −2,67
Теперь есть только две неизвестные стержневые силы в соединении D. Следовательно, в D
(vi) xdirection: tDB (xB − xD) + tDF (xF − xD) + tDC ( xC − xD) = 0
(vii) направление y: tDB (yB − yD) + tDF (yF − yD) + tDC (yC − yD) –5 = 0
Подстановка значений совместных координат и ранее рассчитанного значения т DB (= т BD ) в уравнениях (vi) и (vii) мы получаем из уравнения.(vi)
−2,67 (0−1,5) + tDF (3,0−1,5) + tDC (1,5−1,5) −5 = 0
, так чтоtDF = −2,67
и из уравнения. (vii)−2,67 (1,5−1,5) + tDF (1,5−1,5) + tDC (0−1,5) = 0
, откудаtDC = −3,33
Затем решение переходит к соединению C, чтобы получить t CF и т CE или к соединению F для определения т FC и т FE ; соединение F было бы предпочтительнее, поскольку в F встречается меньше элементов, чем в C. Наконец, оставшийся неизвестный коэффициент натяжения ( т EC или т EF ) находится с учетом равновесия соединения E.Тогда
tFC = + 2.67, tFE = −2.67, tEC = 0
, что читатель должен проверить.Силы в элементах фермы теперь рассчитываются путем умножения коэффициентов растяжения на длины элементов, т. Е.
TAB = tABLAB = −0,67 × 1,5 = −1,0 кН (сжатие) TAC = tACLAC = + 2,0 × 1,5 = + 3,0 кН (напряжение) TBC = tBCLBC
, в которомLBC = (xB − xC) 2+ (yB − yC) 2 = (0-1,5) 2+ (1,5-0) 2 = 2,12 м
Тогда
TBC = + 0,67 × 2,12 = + 1,42 кН (растяжение)
Обратите внимание, что при расчете длин элементов не имеет значения, в каком порядке координаты соединения появляются в скобках, поскольку скобки имеют квадратную форму.Также
TBD = tBDLBD = −2,67 × 1,5 = −4,0 кН (сжатие)
Аналогично
TDF = −4,0 кН (сжатие) TDC = −5,0 кН (сжатие) TFC = + 5,67 кН (растяжение) TFE = — 4,0 кН (сжатие) TEC = 0
Константа равновесия — вводная химия — 1-е канадское издание
Цели обучения
- Объясните важность константы равновесия.
- Постройте выражение константы равновесия для химической реакции.
В середине 1860-х годов норвежские ученые К.М. Гульдберг и П. Вааге отметили своеобразное соотношение между количествами реагентов и продуктов в равновесии. Независимо от того, с каким количеством реагентов они начали, определенное соотношение реагентов и продуктов достигалось при равновесии. Сегодня мы называем это наблюдение законом массового действия. Он связывает количества реагентов и продуктов в равновесии для химической реакции. Для общей химической реакции, протекающей в растворе,
aA + bB ⇄ cC + dD
константа равновесия, также известная как K экв , определяется следующим выражением:
, где [A] — молярная концентрация вещества A в состоянии равновесия и так далее.Коэффициенты a , b , c и d в химическом уравнении становятся показателями степени в выражении для K eq . K eq — характерное числовое значение для данной реакции при данной температуре; то есть каждая химическая реакция имеет свою характеристику K экв . Концентрация каждого реагента и продукта в химической реакции при равновесии составляет , относящихся к ; концентрации не могут быть случайными величинами, но они зависят друг от друга.В числителе выражения для K eq указаны концентрации каждого продукта (сколько бы продуктов ни было), а в знаменателе выражения для K eq указаны концентрации каждого реагента, что приводит к общему значению продуктов по сравнению с реагентами определение для K экв. .
Рассмотрим простой пример. Предположим, у нас есть это равновесие:
A ⇄ B
Есть один реагент, один продукт, и коэффициенты для каждого из них всего 1 (предполагается, не записано).Выражение K eq для этого равновесия равно
.(Понятны экспоненты 1 для каждой концентрации.) Предположим, что числовое значение K экв. для этой химической реакции равно 2,0. Если [B] = 4,0 M, то [A] должно быть равно 2,0 M, чтобы значение дроби равнялось 2,0:
.По соглашению, единицы понимаются как M и опускаются в выражении K eq . Предположим, [B] было 6.0 M. Чтобы значение K eq оставалось постоянным (в конце концов, оно называется константой равновесия ), тогда [A] должно быть 3,0 M в состоянии равновесия:
Если бы [A] было , а не , равным 3,0 М, реакция не была бы равновесной, и результирующая реакция происходила бы до тех пор, пока это соотношение не стало бы действительно 2,0. В этот момент реакция находится в равновесии, и любые чистые изменения прекратятся. (Напомним, однако, что прямая и обратная реакции не прекращаются, потому что химическое равновесие динамично.)
То же самое и с более сложными выражениями для K eq ; только математика усложняется. Вообще говоря, учитывая значение K eq и все концентрации, кроме одной, в состоянии равновесия, недостающую концентрацию можно вычислить.
Пример 2
При следующей реакции:
H 2 + I 2 ⇄ 2 HI
Если равновесие [HI] составляет 0,75 M, а равновесие [H 2 ] равно 0.20 M, каково равновесие [I 2 ], если K eq равно 0,40?
Решение
Начнем с написания выражения K eq . Используя подход к реагентам , выражение K eq выглядит следующим образом:
Обратите внимание, что [HI] возведено в квадрат из-за коэффициента 2 в сбалансированном химическом уравнении. Подставив для равновесия [H 2 ] и [HI] и для данного значения K экв. :
Чтобы найти [I 2 ], мы должны сделать некоторую алгебраическую перестановку: разделить 0.40 в обе части уравнения и умножьте обе части уравнения на [I 2 ]. Это приводит к [I 2 ] в числителе левой части и 0,40 в знаменателе правой части:
Solving,
[I 2 ] = 7,0 M
Единицей измерения концентрации является молярность. Это значение для [I 2 ] можно легко проверить, подставив 0,75, 0,20 и 7,0 в выражение для K eq и вычислив: вы должны получить 0.40, числовое значение K экв (и вы это делаете).
Проверьте себя
При следующей реакции:
H 2 + I 2 ⇄ 2 HI
Если равновесие [HI] составляет 0,060 M, а равновесие [I 2 ] равно 0,90 M, каково равновесие [H 2 ], если K eq равно 0,40?
Ответ
0,010 М
В некоторых типах задач равновесия для определения окончательного ответа необходимо проанализировать квадратные корни, кубические корни или даже более высокие корни.Убедитесь, что вы умеете выполнять такие операции на своем калькуляторе; если вы не знаете, обратитесь за помощью к своему инструктору.
Пример 3
Следующая реакция находится в равновесии:
N 2 + 3 H 2 ⇄ 2 NH 3
K eq при определенной температуре 13,7. Если равновесие [N 2 ] составляет 1,88 M, а равновесие [NH 3 ] составляет 6,62 M, что такое равновесие [H 2 ]?
Решение
Начнем с написания выражения K eq из вычисленного химического уравнения:
Подставляя известные равновесные концентрации и K экв , получается
Алгебраически переставляя и затем вычисляя числовое выражение, получаем
Чтобы найти [H 2 ], нам нужно извлечь кубический корень из уравнения.Выполняя эту операцию, получаем
[H 2 ] = 1,15 M
Вы должны убедиться, что это правильно, используя свой собственный калькулятор, чтобы убедиться, что вы знаете, как правильно делать кубический корень.
Проверьте себя
Следующая реакция находится в равновесии:
N 2 + 3 H 2 ⇄ 2 NH 3
K eq при определенной температуре 13,7. Если равновесие [N 2 ] равно 0.055 M и равновесие [H 2 ] составляет 1,62 M, что такое равновесие [NH 3 ]?
Ответ
1.79 M
K eq было определено ранее в терминах концентраций. Для газофазных реакций K eq также может быть определено в терминах парциальных давлений реагентов и продуктов, P i . Для газофазной реакции
aA (г) + bB (г) ⇄ cC (г) + dD (г)
Константа равновесия, основанная на давлении, K P , определяется следующим образом:
, где P A — парциальное давление вещества A при равновесии в атмосферах и т. Д.Как и в случае константы равновесия на основе концентрации, единицы измерения опускаются при подстановке в выражение для K P .
Пример 4
Что такое K P для этой реакции, учитывая равновесное парциальное давление 0,664 атм для NO 2 и 1,09 для N 2 O 4 ?
2 NO 2 (г) ⇄ N 2 O 4 (г)
Решение
Запишите выражение для этой реакции K P :
Затем подставьте равновесные парциальные давления в выражение и вычислите:
Проверьте себя
Что такое K P для этой реакции при равновесных парциальных давлениях 0.44 атм для H 2 , 0,22 атм для Cl 2 и 2,98 атм для HCl?
H 2 + Cl 2 ⇄ 2 HCl
Ответ
91,7
Существует простая связь между K экв. (на основе единиц концентрации) и K P (на основе единиц давления):
, где R — постоянная закона идеального газа (в единицах л · атм / моль · К), T — абсолютная температура, а Δ n — изменение количества молей газа в сбалансированном химическое уравнение, определяемое как n газ, prods — n газ, rcts .Обратите внимание, что это уравнение подразумевает, что если количество молей газа одинаково в реагентах и продуктах, K экв. = K P .
Пример 5
Что такое K P при 25 ° C для этой реакции, если K eq равно 4,2 × 10 −2 ?
N 2 (г) + 3 H 2 (г) ⇄ 2 NH 3 (г)
Решение
Прежде чем использовать соответствующее уравнение, нам нужно сделать две вещи: преобразовать температуру в градусы Кельвина и определить Δ n .Преобразовать температуру очень просто:
Т = 25 + 273 = 298 К
Чтобы определить изменение количества молей газа, возьмите количество молей газообразных продуктов и вычтите количество молей газообразных реагентов. 2 моль газа в качестве продукта и 4 моль газа в качестве реагента:
Δ n = 2 — 4 = −2 моль
Обратите внимание, что Δ n отрицательно. Теперь мы можем подставить в наше уравнение, используя R = 0,08205 л · атм / моль · K.Единицы измерения опущены для ясности:
К P = (4,2 × 10 −2 ) (0,08205) (298) −2
Solving,
К P = 7,0 × 10 −5
Проверьте себя
Что такое K P при 25 ° C для этой реакции, если K eq равно 98,3?
I 2 (г) ⇄ 2 I (г)
Ответ
2.40 × 10 3
Наконец, мы признаем, что во многих химических реакциях участвуют вещества в твердой или жидкой фазах. Например, конкретная химическая реакция представлена следующим образом:
2 NaHCO 3 (т) ⇄ Na 2 CO 3 (с) + CO 2 (г) + H 2 O ()
Это химическое уравнение включает все три фазы вещества. Этот вид равновесия называется гетерогенным равновесием, потому что присутствует более одной фазы.
Правило для гетерогенных равновесий выглядит следующим образом: Не включайте концентрации чистых твердых веществ и чистых жидкостей в выражения K eq . В выражения констант равновесия включаются только парциальные давления для газообразных веществ или концентрации в растворах. Таким образом, выражение константы равновесия для этой реакции будет просто
.KP = PCO 2
, потому что два твердых тела и одна жидкость не появятся в выражении.
Основные выводы
- Каждое химическое равновесие можно охарактеризовать константой равновесия, известной как K экв. .
- Выражения K eq и K P сформулированы как количества продуктов, деленные на количества реагентов; каждая величина (концентрация или давление) возводится в степень своего коэффициента в сбалансированном химическом уравнении.
- Твердые и жидкие вещества не фигурируют в выражении для константы равновесия.
Упражнения
Определите закон действия масс .
Что такое константа равновесия химической реакции? Как это устроено?
Запишите выражение K eq для каждой реакции.
a) H 2 + Cl 2 ⇄ 2 HCl
б) НЕТ + НЕТ 2 ⇄ N 2 O 3
4.Запишите выражение K eq для каждой реакции.
а) C 2 H 5 OH + NaI ⇄ C 2 H 5 I + NaOH
b) PCl 3 + Cl 2 ⇄ PCl 5
5. Напишите выражение K P для каждой реакции.
а) 2 H 2 (г) + O 2 (г) ⇄ 2 H 2 O (г)
б) 2 H 2 O 2 (г) ⇄ 2 H 2 O (г) + O 2 (г)
6.Запишите выражение K P для каждой реакции.
a) CH 4 (г) + 2 O 2 (г) ⇄ CO 2 (г) + 2 H 2 O (г)
б) CH 4 (г) + 4 Cl 2 (г) ⇄ CCl 4 (г) + 4 HCl (г)
7. Следующая реакция находится в равновесии:
PBr 3 + Br 2 ⇄ PBr 5
Равновесие [Br 2 ] и [PBr 5 ] равно 2.05 М и 0,55 М соответственно. Если K eq равно 1,65, каково равновесие [PBr 3 ]?
8. В равновесии находится следующая реакция:
CO + Cl 2 ⇄ CoCl 2
Равновесие [CO] и [Cl 2 ] составляет 0,088 М и 0,103 М соответственно. Если K eq равно 0,225, каково равновесие [COCl 2 ]?
9. Следующая реакция находится в равновесии:
CH 4 + 2 Cl 2 ⇄ CH 2 Cl 2 + 2 HCl
Если [CH 4 ] равно 0.250 M, [Cl 2 ] составляет 0,150 M, и [CH 2 Cl 2 ] составляет 0,175 M в равновесном состоянии, что такое [HCl] в равновесии, если K экв. равно 2,30?
10. В равновесии находится следующая реакция:
4 HBr + O 2 ⇄ 2 H 2 O + 2 Br 2
Если [HBr] равно 0,100 M, [O 2 ] равно 0,250 M, а [H 2 O] составляет 0,0500 M в равновесном состоянии, что будет [Br 2 ] в равновесии, если K экв. — это 0.770?
11. Напишите выражение K P для следующей газофазной реакции:
4 NO 2 (г) + O 2 (г) ⇄ 2 N 2 O 5 (г)
12. Напишите выражение K P для следующей газофазной реакции:
ClO (г) + O 3 (г) ⇄ ClO 2 (г) + O 2 (г)
13. Каково равновесное парциальное давление COBr 2 , если равновесные парциальные давления CO и Br 2 равны 0.666 атм и 0,235 атм, а K P для этого равновесия составляет 4,08?
CO (г) + Br 2 (г) ⇄ COBr 2 (г)
14. Каково равновесное парциальное давление O 3 , если равновесное парциальное давление O 2 составляет 0,0044 атм, а K P для этого равновесия составляет 0,00755?
3 O 2 (г) ⇄ 2 O 3 (г)
15. Вычислите K P для этой реакции при 298 K, если K eq = 1.76 × 10 −3 .
3 O 2 (г) ⇄ 2 O 3 (г)
16. Вычислите K P для этой реакции при 310 K, если K eq = 6,22 × 10 3 .
4 NO 2 (г) + O 2 (г) ⇄ 2 N 2 O 5 (г)
17. Вычислите K экв. для этой реакции, если K P = 5.205 × 10 −3 при 660 ° C.
CO (г) + F 2 (г) ⇄ COF 2 (г)
18. Вычислите K экв. для этой реакции, если K P = 78,3 при 100 ° C.
4 HCl (г) + O 2 (г) ⇄ 2 H 2 O (г) + 2 Cl 2 (г)
19. Напишите правильное выражение K eq для этой реакции.
NaOH (водн.) + HCl (водн.) ⇄ NaCl (водн.) + H 2 O ()
20.Напишите правильное выражение для этой реакции K eq .
AgNO 3 (водн.) + NaCl (водн.) ⇄ AgCl (т.) + NaNO 3 (водн.)
21. Напишите правильное выражение K P для этой реакции.
CaCO 3 (т) ⇄ CaO (т) + CO 2 (г)
22. Напишите правильное выражение K P для этой реакции.
C 2 H 2 (г) + 2 I 2 (с) ⇄ C 2 H 2 I 4 (г)
Ответы
1.
взаимосвязь между концентрациями реагентов и продуктов химической реакции при равновесии
3.
а)
б)
5.
а)б)
7.
0,163 М
9.
0,272 М
11.
13.
0,639 атм
15.
7,20 × 10 −5 17.
К экв = 3.98 × 10 −1 19.
21.
K P = P CO 2
Сбалансированные уравнения и константы равновесия
В сбалансированном химическом уравнении общее количество атомов каждого присутствующего элемента одинаково с обеих сторон уравнения. Стехиометрические коэффициенты — это коэффициенты, необходимые для уравновешивания химического уравнения. Они важны, потому что они соотносят количества используемых реагентов и образовавшихся продуктов. Коэффициенты относятся к константам равновесия , потому что они используются для их расчета. По этой причине важно понять, как сбалансировать уравнение, прежде чем использовать уравнение для расчета констант равновесия.
Введение
Есть несколько важных правил для балансировки уравнения:
- Уравнение можно сбалансировать, только настроив коэффициенты.
- Уравнение должно включать только реагенты и продукты, которые участвуют в реакции.
- Никогда не меняйте уравнение, чтобы сбалансировать его.
- Если элемент встречается только в одном соединении с каждой стороны уравнения, попробуйте сначала уравновесить этот элемент.
- Когда один элемент существует как свободный элемент, балансируйте этот элемент последним.
Пример \ (\ PageIndex {1} \):
\ [H_2 \; (ж) + O_2 \; (g) \ rightleftharpoons H_2O \; (l) \ nonumber \]
| Поскольку оба реагента находятся в элементарной форме, они могут быть сбалансированы в любом порядке.Рассмотрим в первую очередь кислород. Два атома слева и один справа. Умножить правую на 2 | \ [H_2 (g) + O_2 (g) \ rightleftharpoons 2H_2O (l) \ nonumber \] |
| Затем уравновесить водород. Справа 4 атома, а слева только 2 атома. Умножьте водород слева на 2 | .\ [2H_2 (g) + O_2 (g) \ rightleftharpoons 2H_2O (l) \ nonumber \] |
| Проверить стехиометрию.Водород: слева 2 x 2 = 4; справа 2 x 2 = 4. Кислород: слева: 1 x 2 = 2; справа 2 х 1 = 2. Все атомы уравновешены, поэтому уравнение правильно сбалансировано. | \ [2H_2 (g) + O_2 (g) \ rightleftharpoons 2H_2O (l) \ nonumber \] |
Пример \ (\ PageIndex {2} \):
\ [Al \; (s) + MnSO_4 \; (aq) \ rightleftharpoons Al_2 (SO_4) _3 + Mn; (s) \ nonumber \]
| Сначала рассмотрим ионы SO 4 2 —.Один находится в левой части уравнения, а три — в правой. Добавьте коэффициент три в левую часть. | \ [Al (s) + 3MnSO_4 (вод.) \ Правые левые гарпуны Al_2 (SO_4) _3 + Mn (s) \ nonumber \] |
| Затем проверьте атомы Mn. Один находится справа, но теперь их три слева от предыдущей настройки. Добавьте коэффициент три с правой стороны. | \ [Al (s) + 3MnSO_4 (вод.) \ Правые левые гарпуны Al_2 (SO_4) _3 + 3Mn (s) \ nonumber \] |
| Рассмотрим Al.Один атом находится слева, а два — справа. Слева прибавьте коэффициент два. Убедитесь, что на каждой стороне находится одинаковое количество атомов. | \ [2Al (s) + 3MnSO_4 (aq) \ rightleftharpoons Al_2 (SO_4) _3 + 3 Mn (s) \ nonumber \] |
Пример \ (\ PageIndex {3} \):
\ [P_4S_3 + KClO_3 \ rightleftharpoons P_2O_5 + KCl + SO_2 \ nonumber \]
| Эта проблема более сложная. Сначала посмотрите на атомы P.Их четыре на стороне реагента и два на стороне продукта. Добавьте коэффициент два к стороне продукта. | \ [P_4S_3 + KClO_3 \ rightleftharpoons 2P_2O_5 + KCl + SO_2 \ nonumber \] |
| Затем рассмотрим атомы серы. Их три слева и один справа. Добавьте коэффициент три в правую часть. | \ [P_4S_3 + KClO_3 \ rightleftharpoons 2P_2O_5 + KCl + 3SO_2 \ nonumber \] |
| Теперь посмотрим на атомы кислорода.Их три слева и 16 справа. Добавление коэффициента 16 к KClO 3 слева и KCl справа сохраняет равное количество атомов K и Cl, но увеличивает кислород. | \ [P_4S_3 + 16KClO_3 \ rightleftharpoons 2P_2O_5 + 16KCl + 3 SO_2 \ nonumber \] |
| Утроение трех других частиц (P 4 S 3 , P 2 O 5 и SO 2 ) уравновешивает остальные атомы. | \ [3P_4S_3 + 16 KClO_3 \ rightleftharpoons 2 (3) P_2O_5 + 16KCl + 3 (3) SO_2 \ nonumber \] |
| Упростите и проверьте. | \ [3P_4S_3 + 16KClO_3 \ rightleftharpoons 6P_2O_5 + 16KCl + 9SO_2 \ nonumber \] |
Химическое равновесие
Сбалансированные химические уравнения теперь могут быть применены к концепции химического равновесия, состояния, в котором реагенты и продукты не претерпевают чистых изменений с течением времени.б} \ nonumber \]
В числителе указаны активности продуктов, в знаменателе — активности реагентов. Для K c активности определяются как молярные концентрации реагентов и продуктов ([A], [B] и т. Д.). Строчные буквы — это стехиометрические коэффициенты, которые уравновешивают уравнение.
Важным аспектом этого уравнения является то, что чистые жидкости и твердые тела не учитываются. Это связано с тем, что их действия определены как одно целое, поэтому включение их в уравнение не имеет никакого значения.Это связано с тем, что чистые жидкости и твердые тела не влияют на физическое равновесие; независимо от того, сколько добавлено, система может растворяться только в той степени, в которой позволяет растворимость. Например, если после достижения равновесия в раствор добавляется больше сахара, лишний сахар не растворяется (при условии, что раствор не нагревается, что приведет к увеличению растворимости). Поскольку добавление большего количества не меняет равновесия, это не учитывается в выражении.
K относится к сбалансированной химической реакции
Следующие концепции применяются при корректировке K в ответ на изменения соответствующего сбалансированного уравнения:
- Когда уравнение перевернуто, значение K инвертируется.
- Когда коэффициенты в сбалансированном уравнении умножаются на общий коэффициент, константа равновесия возводится в степень соответствующего коэффициента.
- Когда коэффициенты в сбалансированном уравнении делятся на общий множитель, берется соответствующий корень из константы равновесия.
- При объединении отдельных уравнений их константы равновесия умножаются, чтобы получить константу равновесия для всей реакции.
Сбалансированное уравнение очень важно при использовании константы, потому что коэффициенты становятся степенями концентраций продуктов и реагентов.{\ Delta n} \ nonumber \]
где
\ [\ Delta n = (c + d) — (a + b) \ nonumber \]
Это изменение в молекулах газа. a, b, c и d — стехиометрические коэффициенты молекул газа, найденные в сбалансированном уравнении.
Ни K c , ни K p не имеют единиц измерения. Это связано с их формальными определениями с точки зрения деятельности. Их единицы отменяются в расчете, что предотвращает проблемы с единицами в дальнейших расчетах.
c
\ [PbI_2 \ rightleftharpoons Pb \; (водн) + I \; (водный) \ nonumber \]
Сначала сбалансируйте уравнение.2} {(0.5)} \ nonumber \]
\ [K_c = 0,024 \ nonumber \]
Примечание: Если бы уравнение не было сбалансировано при вычислении константы равновесия, концентрация I — не была бы возведена в квадрат. Это дало бы неверный ответ.
Для работы автоматического номера нужно добавить на страницу шаблон «AutoNum» (желательно в конце).
Пример \ (\ PageIndex {5} \)
\ [SO_2 \; (ж) + O_2 \; (g) \ rightleftharpoons SO_3 \; (g) \ nonumber \]
Сначала убедитесь, что уравнение сбалансировано.
| Убедитесь, что S одинаковы с обеих сторон. По одному с каждой стороны. Затем посмотрите на букву О. Четыре слева и три справа. Добавление коэффициента к O 2 слева неэффективно, так как S справа также необходимо увеличить. Вместо этого добавьте коэффициент к SO 2 слева и SO 3 справа. | \ [2SO_2 + O_2 \ rightleftharpoons 2SO_3 \ nonumber \] | |||||||
| Теперь уравнение сбалансировано.2 \ раз (0,45)} \) \ (К_п = 3,2 \) Авторы и авторство
15.3: Взаимосвязи, включающие константы равновесияЦели обучения
Связь стехиометрии и констант равновесияВажно помнить, что константа равновесия всегда связана с конкретным химическим уравнением, и если мы напишем уравнение в обратном порядке или умножим его коэффициенты на общий множитель, значение \ (K \) изменится. К счастью, правила очень простые:
Вот некоторые из возможностей реакции, включающей равновесие между газообразной водой и ее элементами:
Многие химические изменения можно рассматривать как сумму или разницу двух или более других реакций. {- 6.{+4.0} \) |
Комментарий :
Эта чистая реакция описывает растворение известняка кислотой; он отвечает за разрушающее действие кислотных дождей на здания и статуи. Это пример реакции, которая практически не имеет тенденции протекать сама по себе (маленький K 1 ), будучи «управляемой» второй реакцией, имеющей большую константу равновесия (K –2 ). С точки зрения принципа Ле-Шателье, первая реакция «тянется вправо» за счет удаления карбоната ионом водорода.{19} \)
Равновесия с участием газов
Для реакций, в которых участвуют вещества в растворе, концентрации, используемые в расчетах равновесия, обычно выражаются в моль / литр. Однако для газов концентрации обычно выражаются в терминах парциальных давлений, а не молярности, где стандартное состояние составляет 1 атм давления. Символ \ (K_p \) используется для обозначения констант равновесия, рассчитанных по парциальным давлениям. b} \ label {15.2} {P_ {N_2O_4}} \ label {15.3.2} \]
Как и K, \ (K_p \) является безразмерной величиной, потому что величина, которая фактически используется для расчета, является «эффективным давлением», отношением измеренного давления к стандартному состоянию в 1 бар (приблизительно 1 атм), которое производит безразмерную величину. «Эффективное давление» называется летучестью , так же как активность — это эффективная концентрация.
Поскольку парциальные давления обычно выражаются в атмосферах или мм рт. Ст., Молярная концентрация газа и его парциальное давление не имеют одинаковых числовых значений.{Δn} \ label {15.3.3}} \]
, где \ (K \) — константа равновесия, выраженная в единицах концентрации, а \ (Δn \) — разница между числом молей газообразных продуктов и газообразных реагентов (\ (n_p — n_r \)). Температура выражается как абсолютная температура в Кельвинах. Согласно уравнению 15.3.3, \ (K_p = K \), только если моли газообразных продуктов и газообразных реагентов одинаковы (т.е. \ (Δn = 0 \)). Для разложения \ (N_2O_4 \) требуется 2 моль газообразного продукта и 1 моль газообразного реагента, поэтому \ (Δn = 1 \).1 = K_cRT \ label {15.3.4} \]
Пример \ (\ PageIndex {4} \): процесс Хабера
Константа равновесия реакции азота и водорода с образованием аммиака составляет 0,118 при 745 К. Уравнение равновесия имеет следующий вид:
\ [N_ {2 (g)} + 3H_ {2 (g)} \ rightleftharpoons 2NH_ {3 (g)} \]
Что такое \ (K_p \) для этой реакции при той же температуре?
Дано : уравнение равновесия, константа равновесия и температура
Спросили : \ (К_п \)
Стратегия :
Используйте коэффициенты в сбалансированном химическом уравнении для вычисления \ (Δn \).3 \)
Объединение выражений констант равновесия
Химикам часто требуется знать константу равновесия для реакции, которая ранее не изучалась. В таких случаях желаемую реакцию часто можно записать как сумму других реакций, для которых известны константы равновесия. Константа равновесия для неизвестной реакции может быть затем рассчитана на основе табличных значений для других реакций.
Чтобы проиллюстрировать эту процедуру, давайте рассмотрим реакцию \ (N_2 \) с \ (O_2 \), чтобы дать \ (NO_2 \).Эта реакция является важным источником \ (NO_2 \), придающего городскому смогу его типичный коричневый цвет. Реакция обычно происходит в две отдельные стадии. В первой реакции (1) \ (N_2 \) реагирует с \ (O_2 \) при высоких температурах внутри двигателя внутреннего сгорания с образованием \ (NO \). Освободившийся \ (NO \) затем вступает в реакцию с дополнительным \ (O_2 \), давая \ (NO_2 \) (2). Также дана константа равновесия для каждой реакции при 100 ° C.
- \ (N_ {2 (g)} + O_ {2 (g)} \ rightleftharpoons 2NO _ {(g)} \; \; K_1 = 2.{−15} \ label {15.3.7} \]
Константа равновесия для реакции, которая является суммой двух или более реакций, равна произведению констант равновесия для отдельных реакций. Напротив, напомним, что согласно закону Гесса \ (ΔH \) для суммы двух или более реакций является суммой значений ΔH для отдельных реакций.
Чтобы определить \ (K \) для реакции, которая представляет собой сумму двух или более реакций, сложите реакции, но умножьте на константы равновесия.4 \)
Рассчитайте константу равновесия для следующей реакции при той же температуре.
- \ (CO _ {(g)} + 2H_2S _ {(g)} \ rightleftharpoons CS_ {2 (g)} + H_2O _ {(g)} + H_ {2 (g)} \; \; \; K_3 =? \)
Дано : два сбалансированных уравнения равновесия, значения \ (K \) и уравнение равновесия для всей реакции
Запрошено : константа равновесия для всей реакции
Стратегия :
Расположите уравнения так, чтобы их сумма давала общее уравнение.Если уравнение нужно было поменять местами, инвертируйте значение \ (K \) для этого уравнения. Вычислите \ (K \) для всего уравнения, умножив константы равновесия для отдельных уравнений.
Решение :
Ключом к решению этой проблемы является осознание того, что реакция 3 является суммой реакций 1 и 2:
\ [CO _ {(g)} + \ cancel {3H_ {2 (g)}} \ rightleftharpoons \ cancel {CH_ {4 (g)}} + H_2O _ {(g)} \]
\ [\ cancel {CH_ {4 (g)}} + 2H_2S _ {(g)} \ rightleftharpoons CS_ {2 (g)} + \ cancel {3H_ {2 (g)}} + H_ {2 (g)} \]
\ [CO _ {(g)} + 3H_ {2 (g)} \ rightleftharpoons CS_ {2 (g)} + H_2O _ {(g)} + H_ {2 (g)} \]
Значения для \ (K_1 \) и \ (K_2 \) даны, поэтому вычислить \ (K_3 \) несложно:
\ [K_3 = K_1K_2 = (9.3 \]
Упражнение \ (\ PageIndex {2} \)
На первом из двух этапов промышленного синтеза серной кислоты элементарная сера реагирует с кислородом с образованием диоксида серы. На втором этапе диоксид серы реагирует с дополнительным кислородом с образованием триоксида серы. Показана реакция для каждой стадии, а также значение соответствующей константы равновесия при 25 ° C. Рассчитайте константу равновесия для всей реакции при той же температуре.
- \ (\ frac {1} {8} S_ {8 (s)} + O_ {2 (g)} \ rightleftharpoons SO_ {2 (g)} \; \; \; K_1 = 4.{66} \)
Гетерогенные равновесия
Когда продукты и реагенты равновесной реакции образуют одну фазу, будь то газ или жидкость, система представляет собой гомогенное равновесие. В таких ситуациях концентрации реагентов и продуктов могут варьироваться в широком диапазоне. Напротив, система, в которой реагенты, продукты или и то, и другое находятся более чем в одной фазе, представляет собой гетерогенное равновесие, такое как реакция газа с твердым телом или жидкостью.
Поскольку молярные концентрации чистых жидкостей и твердых веществ обычно не сильно зависят от температуры, их концентрации рассматриваются как константы, что позволяет нам упростить выражения констант равновесия, которые включают чистые твердые вещества или жидкости.Эталонные состояния для чистых твердых веществ и жидкостей — это формы, стабильные при давлении 1 бар (приблизительно 1 атм), которым присвоена активность , равная 1 . (Напомним, что плотность воды и, следовательно, ее объем изменяется всего на несколько процентных пунктов между 0 ° C и 100 ° C.)
Рассмотрим следующую реакцию, которая используется при окончательном обжиге некоторых видов керамики для получения блестящей металлической глазури:
\ [CO_ {2 (g)} + C _ {(s)} \ rightleftharpoons 2CO _ {(g)} \ label {15.3.8} \]
Глазурь образуется, когда оксиды металлов восстанавливаются до металлов с помощью продукта — оксида углерода.2} {P_ {CO_2}} \ label {15.3.13} \]
Включение всех постоянных значений в \ (K ‘\) или \ (K_p \) позволяет нам сосредоточиться на веществах, концентрации которых изменяются во время реакции.
Хотя концентрации чистых жидкостей или твердых веществ не указаны явно в выражении константы равновесия, эти вещества должны присутствовать в реакционной смеси для установления химического равновесия. Какими бы ни были концентрации \ (CO \) и \ (CO_2 \), система, описанная в уравнении 15.3.7 достигнет химического равновесия только в том случае, если было добавлено стехиометрическое количество твердого углерода или избыточного твердого углерода, так что некоторое количество все еще присутствует, когда система достигнет равновесия. Как показано на рисунке \ (\ PageIndex {1} \), не имеет значения, присутствует ли твердый углерод — 1 г или 100 г; в любом случае состав газообразных компонентов системы будет одинаковым в состоянии равновесия.
Рисунок \ (\ PageIndex {1} \): Влияние количества твердого вещества на равновесие в неоднородной системе твердое тело – газ.В системе равновесный состав газовой фазы при заданной температуре, в данном случае 1000 K, является одинаковым независимо от того, присутствует ли небольшое количество твердого углерода (слева) или большое количество (справа).Пример \ (\ PageIndex {3} \)
Запишите каждое выражение для \ (K \), включая все константы, и \ (K_p \) для следующих равновесных реакций.
- \ (PCl_ {3 (l)} + Cl_ {2 (g)} \ rightleftharpoons PCl_ {5 (s)} \)
- \ (Fe_3O_ {4 (s)} + 4H_ {2 (g)} \ rightleftharpoons 3Fe _ {(s)} + 4H_2O _ {(g)} \)
Дано : сбалансированные уравнения равновесия
Запрошено : выражения для \ (K \) и \ (K_p \)
Стратегия :
Найдите \ (K \), записав каждое выражение константы равновесия как отношение концентраций продуктов и реагентов, каждое из которых возводится к своему коэффициенту в химическом уравнении.Затем выразите \ (K_p \) как отношение парциальных давлений продуктов и реагентов, каждое из которых также возводится к своему коэффициенту в химическом уравнении.
Решение
Эта реакция включает чистое твердое вещество (\ (PCl_5 \)) и чистую жидкость (\ (PCl_3 \)). Их концентрации не фигурируют в выражении константы равновесия, потому что они существенно не меняются. Итак
\ [K = \ dfrac {1} {[Cl_2]} \]
и
\ [K_p = \ dfrac {1} {P_ {Cl_2}} \]
Эта реакция содержит два чистых твердых вещества (\ (Fe_3O_4 \) и \ (Fe \)), которые не фигурируют в выражениях константы равновесия.6} \)
Для реакций, проводимых в растворе, концентрация растворителя не включается в выражение константы равновесия, даже если растворитель присутствует в сбалансированном химическом уравнении реакции. Концентрация растворителя также обычно намного больше, чем концентрация реагентов или продуктов (напомним, что чистая вода составляет около 55,5 М, а чистый этанол — около 17 М). Следовательно, концентрация растворителя практически постоянна во время химических реакций, и поэтому растворитель рассматривается как чистая жидкость.Выражение константы равновесия для реакции содержит только те частицы, концентрации которых могут значительно измениться во время реакции.
Примечание
Концентрации чистых твердых веществ, чистых жидкостей и растворителей не включаются в выражения констант равновесия, потому что они не меняются значительно во время реакций, когда их достаточно для достижения равновесия.
Резюме
- Закон действия масс описывает систему, находящуюся в равновесии с точки зрения концентраций продуктов и реагентов.{Δn} \]
Уравновешенная система, которая содержит продукты и реагенты в одной фазе, представляет собой гомогенное равновесие; система, в которой реагенты, продукты или и то, и другое находятся в более чем одной фазе, является гетерогенным равновесием. Для газов выражение константы равновесия может быть записано как отношение парциальных давлений продуктов к парциальным давлениям реагентов, каждое из которых возведено в степень, соответствующую его коэффициенту в химическом уравнении. Константа равновесия, рассчитанная по парциальным давлениям (\ (K_p \)), связана с \ (K \) постоянной идеального газа (\ (R \)), температурой (\ (T \)) и изменением количество молей газа во время реакции.Равновесная система, которая содержит продукты и реагенты в одной фазе, является гомогенным равновесием; система, в которой реагенты, продукты или и то, и другое находятся в более чем одной фазе, является гетерогенным равновесием. Когда реакцию можно выразить как сумму двух или более реакций, ее константа равновесия равна произведению констант равновесия для отдельных реакций.
Механическая карта — Анализ равновесия для твердого тела
Для твердого тела , находящегося в статическом равновесии, то есть недеформируемого тела, в котором силы не совпадают, сумма сил и моментов , действующих на тело, должна быть равна нулю.Добавление моментов (в отличие от частиц, где мы рассматривали только силы) добавляет еще один набор возможных уравнений равновесия, позволяя нам решать больше неизвестных по сравнению с проблемами частиц.
Моменты, как и силы, являются векторами. Это означает, что наше векторное уравнение необходимо разбить на скалярные компоненты, прежде чем мы сможем решить уравнения равновесия. В двумерной задаче тело может вращаться только по часовой стрелке или против часовой стрелки (что соответствует вращению вокруг оси z).Это означает, что твердое тело в двумерной задаче имеет три возможных уравнения равновесия; то есть сумма составляющих силы в направлениях x и y и моментов вокруг оси z. Сумма каждого из них будет равна нулю.
Для двумерной задачи мы разбиваем одно векторное уравнение силы на два уравнения скалярных компонентов.
| \ [\ sum \ vec {F} = 0 \] | |
| \ [\ sum F_x = 0 \] | \ [\ сумма F_y = 0 \] |
Уравнение вектора одного момента становится скалярным уравнением одного момента.
| \ [\ sum \ vec {M} = 0 \] |
| \ [\ sum M_z = 0 \] |
Если мы посмотрим на трехмерную задачу, мы увеличим количество возможных уравнений равновесия до шести. Существуют три уравнения равновесия для силы, в которых сумма компонентов в направлениях x, y и z должна быть равна нулю. Тело также может иметь моменты относительно каждой из трех осей. Второй набор из трех уравнений равновесия утверждает, что сумма составляющих момента вокруг осей x, y и z также должна быть равна нулю.
Разбиваем силы на три составляющих уравнения
| \ [\ sum \ vec {F} = 0 \] | ||
| \ [\ sum F_x = 0 \] | \ [\ сумма F_y = 0 \] | \ [\ sum F_z = 0 \] |
Разобьем моменты на три составляющих уравнения
| \ [\ sum \ vec {M} = 0 \] | ||
| \ [\ сумма M_x = 0 \] | \ [\ сумма M_y = 0 \] | \ [\ сумма M_z = 0 \] |
Нахождение уравнений равновесия:
Как и в случае с частицами, первым шагом в нахождении уравнений равновесия является построение диаграммы свободного тела анализируемого тела.На этой диаграмме должны быть показаны все векторы сил, действующих на тело. На схеме свободного тела укажите значения для любых известных величин, направлений и точек приложения векторов силы и укажите имена переменных для любых неизвестных (величин, направлений или расстояний).
Далее вам нужно будет выбрать оси x, y, z. Эти оси должны быть перпендикулярны друг другу, но они не обязательно должны быть горизонтальными или вертикальными. Если вы выберете оси координат, которые совпадают с некоторыми из ваших векторов силы, вы упростите последующий анализ.
После того, как вы выбрали оси, вам необходимо разбить все векторы сил на компоненты по направлениям x, y и z (см. Страницу векторов на странице Приложения 1 для получения более подробной информации об этом процессе). Ваше первое уравнение будет суммой величин компонентов в направлении x, равной нулю, второе уравнение будет суммой величин компонентов в направлении y, равных нулю, а третье (если вы есть трехмерная задача) будет сумма величин в направлении z, равная нулю.
Затем вам нужно будет составить уравнения момента. Для этого вам нужно будет выбрать точку, о которой вы будете рассказывать. Любая точка должна работать, но обычно лучше выбрать точку, которая уменьшит количество неизвестных в уравнении. Помните, что любой вектор силы, проходящий через данную точку, не будет оказывать никакого воздействия на эту точку. Чтобы записать уравнения моментов, просто просуммируйте моменты, действующие от каждой силы (добавляя чистые моменты, показанные на диаграмме) относительно данной точки и данной оси (x, y или z), и установите эту сумму равной нулю.Все моменты будут относиться к оси z для двумерных задач, хотя моменты могут быть около осей x, y и z для трехмерных задач.
Когда у вас есть уравнения равновесия, вы можете решать эти формулы для неизвестных. Количество неизвестных, которые вы сможете решить, снова будет числом или уравнениями, которые у вас есть.
Химическое равновесие — Веб-формулы
Определение: В химической реакции концентрация реагента и продуктов не показывает чистых изменений с течением времени, это называется химическим равновесием.Типы химического равновесия:
1. Гомогенное равновесие
Все реагенты и продукты находятся в одной фазе и не могут быть разделены
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
2. Неоднородное равновесие
Реагенты и продукты не находятся в однородной фазе и могут быть разделены.
NH 3 (г) + h3O (л) → NH 4 OH (л)
Критерии химического равновесия:
- Реакция должна происходить в закрытом сосуде
- Реакция должна быть обратимой
- Температура, давление и концентрация реагентов остаются постоянными.
Закон химического равновесия:
Измерение равновесной концентрации выражается как константа равновесия. В состоянии равновесия скорости прямого и обратного процессов идентичны, но константы скорости обычно различны. Чтобы определить константу равновесия, сначала рассмотрим простую обратимую реакцию при постоянной температуре.
A + B
→ C + DСогласно закону активной массы скорость химической реакции пропорциональна произведению концентрации в молях реагентов при данной температуре и давлении.
Скорость превращения A и B пропорциональна их концентрации и обозначается как r
1r 1 = k 1 × [A] × [B]
k
1 является константа, известная как константа скорости или коэффициент скорости, а квадратные скобки обозначают концентрации (моль / литр) веществ, заключенных в скобкиТочно так же скорость преобразования C и D, как показано ниже,
r
2 = k 2 × [C] × [D]В состоянии равновесия две константы скорости будут равны, r
1 = r 2 k 1 × [A] × [B] = k 2 × [C] × [D]
k 1 / k 2 = [C] × [D] / [A] × [B] = K eq
Keq — константа равновесия при данной температуре.
Keq = [C] × [D] / [A] × [B]
Это уравнение называется уравнением закона химического равновесия. В состоянии равновесия концентрация реагентов выражается в моль / литр, поэтому Keq = Kc, а если выражается как парциальное давление, то Keq = Kp.
Вычисления:
Пример 1: Два моля водорода реагируют с 2 молями йода с образованием 2 моль иодистого водорода в сосуде емкостью 10 л при температуре 700 К. Равновесие увеличивается до 60%, рассчитайте Kc.
H 2 (г) + I 2 (г) ↔ 2HI (г)
Причина:
| Концентрация реагентов | Концентрация продуктов | ||
| [H] | [I] | [HI] | |
| В начале | 2 моля | 2 моль | 0 моль |
| При 60% равновесии | 1.2 моль | 1,2 моль | 2,4 моль |
| Не используется | 0,8 моль | 0,8 моль | 2,4 моль |
| моль / л при равновесии | 0,8 / 10 моль / л | 0,8 / 10 моль / л | 2,4 / 10 моль / л |
Объем = 10 литров
В состоянии равновесия
Kc = [HI] 2 / [H] [I]
Кс = (0,24) 2 /0.08 × 0,08 = 9,0 моль / л
Пример 2: Значение Кс составляет 0,04 при 400 К для реакции, представленной ниже. Концентрация водорода составляет 0,6 моль / л, а йода — 0,8 моль / л. Рассчитайте концентрацию иодистого водорода.
H 2 (г) + I 2 (г) ↔ 2HI (г)
Причина:
Kc = 0,04 моль / л
[H] = 0,6 моль / л
[I] = 0,8 моль / л
K c = [HI] 2 / [H] [I]
0.04 = [HI] 2 / (0,6 × 0,8)
[HI] 2 = 0,04 × 0,6 × 0,8 = 0,0192
[HI] = (0,0192) 1/2 = 0,0138 моль / л
Пример 3: Определите концентрацию диоксида серы и триоксида серы в состоянии равновесия в сосуде емкостью 1 л при 400 К, взяв по одному моль каждого из них. Значение Kc составляет 25 для реакции, представленной ниже.
SO 2 (г) + NO 2 (г) ↔ SO 3 (г) + NO (г)
Причина:
| Концентрация реагентов | Концентрация продуктов | |||
| [SO 2 ] | [№ 2 ] | [SO 3 ] | [НЕТ] | |
| В начале | 1 моль | 1 моль | 1 моль | 1 моль |
| В состоянии равновесия | X родинок | X родинок | X родинок | X родинок |
| Не используется | 1-х родинок | 1-х родинок | 1+ X родинок | 1+ X моль |
| моль / л при равновесии (Объем = 1 литр) | 1-X моль / лит | 1-X моль / лит | 1+ X моль / лит | 1+ X моль / литр |
K c = [NO] [SO 3 ] / [SO 2 ] [NO 2 ]
25 = {(1 + X) (1 + X)} / {(1 — X) (1 — X)}
25 = (1 + X) 2 / (1 — X) 2
5 = (1 + X) / (1 — X)
5 — 5Х = 1 + Х
Х = 0.66 моль / л
[SO
3 ] = 1 + X = 1,66 моль / л[SO 2 ] = 1 — X = 0,33 моль / л
Пример 4: Рассчитайте Kp для реакции, в которой твердый сероводород аммония нагревали до температуры 400K, при которой общее давление внутри замкнутой системы составляло 0,16 атмосферы при равновесии.
NH 4 SH (s) ↔ NH 3 (g) + H 2 S (g)
Причина:
Допустим, мы рассматриваем P Nh4 = X атмосферу
В состоянии равновесия P h3S = P Nh4 = X атмосфера
P всего = P
h3S + P Nh40.16 = Х + Х
0,16 = 2X
X = 0,08 атмосферы
K
p = P h3S x P Nh4= 0,08 х 0,08
= 0,0064 атмосферы 2
Пример 5: 4 моля фосфора при нагревании дают 2 моля хлора при 300 К в контейнере на 500 мл. Рассчитайте Kc для приведенной ниже реакции.
PCl 5 (г) → PCl 3 (г) + Cl 2 (г)
Причина:
| Концентрация реагентов | Концентрация продуктов | ||
| [PCl 5 ] | [PCl 3 ] | [CL 2 ] | |
| В начале | 4 моль | 0 моль | 0 моль |
| При равновесии | 2 моль | 2 моль | 2 моль |
| Не используется | 2 моль | 2 моль | 2 моль |
| моль / л при равновесии (Объем = 500 мл) | 2/0. | ||