Уровень воды в колодце. Оптимальный показатель
Когда владельцы решают обустроить на своем участке колодец, они начинают производить расчеты, сколько им потребуется воды. Вопрос кажется простым. Но ответ на него можно получить только после произведения необходимых расчетов. Для этого нужны некоторые показатели:
Количество потребления
Этого показатель нужен для определения объема воды, который необходим семье. Как правило, на одного человека в сутки уходит примерно двести литров. Соответственно, это число умножается на количество людей, проживающих в доме. Если число проживающих-трое, то нужно шестьсот литров.
Затем необходимо прибавить расходы на стирку, уборку, форс-мажорные обстоятельства в виде гостей и т. п. И тогда становится ясно, что в сутки необходимо не меньше тысячи литров воды.
Уровень воды в колодце
Уровень воды-не постоянная величина. Она постоянно меняется в зависимости от времени года и количества осадков. Весной, например, вода доходит до отметки «максимум». Это связано с таянием снегов и нагреванием почвы. А сухим летом и морозной зимой уровень наоборот падает. И воды может не хватать.
Это связано с таянием снегов и нагреванием почвы. А сухим летом и морозной зимой уровень наоборот падает. И воды может не хватать.
Поэтому необходимо рассчитать необходимое количество воды. Чтобы не остаться без нее в жару летом или в мороз зимой.
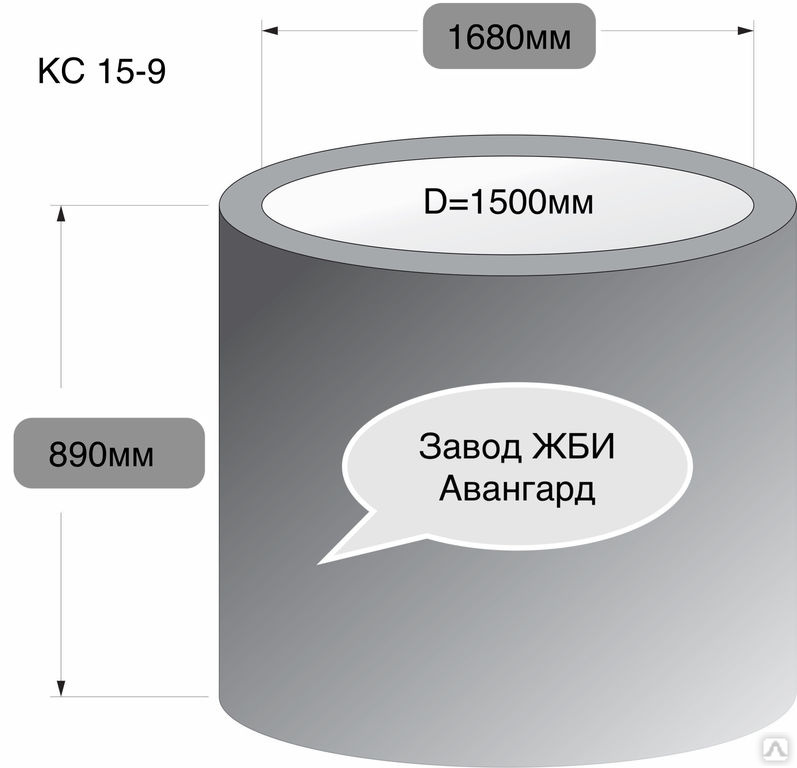
Объем воды в одном колодезном кольце
Когда речь идет о кольце «КС-10*9», имеющее стандартные размеры, то можно сказать, что оно вмещает 700 литров воды.
Теперь можно рассчитать уровень воды в колодце. Зачем это нужно? Ответ простой. Этот расчет нужен для выполнения надежной дезинфекции.
Микробы, живущие в колодце, необходимо периодически подавлять раствором марганцовки. Раствор марганцовки готовится и вносится, исходя из объема воды на данный момент.
Расчет объема воды в колодце из круглых колец
Для проведения правильного расчета необходимо вспомнить школьный курс математики. Это достаточно простые вычисления. Размер кольца в поперечнике делится на два. Так получается радиус. Его нужно умножить на величину 3,14. Затем полученное число умножить на высоту воды в шахте колодца.
Затем полученное число умножить на высоту воды в шахте колодца.
Если не получается замерить глубину, расчеты производятся при помощи известных единиц. Это количество колец, свободных от воды, общая глубина колодца и высота одного кольца, равная одному метру. Нужно отнять высоту не покрытых водой колец от общей глубины колодца. Так получается высота стояния воды.
Падение уровня воды в шахте колодца
Такая ситуация встречается достаточно часто. Когда уровень воды в колодце падает, лучше не предпринимать самостоятельных действий. Следует помнить, что чистка, ремонт или углубление колодца без специального оборудования, подготовки и присутствия напарника-опасное мероприятие.
Кроме этого, при неудачной попытке колодец может вообще обвалиться. Поэтому необходимо проконсультироваться со специалистами. Как правило, вода в колодце падает из-за поломок. А для их устранения нужно выполнить тщательную диагностику.
Наши мастера произведут обследование и диагностику колодца в любом районе Московской области. Если нужна только чистка колодца, то проблема будет устранена без промедления.
Если нужна только чистка колодца, то проблема будет устранена без промедления.
КОЛОДЕЦ НА УЧАСТКЕ — Загородный дом
Главная >> Загородный дом
См. также статью Обустройство колодца
Это странно — поселиться за городом, а колодца не иметь. Здесь никакие самые полные удобства оправданием служить не смогут. Никакой импортный фильтр, никакой водопровод не дадут вам истинно колодезной воды — с ее непревзойденной чистотой и вкусом. Да и утреннее обливание колодезной водой — в этом есть своя прелесть! Короче, в этом древнем сооружении столько пользы, что забыть его просто грешно. Дело за малым — приглядеть для колодца место и пригласить специалиста. А чтоб не чувствовать себя в общении с ними полным профаном — прочитать нижеследующие строки.
Колодцы можно разделить на два основных типа: шахтные и трубчатые. Первые больше подойдут для людей с поэтическим взглядом на жизнь. Для них причастность к традиции не пустой звук. Ворот (или редкий теперь «журавль»), массивная цепь, грохот летящего навстречу воде ведра — вся несложная процедура «добычи» воды вызовет у них поток романтических воспоминаний и приятных ассоциаций.
Для них причастность к традиции не пустой звук. Ворот (или редкий теперь «журавль»), массивная цепь, грохот летящего навстречу воде ведра — вся несложная процедура «добычи» воды вызовет у них поток романтических воспоминаний и приятных ассоциаций.
Люди более прозаические и практичные смогут обойтись артезианской скважиной, которую специалисты тоже почему-то относят к колодцам — трубчатым. Романтики в таком случае будет поменьше, но на качество воды это не повлияет.
Диаметр традиционного колодца от 0,8 до 1,2 метра, а трубчатого — 127-250 мм. В этих миллиметрах и кроется одно из главных преимуществ трубчатого колодца перед шахтным: его закрытость от внешнего мира и глубина в несколько десятков метров исключают даже минимальную возможность загрязнения источника. К тому же бурить скважины проще чисто технически, между тем как традиционные колодцы до сих пор роют вручную, с помощью обычной лопаты.
Однако имейте в виду: если грунт в вашем имении сыпучий, артезианская скважина просто невыгодна — придется пробурить несколько сотен метров.
Это не такое уж простое дело, как может показаться, особенно если вы собираетесь бурить скважину. Здесь ни одна уважающая себя фирма не возьмется заранее прогнозировать ни се глубину, ни точное место ее расположения. Для этого существует процедура обязательного разведочного бурения.
Но если при бурении скважины воду можно «достать» всегда, на какой бы глубине она ни залегала, то при сооружении традиционного колодца глубина залегания подъемных вод вещь изначально немаловажная. (Поэтому в этом вопросе лучше определиться заранее. Тем более что способов определить, есть ли здесь (или там) подземные воды и насколько они глубоки, предостаточно. Скажем, в старину бытовал такой способ: «На очищенной от дерна земле нужно разостлать овчину, обязательно шерстью наверх. Посредине овчины положить свежее куриное яйцо, прикрыв его новым глиняным горшком. Опыт начать с вечера при хорошей погоде и сухой почве. Утром приподнять горшок. Если овечья шерсть и яйцо покрыты росой, то это признак несомненный на этом месте источника, притом неглубокого.
А можно просто повнимательнее приглядеться к местности, и она вам сама подскажет, где можно найти неглубокие подземные источники.
Летом это места с зеленой и густой травой, появляющейся в пологих, неглубоких балках во время засухи в июне-августе, а также места, где можно наблюдать плотный туман или скопление в воздухе комаров и мошек после захода солнца; наконец, места, где растут влаголюбивые растения (камыш, осока и т. д.).
Осенью — места с ярко-зеленой растительностью, в то время как вокруг трава уже пожухла.
Зимой смело можете сооружать колодец там, где в снегу образуются проталины и наледи.
Не стоит делать колодец на берегах рек и там, где резко меняется рельеф местности. Здесь возможны значительные колебания уровня грунтовых вод, а следовательно, их загрязнения при подпитке.
P. S. Глупо рыть колодец вблизи источников загрязнения. Минимальное расстояние от выгребной ямы или автостоянки должно быть не менее 25 метров. Имейте в виду: всего один пролитый вблизи колодца литр бензина может испортить 400 тысяч литров воды.
В деревянном колодезном срубе вроде винной бочки вкус воды в той или иной степени зависит от породы дерева, из которой он сделан. Если сделать сруб из немореного дуба, то долгое время дубильные вещества будут придавать воде неприятный привкус и окрашивать ее в коричневый цвет. Сруб из непросушенной сосны придает воде смолистый вкус, а осиновый первое время — неприятный горьковатый привкус.
Больше всего для срубов годится лиственница. Она служит столько же, сколько и дуб (то есть 20-25 лет в надводной части, а в подводной и того больше), а противных привкусов не придает вовсе.
У колодезных колец из кирпича или бетона есть свои преимущества: во-первых, они в два-три раза долговечнее дубовых и сосновых, во-вторых, они абсолютно непроницаемы для грунтовых вод, а значит, при любых обстоятельствах у вас будет чистая и экологически безопасная вода.
Стоимость 1 м3 шахтного колодца доходит до $200, а скважины — от $25 до $40 за 1 погонный метр. Стоимость разведочного бурения — 30% от сметной стоимости заказа в целом.
Срок исполнения заказов: зимой — от двух до трех недель, летом — от одного до полутора месяцев. Разница в сезонных сроках объясняется только разным количеством желающих.
Традиционный колодец следует закрывать сверху плотной пыле- и водонепроницаемой крышкой, а воду брать одним и тем же ведром, которое должно храниться в закрытом колодце (впрочем, при желании ручной привод можно заменить электронасосом, но, согласитесь, это будет уже не колодец).
Чтобы возле колодца не крутились домашние животные, будет лучше, если вокруг него вы поставите ограждение.
А если возникнет необходимость осмотреть колодезное дно, делать это удобнее всего с помощью обычного фонарика. Кстати, обнаружив что-нибудь на дне колодца (вполне может быть, что вызвавший ваше подозрение предмет вполне безобиден, как, к примеру, детский песочный совок), не рискуйте и не пользуйтесь водой в пищевых целях до тех пор, пока не удалите его.
Но, прежде чем спуститься в колодец, если такая необходимость все-таки возникнет, проверьте его на загазованность.
Удобней всего это делать по старинке — с помощью зажженной свечи, укрепленной на проволоке. Если свеча, опущенная в шахту колодца, горит нормальным пламенем, значит, газа в нем нет. Если пламя изменяет форму (начинает, к примеру, гореть факелом), то газ имеется в каком-то количестве. Если свеча гаснет — газа в колодце много.
В прежние времена газ или застойный воздух удаляли из колодца так: брали большой пук соломы или травы, связывали его веревкой, опускали в шахту колодца и тут же вынимали.
А на будущее: чтобы совсем уж обезопасить себя от этой вполне возможной напасти, в колодец вставляют деревянную вентиляционную трубу с выводом наружу. Это, кстати, noможет избежать и застоя воздуха в колодце, что обязательно скажется на вкусе и запахе воды.
Если ваш колодец достаточно старый и не внушает доверия (к примеру, достался вам вместе с домом), его можно очистить — смести с колодезных стен грязь, траву, мох т. п. Это лучше делать метлой из березовых веток без листьев, закрепленных на шесте. Мусор обычно собирают сеткой и поднимают наверх, а воду, естественно, выбирают ведрами или откачивают насосом. Песок, гравий или щебень со дна колодца также можно поднять наверх, промыть и опустить обратно.
А после чистки старого колодца, чтобы он стал совсем новенький, будет хорошо провести его  Чтобы соблюсти эту меру, прежде всего нужно oпределить объем воды в колодце. Это делается так. Если колодец, к примеру, 1х1 м и глубина воды тоже 1 м, то в колодце 1 м3 воды. Это соответствует 1000 литров или 100 ведрам.
Чтобы соблюсти эту меру, прежде всего нужно oпределить объем воды в колодце. Это делается так. Если колодец, к примеру, 1х1 м и глубина воды тоже 1 м, то в колодце 1 м3 воды. Это соответствует 1000 литров или 100 ведрам.
После подобной процедуры колодезную воду какое-то время пить нельзя. Ее следует снова откачать, и не один, а несколько раз — до тех пор, пока не исчезнет запах хлорки.
А чтобы не попасть впросак, не стоит пользоваться услугами случайных мастеров. Случаи неудачного бурения скважин (как, впрочем, и колодцев) нередки. И дело не столько в том, что вы можете так и не дождаться вожделенной подземной влаги. Все может обернуться eще обиднее: вода появится из-под земли, а через нескс дней иссякнет. Так что, принимая работу, обязательно попросите прокачать скважину до полного просветт воды и понаблюдайте при этом, как она льется. Вода должна течь непрерывно и с хорошим напором. Впрочем, не стоит ограничиваться только подобной визуальной экспертизой.
Сколько кальцинированной соды нужно вводить, чтобы повысить ph воды из колодца?
Какое количество кальцинированной соды нужно ввести, чтобы повысить pH моей колодезной воды с 5,0 до 7,5?
Обычно требуется вводить от 100 до 200 мг кальцинированной соды на каждый литр воды (мг/л). Миллиграммы на литр — это то же самое, что и части на миллион (PPM).
Смешайте раствор кальцинированной соды
Кальцинированная сода представляет собой порошок, который смешивают с водой до образования насыщенного раствора. Вы можете сделать раствор сильнее или слабее. При температуре воды 50F легко поддерживать 10%-й раствор кальцинированной соды в воде, и именно с этого мы рекомендуем вам начать.
Вы можете сделать раствор сильнее или слабее. При температуре воды 50F легко поддерживать 10%-й раствор кальцинированной соды в воде, и именно с этого мы рекомендуем вам начать.
Чтобы приготовить 10% раствор, смешайте 4 фунта порошка кальцинированной соды на каждые 5 галлонов воды, что составляет приблизительно 10% раствор по весу. Для приготовления раствора лучше всего использовать теплую очищенную дистиллированную воду или воду обратного осмоса, хотя, если в вашей необработанной колодезной воде очень мало растворенных твердых веществ и других минералов, вы, как правило, можете использовать необработанную воду для приготовления раствора.
Начните с нескольких галлонов в баке с раствором и проверьте уровень pH, чтобы увидеть, как он работает.
Установка производительности насоса
Мы будем использовать насос Stenner в качестве примера, так как насос Stenner 85MHP-40 является хорошим насосом для бытового колодезного водоснабжения.
Установите «Диапазон скорости подачи» насоса Стеннера на 5 (это означает, что он настроен на подачу 50 % своей производительности).
Запустите воду и проверьте уровень pH, чтобы убедиться, что он находится на желаемом уровне в диапазоне pH от 7 до 8,0.
Если вы обнаружите, что pH в порядке, вам не нужно менять раствор или настройку насоса Стеннера. В противном случае, если pH все еще слишком низкий, вы можете сначала попробовать установить регулировочное кольцо насоса Стеннера на 10, что означает 100%.
Состав для определения размеров насоса Stenner
Для большинства бытовых применений кальцинированной соды при использовании Stenner 85MPh50 будет введено необходимое количество раствора кальцинированной соды для повышения pH до диапазона pH от 7,0 до 8,0. Насос Stenner 85MPh50 имеет максимальную производительность 40 галлонов раствора, перекачиваемого за 24 часа.
Для дозатора кальцинированной соды, как правило, необходимо вводить от 100 до 400 частей на миллион насыщенного раствора кальцинированной соды в воду, чтобы поднять рН до диапазона от 7,0 до 7,4.
Итак, например, предположим, что он был настроен на впрыскивание воды в вашу трубу перед напорным баком, и ваша скважинная вода текла со скоростью 15 галлонов в минуту.
Вы можете использовать 4 фунта порошка кальцинированной соды, растворенного в 5 галлонах воды. Вода весит 8,34 фунта, поэтому 5 галлонов воды весят 41,7 или около 42 фунтов. Это делает ваше решение 10-процентным раствором, что равнозначно 100 000 частей на миллион.
Допустим, у вас было 10 галлонов в минуту, и вы хотели ввести 150 частей на миллион кальцинированной соды.
150 частей на миллион X 10 галлонов в минуту X 1440 (минут в день) разделить на концентрацию раствора 100 000 = 22 галлона в день. Это означает, что вы будете закачивать 22 галлона раствора кальцинированной соды каждые 24 часа, когда скважинный насос фактически включается и откачивает воду.
ПРИМЕЧАНИЕ: ваш насос well , скорее всего, работает только от 30 минут до часа в день. Таким образом, если ваш насос well работает 1 час в день, вы будете использовать около 1 галлона раствора каждый день.
Таким образом, если дебит вашей скважины составляет 10 галлонов в минуту, вам понадобится насос-дозатор, который перекачивает 22 галлона за 24 часа или «22 галлона в день». Stenner 85MPh50 будет работать нормально, потому что вы можете установить шкалу скорости подачи на 55%. 22 разделить на 40 будет 55%.
Обратите внимание, что для вашей воды может не потребоваться 150 частей на миллион 10% раствора кальцинированной соды, может потребоваться только 50 частей на миллион, чтобы довести pH до диапазона 7,0–8,0, но вы сможете узнать это сразу после включения системы, проверив рН.
Конечная температура после помещения теплого металла в более холодную воду: Задачи 1
Конечная температура после помещения теплого металла в более холодную воду: Задачи 1 — 15Когда теплый металл помещают в более холодную воду, какой получается конечная температура?
Проблемы 1 — 15
Перейти к расчету конечной температуры при смешивании металла и воды
Перейти к расчету конечной температуры при смешивании двух проб воды
Назад в меню термохимии
Задача №1: Кусок медной трубки весом 610 г нагревают до 95,3 °C и помещают в изолированный сосуд, содержащий 45,0 г воды при 36,5 °C. Предполагая отсутствие потерь воды и теплоемкость сосуда 10,0 Дж/К, какова конечная температура системы (C стр. меди = 0,387 Дж/г-К)?
Предполагая отсутствие потерь воды и теплоемкость сосуда 10,0 Дж/К, какова конечная температура системы (C стр. меди = 0,387 Дж/г-К)?
Решение:
1) Эту проблему можно резюмировать следующим образом:
q потеряно медью = q получено водой + q получено калориметром
2) Поэтому:
(610, г) (95,3 °C − x) (0,387 Дж·г¯ 1 K¯ 1 ) = (45,0 г) (x − 36,5 °C) (4,184 Дж·г¯ 1 °C ¯ 1 ) + [(10,0 Дж/К) (х — 36,5 °С)]Комментарий: K и °C взаимоисключающие, потому что °C в этой задаче представляет собой разность температур (а не одно конкретное значение) и «размер» одного K = одному °C.
3) Разве алгебра не забавна?
22497,471 — 236,07х = 198,28х — 7237,22424,35х = 29734,691
х = 70,1 °С
Задача №2: Образец вещества массой 45,0 г при 55,0 °C (s = 1,66 кал/г °C) был помещен в калориметр в виде кофейной чашки (c = 4,20 кал/°C), который содержал 50,0 г этилового спирта при 25,0°С (s = 0,590 кал/г°С). Какова результирующая температура?
Какова результирующая температура?
Комментарий перед решением: обратите внимание, что в этой задаче используются калории, а не джоули. На технику решения это не влияет.
Решение:
1) Составьте следующее уравнение:
(масса вещества) (Δt вещества) (C p вещества) = (масса спирта) (Δt спирта) (C p спирта) + (константа калориметра) (Δt спирта)Существует неявное предположение, что спирт и калориметр начинаются при одной и той же температуре. Это очень надежное предположение.
2) Вставьте соответствующие значения:
(45,0 г) (55,0 − x) (1,66 кал/г °C) = (50,0 г) (x − 25,0) (0,590 кал/г °C) + (4,20 кал/°C) (x − 25,0)
3) Получается алгебра:
4108,5 — 74,7х = 29,5х — 737,5 + 4,2х — 105х = 45,7 °С
Задача №3: Кольцо из чистого золота и кольцо из чистого серебра имеют общую массу 17,0 г. Два кольца нагревают до 65,4°С и опускают в 12,4 мл воды при 22,3°С. Когда достигается равновесие, температура воды составляет 24,7 °С. Какова масса золотого кольца?
Когда достигается равновесие, температура воды составляет 24,7 °С. Какова масса золотого кольца?
Решение:
1) Составьте следующее уравнение:
(масса золота) (Δt золота) (С р золота) + (масса серебра) (Δt серебра) (С р серебра) = (масса воды) (Δt воды) (С р воды)
2) Вставьте соответствующие значения:
(х) (40,7 °С) (0,129 Дж г¯ 1 °С¯ 1 ) + (17,0 г − х) (40,7 °С) (0,237 Дж г¯ 1 °С¯ 1 ) = (12,4 г) (2,4 °С) (4,184 Дж г¯ 1 °С¯ 1 )
3) Алгебра:
х = 8,98 г
4) Комментарии:
а) Я посмотрел значения удельной теплоемкости золота и серебра в Интернете. Кстати, вы уже должны были запомнить удельную теплотворную способность жидкой воды.
б) Термины для масс золотых и серебряных колец исходят из того, что их сумма равна 17,0 г.Мы присваиваем «x» массе золотого кольца, поэтому масса серебряного кольца равна 17,0 минус x.
Задача №4: Образец алюминия массой 5,00 г (удельная теплоемкость = 0,89Дж г¯ 1 °С¯ 1 ) и образец железа массой 10,00 г (удельная теплоемкость = 0,45 Дж г¯ 1 °С¯ 1 ) нагревают до 100,0 °С. Затем смесь горячего железа и алюминия по каплям опускают в 91,9 г воды при 23,7°С. Рассчитайте конечную температуру смеси металла и воды, при условии отсутствия потерь тепла в окружающую среду.
Решение:
1) Настройте это:
q Al + q Fe = q вода(5,00 г) (100 °C − x) (0,89 Дж·г¯ 1 °C¯ 1 ) + (10,00 г) (100 °C − x) (0,45 Дж·г¯ 1 °C¯ 1 ) = (91,9 г) (x − 23,7 °C) (4,184 Дж г¯ 1 °C¯ 1 )
2) Проделаем алгебру (и отбросим все единицы):
(445 — 4,45x) + (450 — 4,5x) = 384,5096x — 9112,87752393,4596х = 10007,87752
х = 25,4 °С
Задача №5: Образец металлического железа массой 50,6 г нагревают и помещают в 104,0 г воды при 190,7 ° C в калориметре. Если конечная температура образца железа и воды равна 24,3 °С, какой была температура образца железа, когда его поместили в воду?
Если конечная температура образца железа и воды равна 24,3 °С, какой была температура образца железа, когда его поместили в воду?
Решение:
1) тепло, отдаваемое железом = тепло, получаемое водой:
(масса железа) (Δt железа) (C p железа) = (масса воды) (Δt воды) (C p воды)(50,6 г) (x — 24,3 °C) (0,450 Дж/г °C) = (104,0 г) (4,6 °C) (4,184 Дж/г °C)
4,6 получилось из 24,3 минус 19.7.
x − 24,3 °C – это Δt железа. Он перешел от высокой температуры «x» к более низкой температуре 24,3 ° C.
2) Найдите х:
(50,6x — 1229,58) (0,450) = 2001,625622,77х — 553,311 = 2001,6256
22,77х = 2554,9366
х = 112,2 °С
Задача № 6: Кусок медной трубки весом 505,0 г нагревают до 99,9 °C и помещают в изолированный сосуд, содержащий 59,8 г воды при 24,8 °C. Предполагая отсутствие потерь воды и теплоемкость сосуда 10,0 Дж/К, какова конечная температура системы? (С p меди = 0,387 Дж/г К)
Решение:
Решение не предоставлено.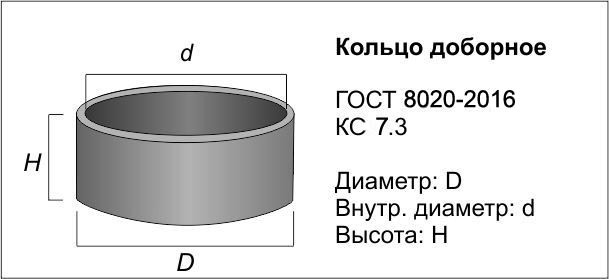
Обратите внимание, что K и °C отменяются в задаче. Это связано с тем, что (а) температуры в фактических расчетах представляют собой разницу между двумя значениями температуры и (б) «размер» 1 К равен «размеру» 1 ° C.
Задача № 7: Какой объем воды температурой 18,5°С нужно добавить вместе с куском железа массой 1,23 кг (C p = 0,449 Дж/г°С) при 68,5°С в изолированном сосуде , чтобы конечная температура смеси вода/металл оставалась постоянной и составляла 25,6 °C?
Решение:
тепло, отдаваемое металлом = тепло, получаемое водой(1230 г) (42,9 °С) (0,449 Дж/г °С) = (масса) (4,184 Дж/г °С) (7,1 °С)
масса = 797,562 грамма
округление до 3 цифр кажется разумным
798 мл
Задача №8: Латунный блок 2,00 x 10 2 г при 85,0 °C помещают в чашку из пенопласта, содержащую 2,00 x 10 2 г воды при 50,0 °C. Тепло не передается чашке или окружающей среде.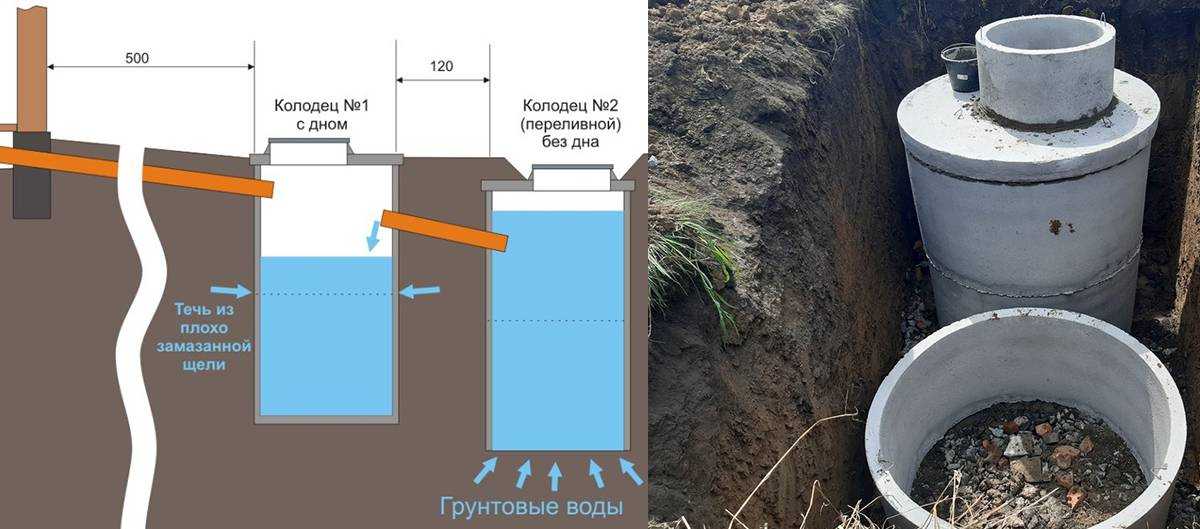 Найдите конечную температуру смеси.
Найдите конечную температуру смеси.
Решение:
Для решения этой проблемы требуется удельная теплоемкость латуни. Используйте этот сайт, чтобы найти значение.
Решение предоставляется читателю.
Задача №9: Для двух одинаковых блоков T f является средним значением начальных температур, так что T f = 1/2 (T 1 + T 2 ). Покажите для системы из двух блоков, полностью изолированных от окружающей среды, что это верно. (Подсказка: так как блоки сделаны из одного и того же материала, они будут иметь одинаковую C стр .)
Решение:
Я буду использовать T 1 для начальной температуры теплого блока и T 2 для начальной температуры холодного блока.тепла, потерянного теплым блоком = количество тепла, полученного холодным блоком
(масса) (ΔT теплая ) (C p ) = (масса) (ΔT холодная ) (C p )
для одинаковых блоков, масса = масса и C p = C p ; поэтому:
ΔТ warm = ΔT cold
T 1 − T f = T f − T 2
2T f = T 1 + T 2
T f = 1/2 (Т 1 + Т 2 )
Задача №10: 50,0 г меди при 200,0 °C помещают в лед при 0,0 °C. Сколько граммов льда растает?
Сколько граммов льда растает?
Решение:
1) Температура меди понизится до нуля по Цельсию, выделив определенное количество тепла:
(50,0 г) (200,0 °С) (0,385 Дж/г °С) = 3850 Дж
2) Все тепло от меди плавит лед:
(334,16 Дж/г) (х) = 3850 Джx = 11,5 г (до трех знаков фиг.)
Задача №11: Предположим, что 0,82 г воды конденсируется на 75,0-граммовом железном блоке, который изначально имеет температуру 24,0 °C.? Если выделяющееся при конденсации тепло идет только на нагрев железного бруска, то какова конечная температура (в °С) железного бруска?
Решение:
(0,82 г / 18,01532 г/моль) (40,7 кДж/моль) = 1,8525673 кДж = 1852,5673 Дж теряется с водойЧтобы продолжить расчет, нужно знать удельную теплоемкость железа. В этом источнике указано 0,444 Дж/г °C.
1852,5673 Дж = (75,0 г) (x) (0,444 Дж/г °C)
x = 55,6 °C изменение
24,0 °С + 55,6 °С = 79,6 °С
Задача №12: 400,0 г железа нагревают в пламени, а затем бросают в химический стакан, содержащий 1,00 кг воды. Исходная температура воды была 20,0 °С, а конечная температура воды и железа после достижения теплового равновесия составила 32,8 °С. Какова была первоначальная температура раскаленного железного стержня? (Предположим, что тепло не передается стакану или окружающему воздуху.)
Исходная температура воды была 20,0 °С, а конечная температура воды и железа после достижения теплового равновесия составила 32,8 °С. Какова была первоначальная температура раскаленного железного стержня? (Предположим, что тепло не передается стакану или окружающему воздуху.)
Решение:
q железо = q вода(400,0 г) (x − 32,8 °C) (0,444 Дж/г °C) = (1000 г) (12,8 °C) (4,184 Дж/г °C)
177,6х — 5825,28 = 53555,2
х = 334,35 °С
Инжир до трех знаков, 334 °C
Задача № 13: Металлический образец массой 30,66 г имеет температуру 81,0 °C, когда его помещают в чашку из пенопласта, содержащую 40,0 г воды при 23,0 °C. Температура воды повысилась до 25,0 °С. Теплоемкость чашки 42 Дж/°С.
а) Сколько джоулей потерял металл в воде?
(б) Какова удельная теплоемкость металла?
(c) Какова атомная масса металла?
(d) Что это за металл?
Решение:
q = [(40,0 г) (2,0 °C) (4,184 Дж/г °C)] + [(42 Дж/°C) (2,0 °C)] = 418,72 Дж (ответ на вопрос а)418,72 Дж = (30,66 г) (56,0 °С) (х)
х = 0,244 Дж/г°С) (ответ на б)
Используйте закон Дюлонга-Пти для атомной массы:
(удельная теплоемкость) умножить на (атомную массу) = 3R
(0,244 Дж/г°С) (x) = (3) (8,31447 Дж/К моль)
х = 102,2 г/моль (ответ на вопрос в)
Примечание: °C и K взаимно исключаются, потому что «размер» каждой единицы измерения температуры одинаков, 1 °C = 1 K.
родий ближе всего с 102,9 г/моль (ответ на d)
Поиск удельной теплоемкости для Rh, я нашел 0,242 Дж/г C.
Задача №14: Неочищенный образец цинка имеет массу 7,35 г. Образец реагирует со 150,00 г разбавленной соляной кислоты внутри калориметра. Масса калориметра 520,57 г, удельная теплоемкость 0,400 Дж/г°С. При протекании реакции температура внутри калориметра повышается с 14,5°С до 29°С.0,7 °С. Какова процентная чистота образца цинка?
Комментарий: мы предполагаем, что плотность раствора HCl составляет 1,00 г/мл, а удельная теплоемкость раствора HCl такая же, как у чистой воды.
Решение:
1) Суммарная энергия, выделяемая при реакции цинка с HCl:
q = (масса воды) (Δt) (C p вода) + (масса калориметра) (Δt) (C p калориметр)q = (150,0 г) (15,2 °С) (4,184 Дж/г °С) + (370,57 г) (15,2 °С) (0,400 Дж/(г °С))
q = 9539,52 + 2253,0656 = 11792,5856 Дж
Примечание: 370,57 получается из 520,57 минус 150,00
2) Теперь нам нужно посмотреть, сколько цинка выделяет вышеуказанное количество тепла. Для этого нам понадобится энтальпия этой реакции:
Для этого нам понадобится энтальпия этой реакции:
Zn(т) + 2HCl(водн.) —> ZnCl 2 (водн.) + H 2 (г)Поиск в Интернете (см. задачу 5.66) приводит к значению -152,4 кДж на моль Zn.
Этот расчет:
11792,5856 Дж разделить на 152400 Дж/моль = 0,07738 моль Zn
Тогда этот расчет:
0,07738 моль умножить на 65,409 г/моль = 5,06 г
3) Определите процентное содержание цинка в образце:
(5,06 г / 7,35 г) умножить на 100 = 68,8% (до трех цифр)
Задача № 15: Кусок железа весом 25,75 г и кусок золота весом 28,45 г, каждый при температуре 100,0 °C, были брошены в 570,0 мл воды при температуре 17,70 °C. Молярная теплоемкость железа и золота равна 25,19 Дж моль¯ 1 °С¯ 1 и 25,41 Дж моль¯ 1 °С¯ 1 соответственно. Какова конечная температура воды и кусков металла?
Решение:
1) Настройка для проблемы:
общее количество джоулей, выделяемых железом + общее количество джоулей, выделяемых золотом = общее количество джоулей, поглощаемых водой(25,75 г / 55,845 г/моль) (100,0 − x) (25,19 Дж/моль °C) + (28,45 г / 196,97 г/моль) (100,0 − x) (25,41 Дж/моль °C) = (570,00 г ) (х — 17,70) (4,184 Дж/г °С)
Найдите x, то есть конечную температуру.
2) Вот что означают некоторые термины:
(25,75 г / 55,845 г/моль) —> моль Fe(28,45 г / 196,97 г/моль) —> моль золота
(100,0 − x) —> изменение температуры Fe и Au (каждая из них начинается со 100 °C и снижается до конечной температуры, обозначенной буквой «x»)
(x − 17,70) —> изменение температуры воды
Обратите внимание, что удельная теплоемкость воды измеряется в граммах, а Fe и Au — в молях. Это нормально, поскольку я использую моли Fe и Au (чтобы компенсировать моль в удельной теплоемкости Fe и Au) и использую граммы воды (чтобы компенсировать граммы в удельной теплоемкости воды). Каждая единица будет отменена должным образом.
Задача №16: Рассчитайте количество граммов льда, которое растает, если 1000,0 г железа при температуре 500,0 °C бросить в смесь льда и воды. Теплота плавления воды 334,166 Дж/г. Удельная теплоемкость железа = 0,448 Дж/г°С. Предположим, что льда достаточно, чтобы некоторое его количество осталось после достижения теплового равновесия.
Решение:
Последнее предложение имеет решающее значение, поскольку оно гарантирует, что температура не изменится, только лед растает, а вся система останется при нуле по Цельсию.
1) Определить энергию, выделяемую железом:
q = (масса) (изменение температуры) удельная теплоемкость)q = (1000,0 г) (500,0 °C) (0,448 Дж/г °C)
q = 224000 Дж
Тот факт, что некоторое количество льда осталось, позволяет нам точно знать, что температура железа упадет с 500,0 °C до 0 °C.
2) Определите лед, который растает:
224000 Дж разделить на 334,166 Дж/г = 670,3 г
3) Эту проблему можно было бы решить так:
(1000,0 г) (500,0 °C) (0,448 Дж/г °C) = x / 334,166 Дж/гЗдесь предполагается, что 100% энергии, теряемой железом, идет на таяние льда.
Задача №17: 18,0 мл воды при 28,0 °C добавляют в горячую сковороду. Вся вода превращается в пар при температуре 100,0 °C. Масса кастрюли 1,25 кг, молярная теплоемкость железа 25,19 Дж/моль °С. Как меняется температура сковороды?
Масса кастрюли 1,25 кг, молярная теплоемкость железа 25,19 Дж/моль °С. Как меняется температура сковороды?
Решение:
1) Определить потребность в энергии для нагрева и кипячения воды:
тепло: q = (18,0 г) (72,0 °C) (4,184 Дж/г °C) = 5422,464 Дж = 5,422464 кДжварить: q = (40,7 кДж/моль) (18,0 г / 18,0 г/моль) = 40,7 кДж
всего: 40,7 кДж + 5,422464 кДж = 46,122464 кДж
Не буду округлять до окончательного ответа.
2) Определить изменение температуры сковороды:
46122,464 Дж = (22,38338 моль) (Δt) (25,19 Дж/моль °C)Δt = 81,8 °С
Обратите внимание, что используются моли железа, а не граммы. Это связано с единицами измерения удельной теплоемкости, предусмотренными в задаче.
Задача №18: Медный шарик имеет массу 125 граммов и находится при температуре 145 °C. Этот шарик помещают в калориметр, содержащий 25,0 граммов льда при температуре -35,0 °C. Какой будет конечная температура медного шарика? (удельная теплоемкость меди = 0,387 Дж/г °C)
Какой будет конечная температура медного шарика? (удельная теплоемкость меди = 0,387 Дж/г °C)
Решение:
Медный шар отдает тепло льду. Весь лед сначала нагреется до 0°С, а затем начнет таять. Когда лед тает, создается система жидкий лед, температура которой остается равной 0 °C. Если медь расплавит весь лёд, то только тогда жидкая вода перейдёт от нуля °С до некоторой конечной, равновесной с медью температуры.
1) Давайте нагреем лед с −35 °C до 0 °C и посмотрим, сколько энергии на это потребуется.
q = (25 г) (35 °C) (2,06 Дж/г °C) q = 1802,5 Дж
2) Посмотрим, что произойдет с температурой меди при удалении 1802,5 Дж.
1802,5 Дж = (125 г) (x) (0,387 Дж/г°C)х = 37,26 °С
145 — 37,26 = 107,74 °С
3) Теперь давайте охладим медный шарик до нуля и посмотрим, сколько энергии при этом высвободится.
q = (125) (107,74) (0,387) = 5211,9225 Дж4) Далее нам нужно выяснить, сколько льда растаяло, используя 5211,9225 Дж энергии.
5211,9225 Дж = (х) (6020 Дж/моль) х = 0,86577 моль0,86577 моль умножить на 18,015 г/моль = 15,6 г
Поскольку изначально у нас было 25 г льда, при таянии 15,6 г льда в системе остается некоторое количество льда. Поскольку весь лед должен растаять, прежде чем мы сможем уйти от 0 °C, мы заключаем, что вся система жидкий лед-медь находится при 0 °C, когда достигается равновесие.
Задача №19: Медный кубик массой 100 грамм нагревают на кипящей водяной бане до 100,0 по Цельсию. Куб вынимают из ванны и помещают на очень большой кусок льда, температура которого равна 0,00 по Цельсию. Какова максимальная масса льда, который можно растопить в результате теплообмена, если предположить, что вся тепловая энергия расходуется на таяние льда?
Решение:
1) Определим, сколько энергии выделила медь при плавлении льда:
q = (масса) (Δt) (удельная теплоемкость)q = (100,0 г) (100,0 °C) (0,385 Дж/г °C)
q = 3850 Дж
2) Теперь определяем, сколько льда можно растопить:
q = (масса) (теплота плавления)3850 Дж = (334,166 Дж/г) (х)
х = 17,25 г
инжир до трех знаков, 17,2 г (с использованием правила округления до пяти)
3) Комментарии:
(а) удельную теплоемкость меди можно посмотреть в учебнике или в Интернете.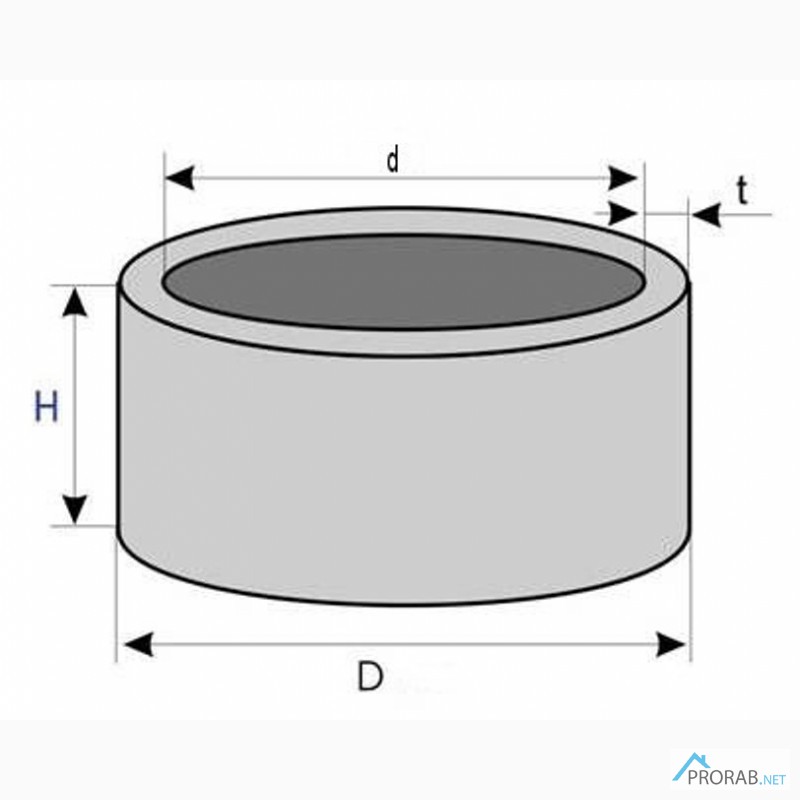
(b) теплоту плавления можно посмотреть (или рассчитать по молярной теплоте плавления, 6,02 кДж/моль)Задача № 20: Кусок алюминия массой 12,0 г при температуре 22,0 °C помещают в 175,0 мл воды при температуре 85,0 °C и дают ему прийти к тепловому равновесию. Какой будет конечная температура? (Другие факторы, такие как передача тепла воздуху, следует игнорировать.) Удельная теплоемкость алюминия составляет 0,215 кал / г ° C.
Решение:
1) Прежде чем приступить к решению, можете ли вы найти ошибку в этом предложенном решении (и дело не в том, что ни на чем нет единиц)?
(175,0) (4,184) (85,0 — Т) = (12) (0,215) (Т — 22,0)Ошибка в неправильном смешивании юнитов. 4,184 – удельная теплоемкость жидкой воды в Дж г¯ 1 °С¯ 1 и 0,215 – удельная теплоемкость алюминия в кал г¯ 1 °С¯ 1 .
Вы не можете использовать эти две единицы теплоты в одной и той же задаче и быть правы.