Химические реакции: типы, свойства, уравнения

Содержание:
Характеристика химических реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Химические реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.

Типы химических реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Химическая реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа — Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Химическая реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Химическая реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Fe+CuSO4→ FeSO4+Cu
Химическая реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
NaOH+HCl→ NaCl+Н2О
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки химических реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак химической реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость химической реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие химической реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения химических реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Химические реакции, видео
И в завершение интересно видео про самые удивительные химические реакции.
Эта статья доступна на английском языке — Chemical Reactions.
www.poznavayka.org
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях

Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
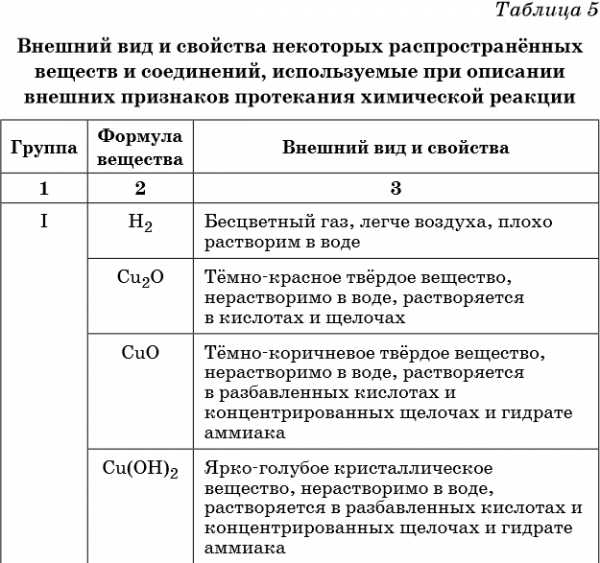
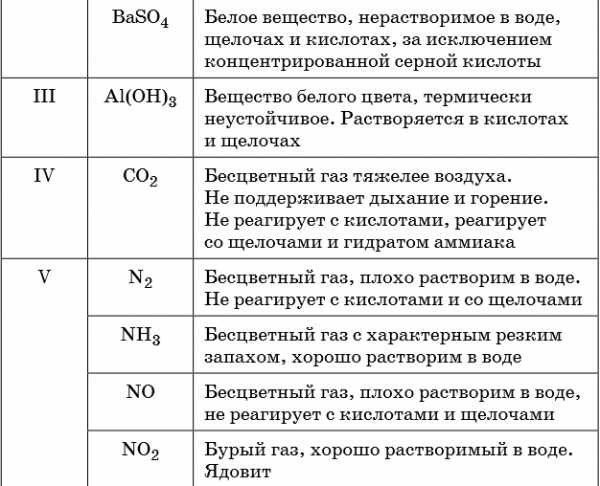
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.



Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) Cu(NO3)2 и Na2S
В) Cu(NO3)2 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) HCl и Al(OH)3
В) AgNO3 и KI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и H3PO4
Б) Zn(OH)2 и HCl
В) MnO2 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2CrO4 и H2SO4
Б) Cu(OH)2 и HCl
В) HCl и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaCl
Б) NaI и AgNO3
В) CuCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2S и H2SO4
Б) Fe(OH)2 и HCl
В) FeSO4 и Ba(NO3)2
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и KOH
Б) K2CO3 и BaCl2
В) Na2CO3 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CaCl2 и AgNO3
Б) CuCl2 и Ba(OH)2
В) FeCl3 и Ba(OH)2
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Al(NO3)3 и NaOH
Б) K2CO3 и HNO3
В) HBr и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и h3SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NH4Cl
Б) NH4Cl и Ca(OH)2
В) CuSO4 и KOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Fe(NO3)2 и NaOH
Б) KOH и CuCl2
В) ZnCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и H2SO4(конц.)
Б) NaOH и NH4Cl
В) Na2CO3 и HI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CuSO4 и BaCl2
Б) CuSO4 и NaOH
В) FeSO4 и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) FeCl3 и AgNO3
Б) CaCl2 и Na2CO3
В) KOH и H3PO4
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) H2SO4 и Na2SO3
Б) HCl и Na2CO3
В) Cr(OH)3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) HNO3 и K2SiO3
Б) H2SO4 и BaCl2
В) Cu и H2SO4
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) BaI2 и AgNO3
Б) Ag и HNO3 (конц.)
В) Ag и H2SO4 (конц.)
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Ответы
Приложение

himi4ka.ru
Реакция определение — Справочник химика 21
Скорость диффузии можно представить в виде условия, когда время реакции, определенное по уравнению (19), намного больше 8 10. Поэтому условием реакции в пленке следует пренебречь. Сравнение уравнений (5) и (29) показывает, что величина ЬЧО равна времени диффузии, если б и вычислены по значениям коэффициента физической абсорбции. [c.27]Цепные реакции. Определение промежуточных продуктов [c.94]
Реакция определения никеля (И) диметилглиоксимом (ОНг) в щелочной среде в присутствии окислителей получила большое распространение. В результате реакции образуется соединение, растворы которого окрашены в бурый цвет (отношение N1 [)Нг = = 1 3). Максимальное поглощение наблюдается при >, = 470 нм-, значение е= 13 000. В качестве окислителя используют раствор иода. Никель может быть определен указанной реакцией в сталях в присутствии ванадия, молибдена. Вольфрам, хром и титан могут присутствовать до 18%. Мешают медь, кобальт и все элементы, ионы которых дают осадки гидроокисей в щелочной среде. Это первый недостаток метода, второй — малая чувствительность. [c.493]
Рассматривая теоретически обоснованные методы предвидения скоростей химических реакций, следует отметить, что применение в этих целях теории активного комплекса ограничивается в настоящее время простыми реакциями. Она дополняет теорию столкновений, которая дает возможность выяснить ход некоторых реакций между линейными молекулами в жидкой и газовой фазах. Однако во многих случаях скорость реакции, определенная с использованием теории столкновений, слишком велика. Объяснить же ход мономолекулярных реакций, например изомеризации н-бутана или разложения ацетальдегида, по теории столкновений невозможно. При интерпретации хода таких реакций с применением теории активного комплекса предполагается, что механизм активации основан на столкновении молекул и в дальнейшем реакция проходит в два этапа (образование активного комплекса и его распад или перегруппировка), характеризующихся разными скоростями.
Когда пленка продукта отсутствует и размер зерен изменяется в ходе реакции, определение сопротивления превращению упрощается. Поскольку поверхность реакции и поверхность, к которой диффундирует компонент А через газовую ламинарную пленку, [c.269]
Порядок величин числовых значений факторов частоты для типичных реакций определен по уравнению (см. также табл. 4) [c.45]
Изучение изменений внутренней энергии прн химических превращениях имеет большое значение для развития теоретических основ химии, так как является одним из основных путей для изучения энергии отдельных химических связей в молекуле и количественного познания прочности этих связей и реакционной способности молекул. Кроме того, изменения внутренней энергии при реакции (или теплота реакции) являются необходимыми исходными величинами для термодинамических расчетов химических реакций (определение константы равновесия, выход продуктов реакции), имеющих большое значение для химических исследований и в химико-технологической практике. [c.56]
Аддитивность э.д.с. схематически иллюстрируется рис. 19-10. В гл. 16 было объяснено, что нет необходимости табулировать изменение свободной энергии для каждой возможной реакции. Если имеются табулированные изменения свободной энергии для реакций определенного вида, а именно для реакций образования всех соединений из элементов в их стандартных состояниях, можно вычислить изменение свободной энергии для любой реакции, включающей эти соединения, основываясь на свойстве аддитивности свободных энергий. Точно так же нет необходимости табулировать напряжение любого мыслимого элемента или каждой мыслимой комбинации анодной и катодной реакций. Вместо этого достаточно иметь таблицы напряжений электрохимических элементов, в которых все электродные реакции скомбинированы с одним стандартным электродом. Это равнозначно выбору произвольного начала отсчета на рис. 19-10. Любую реакцию в электрохимическом элементе можно представить в виде двух полуреакций, одна из которых протекает на аноде, а другая на катоде.
Этап 4. Изучение адсорбционных процессов, сопровождающих химические реакции (определение моделей пористой структуры и кинетики адсорбции работа на экспериментальном оборудовании). [c.19]
Расшифровки кинетических схем сложных химических реакций, определение их структуры и значений кинетических констант являются сложными задачами, объединяемыми термином обратные задачи химической кинетики . Изложение методов решения этих задач, выходящее за рамки настоящей книги, освещено в работах [4, 15-191. [c.78]
Величина в общем случае представляет собой наблюдаемый порядок реакции, определение которого позволяет выбрать [c.167]
При расчете реакторов для систем газ — твердое вещество (частицы) основными задачами при моделировании являются оценка гидродинамической структуры фаз определение удельной поверхности реакции оценка изменения состояния твердых частиц в ходе реакции определение соотношения скоростей процессов тепло- и массопереноса. [c.19]
При переходе к более сложным реакциям определение Е чрезвычайно усложняется. Но несмотря на то что квантовомеханический метод расчета поверхности потенциальной энергии элементарного химического акта для реакций с многоатомными молекулами практически пока не осуществим из-за математических трудностей этот подход является в принципе наиболее правильным. Поэтому приближенное решение проблемы ищут исходя из квантовомеханических представлений как путем упрощения физической картины процесса, так и путем упрощения математического аппарата
www.chem21.info
Химические реакции определение возможности протекания
Знание законов химического равновесия позволяет решать, не прибегая к опыту, многие важнейшие задачи производственной практики и научно-исследовательской работы. Главными из них являются определение условий проведения химической реакции и возможности ее протекания в том или другом направлении, нахождение предела ее протекания, выбор оптимального режима, повышение выхода продукта реакции. [c.13]Цель этого этапа моделирования — определение границ кинетической области, а также оптимальных пористой структуры, формы и размеров зерен катализатора. Работами многих ученых » -созданы методы анализа скорости протекания химических процессов в пористых зернах и даны важнейшие рекомендации -зо, 52,5з JJo выбору указанных оптимальных параметров. Развитие математического моделирования при помощи ЭВМ открыло новые возможности дальнейшего совершенствования методов расчета и детального изучения механизмов химических реакций на пористых катализаторах. [c.472]
Константа равновесия химической реакции позволяет знать направление и предел ее возможного протекания. Действительно, если для реакции типа (3.6) известна Кр, то для смеси с определенными значениями парциальных давлений реагентов Рв, РЬ, Р а, Рк можно составить выражение [c.123]
Позднее, с открытием и исследованием электрической, лучи стой, химической и других форм энергии, постепенно в круг рассматриваемых термодинамикой вопросов включается и изучение этих форм энергии. Быстро расширялась и область практического применения термодинамических методов исследования. Уже не только паровая машина и процессы превращения механической энергии в теплоту исследуются на основе законов термодинамики, но и электрические машины, холодильные машины, компрессоры, двигатели внутреннего сгорания, реактивные двигатели. Гальванические элементы, а также процессы электролиза, различные химические реакции, атмосферные явления, некоторые процессы, протекающие в растительных и животных организмах, и многие другие исследуются не только в отношении их энергетического баланса, но и в отношении возможности, направления и предела самопроизвольного протекания процесса в данных условиях. Они исследуются также в отношении установления условий равновесия, определения максимального количества полезной работы, которая может быть получена при проведении рассматриваемого процесса в тех или иных условиях, или, наоборот, минимального количества [c.175]
Изучение процесса протекания химических реакций. По мере проникновения структурного анализа в повседневную жизнь химических лабораторий и увеличения пропускной способности структурных центров эта задача постепенно выходит на передний план. Какие преобразования происходят в многостадийном процессе химического реагирования — один из самых актуальных и сложных вопросов многих реакций. Структурное изучение исходных веществ, промежуточных и конечных продуктов, возникающих в разных термодинамических условиях, позволяет уяснить многие (хотя, конечно, не все) стороны процесса. При этом следует иметь в виду, что чисто стерические эффекты, пространственные возможности или, наоборот, затруднения являются немаловажными факторами в определении направления протекания реакций. Особенно существенно в этом аспекте структурное изучение продуктов, возникающих на разных стадиях каталитических реакций. [c.176]
В общем случае интенсификация химического процесса определяется наилучшими условиями, обеспечивающими протекание химической реакции с максимальной скоростью. Следовательно, вопросы интенсификации ХТП решаются на основе анализа кинетики химических реакций. Рециркуляция способствует уменьшению времени реакции и, как следствие этого, в результате быстрого отвода продуктов реакции из реакционной зоны — увеличению концентраций реагирующих веществ. Методика кинетического расчета для определения эффективно функционирующего реакционного узла при наличии рецикла, предложенная М. Ф. Нагиевым, позволяет определить условия, в которых возможна максимальная производительность объема реактора при минимальном образовании побочных продуктов, обеспечивает возможность эффективного применения рециркуляции, дающей максимальный эффект интенсификации химического процесса. [c.301]
Ранее был рассмотрен термодинамический метод изучения химических процессов, позволяюш,ий осуществлять расчет химических равновесий и устанавливать направление возможного протекания процессов в тех или иных условиях. Термодинамические данные важны в том отнощении, что самопроизвольный ход определенной реакции в заданных условиях возможен лишь в направлении термодинамического равновесия. Никакие факторы, влияющие на скорость процесса, скажем, перемешивание или введение катализатора, не могут повернуть реакцию в обратном направлении. Поэтому и все усилия, направленные на осуществление такой реакции, являются бесплодными. Однако знание возможного направления реакции и даже какой-либо термодинамической величины, количественно характеризующей степень отклонения системы от состояния равновесия (например, ЛО), не позволяет сделать никаких заключений о действительной скорости этой реакции в определенных условиях. [c.253]
Основы физической и коллоидной химии позволяют заложить фундамент развития качественных и количественных представлений об окружающем мире. Эти знания необходимы для дальнейшего изучения таких специальных дисциплин, как агрохимия, почвоведение, агрономия, физиология растений и животных и др. Современное состояние науки характеризуется рассмотрением основных физико-химических проц
www.chem21.info
Реакции химические, определение — Справочник химика 21
Экспериментальный метод определения константы равновесия отличается высокой точностью и достоверностью, но его возможности весьма ограниченны. Во-первых, он распространяется лишь на практически обратимые реакции. Во-вторых, он не может быть использован для изучения медленно протекающих реакций, химическое равновесие в которых устанавливается слишком долго. В-третьих, не всегда удается подобрать подходящий метод анализа, обладающий достаточной чувствительностью, скоростью выполнения и не нарушающий при этом целостности изучаемой химической системы. [c.140]Применение катализаторов, многократно увеличивающих скорость реакции в определенном направлении, позволило разработать целый ряд промышленных способов получения химической продукции. Несмотря на непрерывное развитие наших знаний [c.109]
Поскольку фазовое равновесие в замкнутых системах достигается при наличии в системе химического равновесия, очевидно, что расчет равновесия в системах, в которых происходит несколько одновременно протекающих реакций, представляет определенные трудности. [c.42]
Оценки основных характеристик фронта экзотермической реакции. Процедура определения приближенного значения максимальной температуры во фронте реакции состоит в использовании метода узких реакционных зон [11], согласно которому основная доля химического превращения во фронте реакции реализуется при температурах, близких к максимальной. При Дэф = оо максимальная температура во фронте реакции определяется из уравнения [c.86]
Обобщенный объект —это некоторое известное и широко используемое в данной ПО понятие, например химическая реакция , химическое оборудование , технологический поток и т.д. Обобщенный объект фактически представляет определенным образом класс объектов ПО. Конкретный, или индивидный, объект — это некоторым образом выделенная единичная (индивидная) сущность, например теплообменник № 87 , семь компонентов . Из приведенных примеров видно, что понятия обобщенного и конкретного объекта относительны и зависят от рассматриваемой проблемной среды и решаемых в ней задач. Однако в конкретной ПО обобщенные и индивидные объекты выделяются достаточно просто. [c.135]
Основным технологическим элементом установки для проведения химического процесса является аппарат, в котором происходит химическая реакция. Химическими реакторами принято считать аппараты, в которых осуществляются химические процессы с целью получения определенного вещества в рамках одного технологического процесса. [c.26]
Систематические исследования термодинамики многих таких химических реакций были проведены в Институте горючих ископаемых. Изучены реакции получения непредельных углеводородов, синтез-газа, водорода и углерода из углеводородов Сх—С5. При этом рассмотрены не только перспективные реакции (использование которых возможно в дальнейшем), но и реакции, не имеющие в настояш.ее время перспектив, протекающие как побочные. Изучение последних необходимо для нахождения возможностей их устранения, а во многих случаях данные для подобных реакций представляют определенный практический интерес как термодинамические характеристики процесса, проводимого в обратном направлении. [c.5]
Таким образом, величины и/,у представляют собой усредненные по распределению вероятности переходов, в частности коэффициенты (константы) скорости химических реакций /г,, определенные для молекул в некоторых квантовых состояниях . [c.14]
Чуханов [2] объясняет это явление отставанием химических реакций при термической деструкции, которые, как все реакции, имеют определенные конечные скорости. Для полного протекания химических процессов необходимо термическое воздействие в течение определенного времени. [c.227]
Начиная с 80-х годов, исследования состава нефтей стали широко производиться как в России, так и в США. В России в этих исследованиях участвовали выдающиеся ученые того времени — Д. И. Менделеев, В. В. Марковников, М. И. Коновалов и другие. Д. И. Менделеев в 1883 г. установил присутствие пентана в легкой фракции бакинской нефти и его идентичность с пентаном американской нефти. В. В. Марковников и В. Оглоблин установили присутствие в бакинских нефтях нового класса углеводородов, названных ими нафтенами. Дальнейшие исследования показали, что в составе нефтей присутствует много различных углеводородов, и содержание углеводородов разных классов неодинаково в разных нефтях. Оказалось, что в бакинской нефти много нафтенов, а пенсильванская нефть США более богата метановыми углеводородами. Все эти исследования состава нефтей проводились с помощью перегонки, химических реакций и определения плотности. [c.218]
Скорость химической реакции w, определенная по веществу В, равна количеству этого вещества, реагирующему в единицу времени в единице объема [c.329]
Во многих технологических процессах в кипящий слой поступает или им поглощается теплота вследствие протекающих в нем химических реакций или определенных физических процессов 136 [c.136]
В химии нефти с тепловым свойствами чаще всего приходится встречаться при определении констант равновесия тех или иных химических реакций углеводородов, для чего необходимо знание теплового эффекта реакции. Непосредственное определение теплоты реакции обычно чрезвычайно трудно и сложно и чаще эту величину находят расчетом, пользуясь законом Гесса. [c.84]
Для химической реакции с определенным тепловым эффектом кривая зависимости аТ от в
www.chem21.info
Типы химических реакций: классификация
В современной науке различают химические и ядерные реакции, протекающие в результате взаимодействия исходных веществ, которые принято называть реагентами. В результате образуются другие химические вещества, которые называются продуктами. Все взаимодействия происходят при определенных условиях (температура, давление, свет, излучение, присутствие катализаторов и прочее). Ядра атомов реагентов химических реакций не меняются. В ядерных превращениях образуются новые ядра и частицы. Существует несколько различных признаков, по которым определяют типы химических реакций.
За основу классификации можно взять число исходных и образующихся веществ. В этом случае все типы химических реакций делятся на пять групп:
- Разложения (несколько новых получается из одного вещества), например, разложение при нагревании калия хлората на хлористый калий и кислород: KCLO3 → 2KCL + 3O2.
- Соединения (два или несколько соединений образуют одно новое), взаимодействуя с водой, окись кальция превращается в гидроокись кальция: h3O + CaO → Ca(OH)2;
- Замещения (число продуктов равно числу исходных веществ, в которых замещена одна составляющая часть на другую), железо в сульфате меди, замещая медь, образует сульфат двухвалентного железа: Fe + CuSO4 → FeSO4 +Cu.
- Двойного обмена (молекулы двух веществ обмениваются оставляющими их частями), металлы в йодиде калия и азотнокислом серебре обмениваются анионами, образуя выпадающий в осадок йодид серебра и азотнокислый кадий: KI + AgNO3 → AgI↓ + KNO3.
- Полиморфного превращения (происходит переход вещества из одной кристаллической формы в другую), йодид ртути красного цвета при нагревании переходит в йодид ртути желтого цвета: HgI2 (красный) ↔ HgI2 (желтый).
Если химические превращения рассматривать по признаку изменения в реагирующих веществах степени окисления элементов, то тогда типы химических реакций могут делиться на группы:
- С изменением степени окисления — реакции окислительно-восстановительные (ОВР). В качестве примера можно рассмотреть взаимодействие железа с соляной кислотой: Fe + HCL → FeCl2 + h3, в результате степень окисления железа (восстановитель, отдающий электроны) изменилась с 0 до -2, а водорода (окислитель, принимающий электроны) с +1 до 0.
- Без изменения степени окисления (т. е. не ОВР). Например, реакции кислотно-щелочного взаимодействия бромистого водорода с гидроокисью натрия: HBr + NaOH → NaBr + h3O, в результате таких реакций образуются соль и вода, а степени окисления химических элементов, входящих в исходные вещества, не меняются.
Если рассматривать химическое равновесие и скорость протекания в прямом и обратном направлении, то все типы химических реакций могут делиться также на две группы:
- Обратимые — те, что одновременно протекают в двух направлениях. Большинство реакций являются обратимыми. В качестве примера можно привести растворение в воде двуокиси углерода с образованием нестойкой угольной кислоты, которая разлагается на исходные вещества: h3O + CO2 ↔ h3CO3.
- Необратимые — протекают только в прямом направлении, после полного расходования одного из исходных веществ завершаются, после чего присутствуют только продукты и исходное вещество, взятое в избытке. Обычно один из продуктов является или выпавшим в осадок нерастворимым веществом или выделившимся газом. Например, при взаимодействии серной кислоты и хлористого бария: h3SO4 + BaCl2 + → BaSO4↓ + 2HCl в осадок выпадает нерастворимый сульфат бария.
Типы химических реакций в органической химии можно разделить на четыре группы:
- Замещение (происходит замена одних атомов или групп атомов на другие), например, при взаимодействии хлорэтана с гидроокисью натрия образуется этанол и хлорид натрия: C2H5Cl + NaOH → C2H5OH + NaCl, то есть атом хлора замещается на атом водорода.
- Присоединение (две молекулы реагируют и образовывают одну), например, бром присоединяется в месте разрыва двойной связи в молекуле этилена: Br2 + Ch3=Ch3 → BrCh3—Ch3Br.
- Отщепление (молекула разлагается на две и более молекулы), например, при определенных условиях этанол разлагается на этилен и воду: C2H5OH → Ch3=Ch3 + h3O.
- Перегруппировка (изомеризация, когда одна молекула превращается в другую, но качественный и количественный состав атомов в ней не меняется), например, 3-хлорутен-1 (C4H7CL) превращается в 1 хлорбутен-2 (C4H7CL). Здесь атом хлора перешел от третьего углеродного атома в углеводородной цепочке к первому, а двойная связь соединяла первый и второй атомы углерода, а затем стала соединять второй и третьи атомы.
Известны и другие виды химических реакций:
- По тепловому эффекту: реакции, протекающие с поглощением (эндотермические) или выделением тепла (экзотермические).
- По типу взаимодействующих реагентов или образующихся продуктов. Взаимодействие с водой — гидролиз, с водородом — гидрирование, с кислородом — окисление или горение. Отщепление воды — дегидратация, водорода — дегидрирование и так далее.
- По условиям взаимодействия: в присутствии катализаторов (каталитические), под действием низкой или высокой температуры, при изменении давления, на свету и прочее.
- По механизму протекания реакции: ионные, радикально-цепные или цепные реакции.
fb.ru
Реакции определение и классификация — Справочник химика 21
Чтобы помочь абитуриентам, авторы уделяют внимание показу того, как составляется план ответа, как раскрывается логика химической науки. Классификация веществ и реакций, определение понятий и-терминология, номенклатура, схемы и таблицы — все это служит иллюстрацией рассматриваемых положений и способствует обобщению знаний. Далее на основании важнейших общетеоретических положений раскрываются главнейшие свойства неорганических и органических соединений. [c.4]Классификация химических реакций реакции соединения, разложения, замещения, обмена. Окислительно-восстановительные реакции. Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов. [c.501]
Рассмотренная классификация реакций с технологической точки зрения является, вероятно, не полной и, более того, условной, так как некоторые реакции очень трудно отнести к тому или иному классу (изотопные, ионные и др.). Однако подавляющее большинство реакций относится к определенному классу или типу реакций рассмотренной классификации. [c.101]
Основные научные работы посвящены физической органической химии, основателем которой он является. Изучал (1926—1933) электронную структуру ароматических соединений. Развил (1926—1934) теорию электронных смещений, или теорию мезомерии, отправляясь от схем Р. Робинсона. Ввел представление об электро- и нуклеофильных реагентах и реакциях, уточнил классификацию эффектов электронных смещений, рассмотрел их причины, осуществил широкое обобщение материала, относящеюся к определению зависимости физических свойств и реакционной способности соединений (по данным химической кинетики) от их электронного строения. Изучал механизм галогенирования и гидратации алкенов. Совместно со своим учеником и сотрудником Э. Д. Хьюзом провел (1933—1946) серию фундаментальных исследований кинетики реакций замещения у насыщенного углеродного атома. Вместе с В. Прелогом разработал общепринятую систему Н- и 8-обозначений для пространственных конфигураций. Автор книги Теоретические основы органической химии (1953), выдержавшей два издания и переведенной на русский язык. [22, 80, 81,322,332,339] [c.209]
К. Ингольд развил теорию электронных смещений, отправляясь от схем Р. Робинсона. Ввел представление об электро- и нуклеофильных реагентах и реакциях, уточнил классификацию эффектов электронных смещений, рассмотрел их причины. Осуществил щирокое обобщение материала, относящегося к определению зависимости физических свойств и реакционной способности соединений (по данным химической кинетики) от их электронного строения. [c.673]
Теория активированного комплекса совместно с теорией кинетики сложных реакций, разработанной автором, позволяет дать рациональную классификацию сложных реакций. Актуальность вопроса видна из того, что сложные реакции наиболее часто встречаются на практике между тем до сих пор нет четкого разграничения понятий для ряда даже часто встречающихся типов сложных реакций. Новая классификация делает попытку суммировать и обобщить накопившийся в химии опыт в этой области на основе определенных структурных представлений. Оказывается, что сложные реакции представляют собой линейные структуры, и потому к ним применимы методы структурной алгебры. Последние имеют две стороны изобразительную, или геометрическую, и расчетную, или алгебраическую. В этой главе мы остановимся на новом способе представления сложных реакций. Сущность предлагаемого метода состоит в следующем. [c.283]
Определение места данного типа сложной реакции в классификации. В разделе 3 этой главы мы наметили классификацию сложных реакций сначала по числу простых реакций т, из которых она состоит, затем при определенном т — по числу вторичных, третичных, четвертичных и т. д. симплексов, из которых состоит комплекс данной сложной реакции. Если же и этих признаков окажется недостаточно, то следующий классификационный признак — это общее число вершин всех симплексов (не принимая во внимание их спайки при образовании комплексов). Матрица позволяет найти место данной сложной реакции в классификации. Для нахождения первой величины т достаточно пересчитать диагональные элементы К в Гг (это и есть т), для нахождения второй величины — пересчитать число занятых мест в каждой строке в матрице Q, для нахождения третьей величины — пересчитать число всех занятых мест во всей матрице Q. В аналитической и притом матричной форме две последние операции выразятся следующим образом (что касается т, то это просто число строк в т, п-матрице С). [c.337]
Если предположить, что катализ реакции гидрирования бензола возможен только кластерами атомов определенной структуры, то эта реакция в классификации Будара должна быть отнесена к разряду структурно-чувствительных [33]. Поэтому, видимо, удельная активность никеля, фиксированно- [c.95]
Методы определения скорости химических реакций. Кинетическая классификация химических реакций. . [c.297]
При исследовании органических соединений следует пользоваться реакциями для классификации после определения температуры кипения (или плавления), растворимости и после опытов с прокаливанием. На основании этих данных и внешнего вида соединения (цвет, физическое состояние, запах) уже возможно отнести его к одному или двум классам растворимости. Кроме того, эти определения дают указание, какие типы функциональных групп могут присутствовать в соединениях. Следующая стадия исследования состоит в поисках специфических признаков, указывающих на присутствие или отсутствие наиболее часто встречающихся функциональных групп. Для этого следует избрать несколько реактивов для классификации, которые не только давали бы указания на присутствие той или иной функциональной группы, но и помогали бы исключению многих классов соединений. [c.88]
Существует определенная классификация реакций ионного инициирования процессов полимеризации по типам инициирующих агентов и по механизму их действия. Мы ограничиваемся краткими замечаниями по этому поводу (подробнее см. [1—3]). [c.52]
Приводится классификация кибернетических функций катализаторов, которая включает обеспечение многократной повторяемости этапов единственно [в
www.chem21.info