Определение реакций связей аналитическим и графическим способом
Решение задачи по определению аналитическим и графическим способами реакций связей в шарнирном соединении невесомой стержневой системы, нагруженной двумя силами, лежащими в одной плоскости.
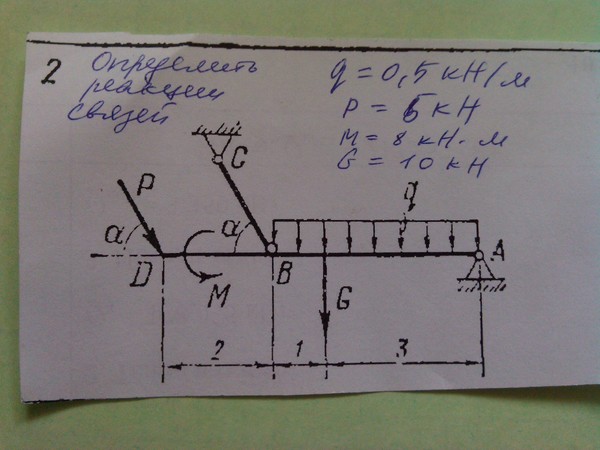
Задача
Определить реакции связей системы стержней, удерживающих подвешенные на нерастяжимых нитях грузы 1 и 2.
Масса грузов: F1 = 0,4кН и F2 = 0,5кН (рис. 1). Весом стержней пренебречь.
Найденные аналитическим способом значения требуется проверить графически.
Решение
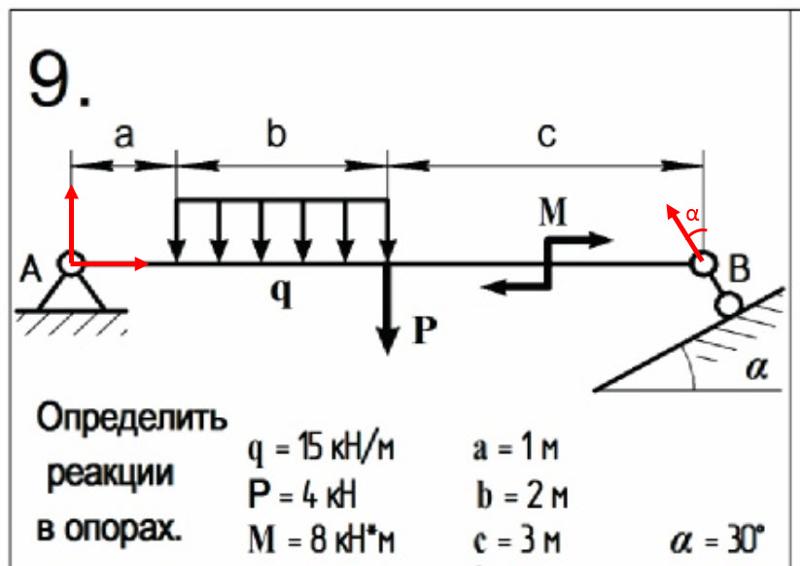
1. Рассматриваем равновесие шарнира В.
2. Освобождаем шарнир В от связей и изображаем действующие на него активные силы и реакции связей, располагая их вдоль оси стержней (рис. 2).
Аналитический способ решения задачи
Аналитическим называют способ решения, при котором искомые результаты получают путем расчетов по составленным выражениям.
Другие видео
Выбираем систему координат и составляем уравнения равновесия для системы сил, действующих на шарнир В.
Определяем реакции стержней R1 и R2, решая уравнения (1) и (2).
Из уравнения (1) получаем:
Подставляем найденное значение R1 в уравнение (2) и получаем
Положительные значения реакций связей R1 и R2 указывают на то, что первоначально выбранные направления реакций оказались верными.
Графическое решение. Силовой многоугольник
Проверяем правильность полученных результатов, решая задачу графически.
Полученная система сил находится в равновесии, следовательно, силовой многоугольник, построенный для этой системы сил, должен быть замкнутым.
Строим силовой многоугольник (рис. 3) в следующем порядке:
- В выбранном масштабе (например: μсил=0,01кН/мм) из точки a откладываем, путем параллельного переноса, заданную силу F1
- От конца вектора F1 (точки b) под заданным углом откладываем силу F2
- Из точек а и с проводим прямые, параллельные положениям стержней 1 и 2.

Эти прямые пересекаются в точке d и в результате построения образуется замкнутый многоугольник abcd, в котором сторона cd=R2, а сторона da=R1.
Измерив длины этих сторон линейкой (в мм) и умножив на масштаб μсил построения сил, получаем значения искомых реакций связей в стержнях:
Как видно из чертежа, графическое решение задачи подтверждает правильность аналитического решения.
Другие примеры решения задач статики >
Сохранить или поделиться с друзьями
Вы находитесь тут:
На нашем сайте Вы можете получить решение задач и онлайн помощь
Подробнее
Стоимость мы сообщим в течение 5 минут
на указанный вами адрес электронной почты.
Если стоимость устроит вы сможете оформить заказ.
НАБОР СТУДЕНТА ДЛЯ УЧЁБЫ
На нашем сайте можно бесплатно скачать:
— Рамки A4 для учебных работ
— Миллиметровки разного цвета
— Шрифты чертежные ГОСТ
— Листы в клетку и в линейку
Сохранить или поделиться с друзьями
Заказать решение
Поиск формул и решений задач
Теоретическая механика.
 20 лекций. Ч. 1. Статика. Кинематика Теоретическая механика. 20 лекций. Ч. 1. Статика. Кинематика
20 лекций. Ч. 1. Статика. Кинематика Теоретическая механика. 20 лекций. Ч. 1. Статика. Кинематика
ОглавлениеПРЕДИСЛОВИЕВВЕДЕНИЕ.  ПРЕДМЕТ И ОСНОВНЫЕ ПОНЯТИЯ ТЕОРЕТИЧЕСКОЙ МЕХАНИКИ ПРЕДМЕТ И ОСНОВНЫЕ ПОНЯТИЯ ТЕОРЕТИЧЕСКОЙ МЕХАНИКИСТАТИКА. ЛЕКЦИЯ 1. ЗАДАЧИ СТАТИКИ, АКСИОМЫ СТАТИКИ. СВЯЗИ И РЕАКЦИИ СВЯЗЕЙ Момент силы относительно точки Алгебраический момент силы Основные типы связей и их реакции Упражнения ЛЕКЦИЯ 2. СХОДЯЩИЕСЯ СИЛЫ И ПАРЫ СИЛ Сходящиеся силы. Приведение сходящихся сил к простейшему виду Вычисление и построение равнодействующей Условия равновесия сходящихся сил Теорема о трех силах Теорема Вариньона Пара сил и ее момент Приведение системы пар сил к простейшему виду или сложение пар сил Упражнения ЛЕКЦИЯ 3. ПРЕОБРАЗОВАНИЕ И РАВНОВЕСИЕ ПРОСТРАНСТВЕННОЙ ПРОИЗВОЛЬНОЙ СИСТЕМЫ СИЛ Момент силы относительно оси Аналитический способ вычисления момента Геометрический способ вычисления момента Преобразование пространственной произвольной системы сил Приведение пространственной произвольной системы сил к данному центру. Главный вектор и главный момент. Основная теорема статики Перемена центра приведения ЛЕКЦИЯ 4.  ПРЕОБРАЗОВАНИЕ И РАВНОВЕСИЕ ПРОСТРАНСТВЕННОЙ ПРОИЗВОЛЬНОЙ СИСТЕМЫ СИЛ (продолжение). ЧАСТНЫЕ СЛУЧАИ СИСТЕМЫ СИЛ ПРЕОБРАЗОВАНИЕ И РАВНОВЕСИЕ ПРОСТРАНСТВЕННОЙ ПРОИЗВОЛЬНОЙ СИСТЕМЫ СИЛ (продолжение). ЧАСТНЫЕ СЛУЧАИ СИСТЕМЫ СИЛСлучаи приведения к простейшему виду Условия (уравнения) равновесия пространственной произвольной системы сил Частные случаи системы сил Плоская система сил Система параллельных сил Равновесие системы тел Вопросы для самопроверки ЛЕКЦИЯ 5. ЦЕНТР ПАРАЛЛЕЛЬНЫХ СИЛ И ЦЕНТР ТЯЖЕСТИ Центр параллельных сил Распределенные силы Центр тяжести Интегральные формулы для координат центра тяжести Метод разбиения Вопросы для самопроверки ЛЕКЦИЯ 6. ТРЕНИЕ ТВЕРДЫХ ТЕЛ Трение покоя и трение скольжения Трение качения Решение задач статики при учете сил трения Заклинивание Упражнения КИНЕМАТИКА ЛЕКЦИЯ 7. КИНЕМАТИКА ТОЧКИ Способы задания движения точки Определение траектории, скорости и ускорения точки при векторном способе задания движения Определение траектории, скорости и ускорения точки при координатном способе задания движения Определение скорости и ускорения точки при естественном способе задания движения Естественные координатные оси и их орты Определение скорости Определение ускорения Вопросы для самопроверки ЛЕКЦИЯ 8.  ПРОСТЕЙШИЕ ДРИЖЕНИЯ ТВЕРДОГО ТЕЛА ПРОСТЕЙШИЕ ДРИЖЕНИЯ ТВЕРДОГО ТЕЛАПоступательное движение Вращательное движение Уравнение вращательного движения. Угловая скорость и угловое ускорение тела Траектории, скорости и ускорения точек тела Векторы угловой скорости и углового ускорения тела Векторные формулы для линейной скорости, касательного и нормального ускорений точки тела ЛЕКЦИЯ 9. ПЛОСКОПАРАЛЛЕЛЬНОЕ ДВИЖЕНИЕ ТВЕРДОГО ТЕЛА Уравнения движения Угловая скорость и угловое ускорение тела при плоскопараллельном движении Определение скоростей точек тела. Метод полюса Мгновенный центр скоростей Определение скоростей точек плоской фигуры через мгновенный центр скоростей Различные случаи определения положения мгновенного центра скоростей Определение ускорений точек тела Вопросы для самопроверки ЛЕКЦИЯ 10. СЛОЖНОЕ ДВИЖЕНИЕ ТОЧКИ Теорема сложения скоростей Теорема сложения ускорений Причины появления ускорения Кориолиса Вычисление и построение ускорения Кориолиса Вопросы для самопроверки ДОБАВЛЕНИЕ.  КИНЕМАТИКА ПРОЦЕССА ФУГОВАНИЯ ДРЕВЕСИНЫ КИНЕМАТИКА ПРОЦЕССА ФУГОВАНИЯ ДРЕВЕСИНЫСхема и расчетная модель процесса фугования Геометрические характеристики обработанной поверхности при одном ноже в ножевой головке Геометрические характеристики поверхности в случае многоножевой головки РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА |
Энергии связи — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1981
Атомы связываются друг с другом, образуя соединения, потому что при этом они достигают более низких энергий, чем те, которыми они обладают как отдельные атомы. Количество энергии, равное разности энергий связанных атомов и энергий разъединенных атомов, выделяется обычно в виде тепла.
Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, образующие другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
\[ 2H_2O \стрелка вправо 2H_2 + O_2\]
Для разрыва связи всегда требуется энергия, известная как энергия связи. Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы. Его можно использовать для определения наиболее подходящей точечной структуры Льюиса при наличии нескольких точечных структур Льюиса.
Хотя каждая молекула имеет свою характеристическую энергию связи, возможны некоторые обобщения.Для разрыва связи всегда требуется энергия. Энергия высвобождается при образовании связи.
 Например, хотя точное значение энергии связи С–Н зависит от конкретной молекулы, все связи С–Н имеют энергию связи примерно одинакового значения, поскольку все они являются связями С–Н. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Мы можем рассчитать более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи.
Например, хотя точное значение энергии связи С–Н зависит от конкретной молекулы, все связи С–Н имеют энергию связи примерно одинакового значения, поскольку все они являются связями С–Н. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Мы можем рассчитать более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи.| Одиночные облигации | |||||||
|---|---|---|---|---|---|---|---|
| В—В | 432 | Н—В | 391 | И—Я | 149 | С = С | 614 |
| В—Ж | 565 | Н—Н | 160 | I—Кл | 208 | С ≡ С | 839 |
| H—Cl | 427 | Н-Ф | 272 | И—Бр | 175 | О = О | 495 |
| H—Br | 363 | N—Cl | 200 | С = О* | 745 | ||
| Н—Я | 295 | Н—Бр | 243 | Ш-В | 347 | С ≡ О | 1072 |
| Н—О | 201 | Ю-Ф | 327 | Н = О | 607 | ||
| К—Ч | 413 | О—Н | 467 | S—Cl | 253 | Н = Н | 418 |
| К—К | 347 | О—О | 146 | S—Br | 218 | Н ≡ Н | 941 |
| C—N | 305 | О-Ф | 190 | СС | 266 | С ≡ N | 891 |
| К—О | 358 | О—Cl | 203 | С = Н | 615 | ||
| C—F | 485 | О—И | 234 | Si—Si | 340 | ||
| C—Cl | 339 | Si-H | 393 | ||||
| C—Br | 276 | Ф—Ф | 154 | Si-C | 360 | ||
| К—Я | 240 | F—Cl | 253 | Si-O | 452 | ||
| К—С | 259 | Ф—Бр | 237 | ||||
| Кл—Кл | 239 | ||||||
| Cl—Br | 218 | ||||||
| Бр—Бр | 193 | ||||||
*C == O(CO 2 ) = 799 | |||||||
Когда связь прочная, энергия связи выше, поскольку для ее разрыва требуется больше энергии. Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. В общем чем короче длина связи, тем больше энергия связи.
Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. В общем чем короче длина связи, тем больше энергия связи.
Средние энергии связи в таблице T3 являются средними значениями энергии диссоциации связи. Например, средняя энергия связи O-H в H 2 O составляет 464 кДж/моль. Это связано с тем, что для диссоциации связи Н-ОН требуется 498,7 кДж/моль, а связи ОН — 428 кДж/моль.
\[\dfrac{498.7\; кДж/моль + 428\; кДж/моль}{2}=464\; кДж/моль\]
Когда принимается во внимание большее количество энергий связи в разных молекулах, среднее значение будет более точным. Однако
- Средние значения связей не так точны, как удельные энергии диссоциации связей молекул.
- Двойные связи имеют более высокую энергию по сравнению с одинарной связью (но не обязательно в 2 раза выше).
- Тройные связи имеют даже более высокую энергию, чем двойные и одинарные связи (но не обязательно в 3 раза выше).
Разрыв и образование связи
Когда происходит химическая реакция, атомы в реагентах перестраивают свои химические связи с образованием продуктов. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Поэтому, когда происходят химические реакции, всегда будет сопровождать изменение энергии .
Рисунок 1: ( слева ) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (справа) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты. В некоторых реакциях энергия продуктов ниже энергии реагентов. Таким образом, в ходе реакции вещества отдают энергию окружающей среде. Такие реакции являются экзотермическими и могут быть представлены 9Диаграмма уровней энергии 0024 на рисунке 1 (слева). В большинстве случаев энергия выделяется в виде тепла (хотя в некоторых реакциях энергия выделяется в виде света). В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы вступить в реакцию. Эти реакции являются эндотермическими и могут быть представлены диаграммами энергетических уровней, как на рисунке 1 (справа).
В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы вступить в реакцию. Эти реакции являются эндотермическими и могут быть представлены диаграммами энергетических уровней, как на рисунке 1 (справа).
Технически температура не является ни реагентом, ни продуктом
Нередко учебники и преподаватели рассматривают теплоту как независимый «вид» реакции. Хотя это совершенно неверно, потому что нельзя «добавлять или отводить тепло» к реакции, как в случае с частицами, это служит удобным механизмом для предсказания сдвига реакций при изменении температуры. Например, если теплота является «реагентом» (\(\Delta{H} > 0 \)), то реакция способствует образованию продуктов при повышенной температуре. Точно так же, если теплота является «продуктом» (\(\Delta{H} < 0 \)), то реакция способствует образованию реагентов. Более точное и, следовательно, предпочтительное описание обсуждается ниже.
Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо как «продукт» реакции, либо как «реагент». Экзотермические реакции высвобождают энергию, поэтому энергия является продуктом. Эндотермические реакции требуют энергии, поэтому энергия является реагентом.
Экзотермические реакции высвобождают энергию, поэтому энергия является продуктом. Эндотермические реакции требуют энергии, поэтому энергия является реагентом.
Пример \(\PageIndex{1}\): экзотермические и эндотермические реакции
Является ли каждая химическая реакция экзотермической или эндотермической?
- \(2H_{2(г)} + O_{2(г)} \rightarrow 2H_2O_{(ℓ)} + \text{135 ккал}\)
- \(N_{2(г)} + O_{2(г)} + \text{45 ккал} \rightarrow 2NO_{(г)}\)
Решение
Для решения этого вопроса расчетов не требуется. Просто посмотрите, где находится «тепло» в химической реакции.
- Потому что высвобождается энергия; эта реакция экзотермическая.
- Поскольку энергия поглощается; эта реакция эндотермическая.
Упражнение \(\PageIndex{1}\)
Если энергия связи для H-Cl составляет 431 кДж/моль. Какова общая энергия связи 2 молей HCl?
Ответить
Просто умножьте среднюю энергию связи H-Cl на 2. Получится 862 кДж/моль (таблица T3).
Получится 862 кДж/моль (таблица T3).
Пример \(\PageIndex{2}\): получение йодистого водорода
Чему равно изменение энтальпии этой реакции и является ли она эндотермической или экзотермической?
\[H_2(g)+I_2(g) \rightarrow 2HI(g)\]
Решение
Сначала посмотрите на уравнение и определите, какие связи существуют в реагентах.
- одна связь H-H и
- одна I-I связь
Теперь сделайте то же самое для продуктов
- две облигации H-I
Затем определите энергии этих связей из таблицы выше:
- H-H связи: 436 кДж/моль
- I-I связи: 151 кДж/моль
Сумма энтальпий на стороне реакции:
436 кДж/моль + 151 кДж/моль = 587 кДж/моль.
Это количество энергии, необходимое для разрыва связей на стороне реагента. Затем мы смотрим на формирование связи со стороны продукта:
- 2 моль H-I связи: 297 кДж/моль
Сумма энтальпий на стороне продукта:
2 x 297 кДж/моль = 594 кДж/моль
Это количество энергии высвобождается при образовании связей на стороне продукта. Таким образом, чистое изменение реакции составляет
Таким образом, чистое изменение реакции составляет
587-594 = -7 кДж/моль.
Поскольку результат отрицательный, реакция экзотермическая .
Пример \(\PageIndex{2}\): Разложение воды
Используя энергию связи, приведенную в таблице выше, найдите изменение энтальпии термического разложения воды:
\[ 2H_2O (г) \rightarrow 2H_2 + O_2 (г) \]
Реакция, описанная выше, экзотермическая или эндотермическая? Объяснять.
Решение
Изменение энтальпии связано с разрывом двух молей связей O-H и образованием 1 моля связей O-O и двух молей связей H-H (таблица T3).
- Сумма энергий, необходимых для разрыва связей на стороне реагентов, составляет 4 x 460 кДж/моль = 1840 кДж/моль.
- Сумма энергий, выделяемых для образования связей на стороне продуктов, равна
- 2 моля связей Н-Н = 2 x 436,4 кДж/моль = 872,8 кДж/моль
- 1 моль связи O=O = 1 x 498,7 кДж/мил = 498,7 кДж/моль
, что является выходной (высвобожденной) энергией = 872,8 кДж/моль + 498,7 кДж/моль = 1371,5 кДж/моль.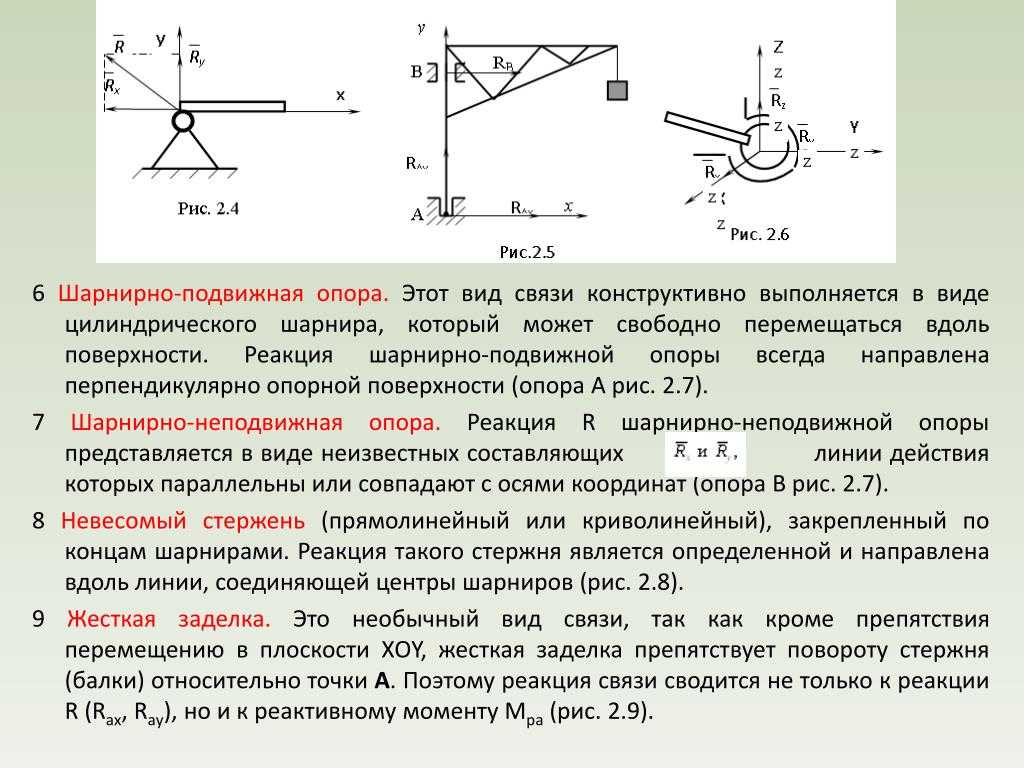
Полная разность энергий составляет 1840 кДж/моль – 1371,5 кДж/моль = 469 кДж/моль, что указывает на то, что реакция является эндотермической и что для проведения этой реакции необходимо подать 469 кДж тепла.
Эта реакция является эндотермической, поскольку для образования связей требуется энергия.
Резюме
Энергия высвобождается для создания связей, поэтому изменение энтальпии разрыва связей положительно. Для разрыва связей требуется энергия. Атомы намного счастливее, когда они «женятся» и высвобождают энергию, потому что легче и стабильнее находиться в отношениях (например, генерировать электронные конфигурации из октетов ). Изменение энтальпии отрицательно, потому что система высвобождает энергию при образовании связи.
Ссылки
- Петруччи, Ральф Х., Харвуд, Уильям С., Херринг, Ф. Г. и Мадура Джеффри Д. Общая химия: принципы и современные приложения. 9изд. Река Аппер-Сэдл: Pearson Education, Inc., 2007. .
- Каррут, Гортон, Эрлих, Юджин. «Энергия связи». Библиотека томов. Эд. Каррут, Гортон. Том 1. Теннесси: Юго-запад, 2002. .
- Больше практических задач: http://www.chalkbored.com/lessons/chemistry-11/bond-energies-worksheet.pdf
Авторы и ссылки
- Ким Сон (UCD), Дональд Ле (UCD)
Bond Energies распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
4.2: Энергия связи и химические реакции. Эндотермические и экзотермические реакции.
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 221464
Цели обучения
Цели обучения этого модуля:
- Определить энергию связи .
- Рассчитать изменение энтальпии или теплоту реакции.
- Определите, является ли химический процесс экзотермическим или эндотермическим.
Что произойдет, если вы возьмете баскетбольный мяч, поставите его на полпути к детской горке, а затем отпустите? Баскетбольный мяч катится по горке. Что произойдет, если вы сделаете это снова? Баскетбольный мяч катится по горке? Должно.
Что произойдет, если вы сделаете это снова? Баскетбольный мяч катится по горке? Должно.
Если бы вы повторяли этот эксперимент снова и снова, как вы думаете, смог бы когда-нибудь баскетбольный мяч закатить вверх по горке? Возможно нет. Почему нет? Ну, для начала, по нашему опыту, баскетбол всегда перемещался на более низкую позицию, когда ему предоставлялась возможность. Гравитационное притяжение Земли воздействует на баскетбольный мяч, и, если есть шанс, баскетбольный мяч скатится вниз. Мы говорим, что баскетбол идет на более низкую гравитационная потенциальная энергия . Баскетбольный мяч может двигаться вверх по горке, но только в том случае, если кто-то приложит к баскетбольному мячу некоторое усилие (то есть работу). Общее утверждение, основанное на бесчисленных наблюдениях за столетия исследований, заключается в том, что все объекты имеют тенденцию самопроизвольно перемещаться в положение с минимальной энергией, если на них не действует какая-либо другая сила или объект.
Bond Energy
Аналогичное утверждение можно сделать об атомах в соединениях. Атомы связываются друг с другом, образуя соединения, потому что при этом они достигают более низких энергий, чем те, которыми они обладают как отдельные атомы. Количество энергии, равное разности энергий связанных атомов и энергий разъединенных атомов, выделяется обычно в виде тепла. То есть связанные атомы имеют более низкую энергию, чем отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию. При создании соединений атомы действуют как баскетбольный мяч на детской площадке; они движутся в направлении уменьшения энергии.
Мы можем обратить процесс вспять, как и в случае с баскетбольным мячом. Если мы вкладываем энергию в молекулу, мы можем разорвать ее связи, разделив молекулу на отдельные атомы. Связи между некоторыми конкретными элементами обычно имеют характерную энергию, называемую энергией связи, которая необходима для разрыва связи. Такое же количество энергии было высвобождено, когда атомы образовали химическую связь. Срок энергия связи обычно используется для описания силы взаимодействия между атомами, образующими ковалентные связи. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Связь C=C прочнее, чем связь C-C (как обсуждалось относительно длины связи в разделе 4.4). Для атомов в ионных соединениях, притягиваемых противоположными зарядами, используется термин энергия решетки. Сейчас мы будем иметь дело с ковалентными связями в молекулах.
Такое же количество энергии было высвобождено, когда атомы образовали химическую связь. Срок энергия связи обычно используется для описания силы взаимодействия между атомами, образующими ковалентные связи. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Связь C=C прочнее, чем связь C-C (как обсуждалось относительно длины связи в разделе 4.4). Для атомов в ионных соединениях, притягиваемых противоположными зарядами, используется термин энергия решетки. Сейчас мы будем иметь дело с ковалентными связями в молекулах.
Хотя каждая молекула имеет свою характеристическую энергию связи, возможны некоторые обобщения. Например, хотя точное значение энергии связи С–Н зависит от конкретной молекулы, все связи С–Н имеют энергию связи примерно одинакового значения, поскольку все они являются связями С–Н. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль.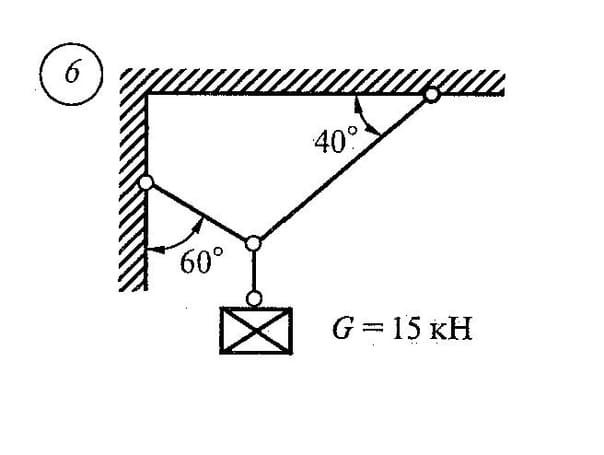 В таблице \(\PageIndex{1}\) приведены приблизительные энергии различных ковалентных связей.
В таблице \(\PageIndex{1}\) приведены приблизительные энергии различных ковалентных связей.
| Бонд | Энергия связи (ккал/моль) |
|---|---|
| С–Н | 100 |
| КО | 86 |
| С=О | 190 |
| C–N | 70 |
| С-С | 85 |
| С=С | 145 |
| К≡К | 200 |
| Н–Г | 93 |
| В–В | 105 |
| Бр-Бр | 46 |
| Cl–Cl | 58 |
| О–Н | 110 |
| О=О | 119 |
| H–Br | 87 |
| H–Cl | 103 |
Когда происходит химическая реакция, атомы в реагентах перестраивают свои химические связи с образованием продуктов.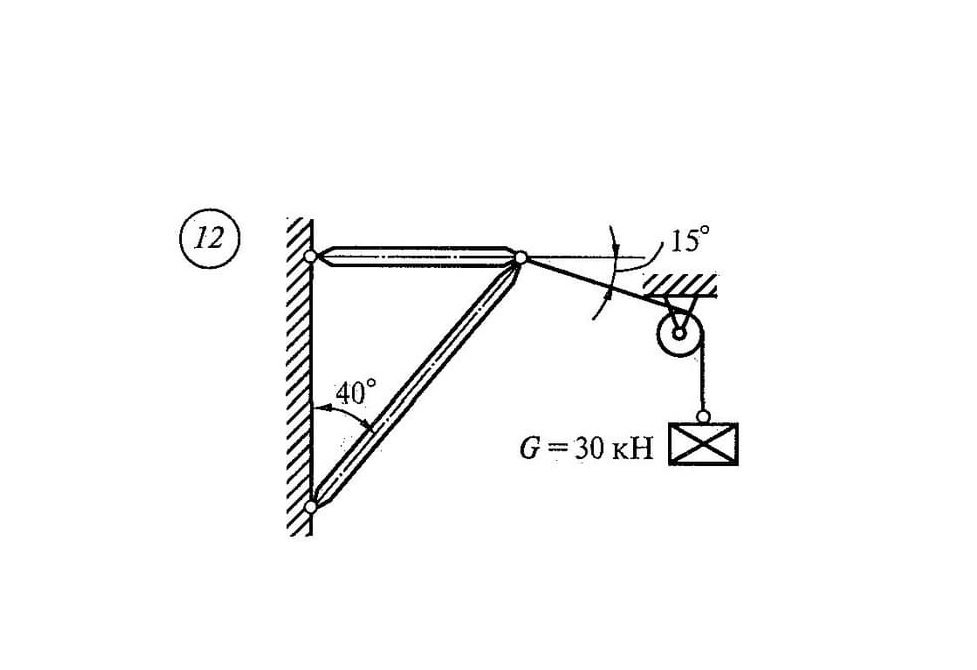 Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Поэтому, когда происходят химические реакции, всегда будет сопровождать изменение энергии . Изменение энтальпии для данной реакции можно рассчитать, используя значения энергии связи из таблицы \(\PageIndex{1}\).
Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Поэтому, когда происходят химические реакции, всегда будет сопровождать изменение энергии . Изменение энтальпии для данной реакции можно рассчитать, используя значения энергии связи из таблицы \(\PageIndex{1}\).
Изменение энтальпии или теплоты реакции, Δ
HИзменения энергии в химических реакциях обычно измеряются как изменения энтальпии. В этом процессе к реакции добавляют энергию для разрыва связей и извлекают энергию для образующихся связей.
\[\text{изменение энтальпии} ≈ \sum (\text{разорванные связи}) — \sum (\text{образованные связи}) \nonumber \]
Знак ≈ используется, потому что мы суммируем средних энергий связи (т. е. по многим различным молекулам). Следовательно, этот подход не дает точных значений изменения энтальпии, Δ H .
Рассмотрим реакцию 2 молей газообразного водорода (H 2 ) с 1 моль газообразного кислорода (O 2 ) с получением 2 молей воды:
\[\ce{2H_2(g) + O_2( g) \rightarrow 2H_2O(g)} \nonumber \]
или показано графически:
с этими средними энергиями связи:
- \(\ce{H–H}\) = 105 ккал/моль
- \(\ce{O=O}\) = 119 ккал/моль
- \(\ce{O–H}\) = 110 ккал/моль
В этой реакции разрываются 2 связи H–H и 1 связь O=O, при этом образуются 4 связи O–H (по две на каждую H 2 O). Изменения энергии можно свести в таблицу и рассчитать следующим образом:
Изменения энергии можно свести в таблицу и рассчитать следующим образом:
| Разорванные связи (ккал/моль) | Образовавшиеся связи (ккал/моль) | ||
|---|---|---|---|
| 2 Н–В | 2 моль x 105 ккал/моль = 210 ккал | 4 О–Н | 4 моля x 110 ккал/моль = 440 ккал |
| 1 О=О | 1 моль x 119 ккал/моль = 119 ккал | ||
| Итого = 329 ккал | Итого = 440 ккал | ||
\[\begin{align*} \Delta H &≈ \sum (\text{разорванные связи}) — \sum (\text{образованные связи}) \\[4pt] &≈ 329 \: \text {ккал} — 440 \: \text{ккал} \\[4pt] &≈ −111 \: \text{ккал} \end{align*} \nonumber \]
Изменение энтальпии (ΔH) реакции приблизительно -111 ккал/моль. Это означает, что связи в продуктах (440 ккал) сильнее, чем связи в реагентах (329 ккал).ккал) примерно на 111 ккал/моль. Поскольку связи в продуктах сильнее, чем в реагентах, реакция высвобождает больше энергии, чем потребляет. Эта избыточная энергия высвобождается в виде тепла, поэтому реакция экзотермическая . Следовательно, мы можем переписать реакцию с выделением тепла (111 ккал) на стороне продукта уравнения следующим образом:
Это означает, что связи в продуктах (440 ккал) сильнее, чем связи в реагентах (329 ккал).ккал) примерно на 111 ккал/моль. Поскольку связи в продуктах сильнее, чем в реагентах, реакция высвобождает больше энергии, чем потребляет. Эта избыточная энергия высвобождается в виде тепла, поэтому реакция экзотермическая . Следовательно, мы можем переписать реакцию с выделением тепла (111 ккал) на стороне продукта уравнения следующим образом:
Мы также можем переписать уравнение реакции с информацией ΔH (см. ниже ). Обратите внимание, что 9Экзотермическая реакция 0045 имеет отрицательное значение ΔH .
\[\ce{2H_2(g)+O_2(g) \rightarrow 2H_2O(g)} \ \: \: \: \: \: \Delta H = -111 \: \text{kcal} \nonumber \ ]
Пример \(\PageIndex{1}\)
Каково изменение энтальпии этой реакции? Является ли реакция экзотермической или эндотермической?
\[\ce{H_2(g) + Br_2(g) \rightarrow 2HBr(g)} \nonumber \]
Решение
Шаг 1- Сначала посмотрите на уравнение и определите, какие связи существуют в реагентах ( связи разорваны).
- одна связь H-H и
- одна связка Br-Br
Шаг 2. Сделайте то же самое для продуктов (образованных связей)
- две связи H-Br
Шаг 3. Определите энергии этих связей из таблицы \(\PageIndex{1}\):
- H-H связи: 105 ккал/моль
- Связи Br-Br: 46 ккал/моль
Шаг 4. Составьте таблицу (см. ниже) и примените формулу изменения энтальпии.
| Разорванные связи (ккал/моль) | Образовавшиеся связи (ккал/моль) | ||
|---|---|---|---|
| 1 H–H | 1 моль x 105 ккал/моль = 105 ккал | 2 Н– Бр | 2 моль x 87 ккал/моль = 174 ккал |
| 1 Бр–Бр | 1 моль x 46 ккал/моль = 46 ккал | ||
| Всего = 151 ккал | Всего = 174 ккал | ||
\[\begin{align*} \Delta H &≈ 151 \: \text{ккал} — 174 \: \text{ккал} \\[4pt] &≈ −23 \: \text{ккал} \end{align*} \nonumber \]
Шаг 5. Поскольку \(ΔH\) отрицательное значение (-23 ккал), реакция экзотермическая .
Поскольку \(ΔH\) отрицательное значение (-23 ккал), реакция экзотермическая .
Упражнение \(\PageIndex{1}\)
Используя энергию связи, приведенную в таблице выше, найдите изменение энтальпии при термическом разложении воды:
\[\ce{H_2(g) + Cl_2(g) \rightarrow 2HCl(g)} \nonumber \]
Является ли описанная выше реакция экзотермической или эндотермической? Объяснять.
- Ответить
ΔH = −43 ккал
Поскольку ΔH отрицательно (-43 ккал), реакция является экзотермической .
Эндотермические и экзотермические реакции
Эндотермические и экзотермические реакции можно рассматривать как имеющие энергию либо в качестве реагента реакции, либо в качестве продукта. Эндотермические реакции требуют энергии, поэтому энергия является реагентом. Тепло поступает из окружающей среды в систему (реакционную смесь), и энтальпия системы увеличивается (Δ H положительно). Как обсуждалось в предыдущем разделе, в экзотермической реакции выделяется тепло (которое считается продуктом) и энтальпия системы уменьшается (Δ H отрицательный).
Как обсуждалось в предыдущем разделе, в экзотермической реакции выделяется тепло (которое считается продуктом) и энтальпия системы уменьшается (Δ H отрицательный).
В ходе эндотермического процесса система получает тепло из окружающей среды, и поэтому температура окружающей среды снижается (остывается). Химическая реакция является экзотермической , если тепло выделяется системой в окружающую среду. Поскольку окружающая среда получает тепло от системы, температура окружающей среды увеличивается. См. рисунок \(\PageIndex{1}\).
Рисунок \(\PageIndex{1}\): (A) Эндотермическая реакция. (B) Экзотермическая реакция. Эндотермическая реакция: окружающая среда становится холоднее и дельта H больше 0. Экзотермическая реакция: окружающая среда нагревается и дельта H меньше 0,9.0023 Эндотермическая реакция : Когда \(1 \: \text{моль}\) карбоната кальция разлагается на \(1 \: \text{моль}\) оксида кальция и \(1 \: \text{моль} \) углекислого газа, поглощается \(177,8 \: \text{кДж}\) тепла. Поскольку тепло поглощается системой, \(177,8 \: \text{кДж}\) записывается как реагентов . Δ H является положительным для эндотермической реакции.
Поскольку тепло поглощается системой, \(177,8 \: \text{кДж}\) записывается как реагентов . Δ H является положительным для эндотермической реакции.\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \ : \: \: \Delta H = +177,8 \: \text{kJ} \nonumber \]
Экзотермическая реакция : При сгорании газообразного метана выделяется тепло, что делает реакцию экзотермической. В частности, при сгорании \(1 \: \text{моль}\) метана выделяется 890,4 кДж тепловой энергии. Эта информация может быть представлена как часть сбалансированного уравнения двумя способами. Во-первых, количество выделившейся теплоты может быть записано в виде продукта стороны реакции. Другой способ — записать теплоту реакции (Δ H ) информация с отрицательным знаком , \(-890,4 \: \text{kJ}\).
\[\ce{CH_4} \влево( г \вправо) + 2 \ce{O_2} \влево( г \вправо) \стрелка вправо \ce{CO_2} \влево( г \вправо) + 2 \ce {H_2O} \left( l \right) \: \: \: \: \: \Delta H = -890,4 \: \text{kJ} \nonumber \]
Пример \(\PageIndex{2}\)
Является ли каждая химическая реакция экзотермической или эндотермической?
- CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O(ℓ) + 213 ккал
- N 2 (г) + O 2 (г) + 45 ккал → 2NO(г)
Раствор
- Поскольку энергия (213 ккал) является продуктом, энергия выделяется в результате реакции. Следовательно, эта реакция является экзотермической.
- Поскольку энергия (45 ккал) является реагентом, энергия поглощается реакцией. Следовательно, эта реакция эндотермическая.
Упражнение \(\PageIndex{2}\)
Является ли каждая химическая реакция экзотермической или эндотермической?
- H 2 (г) + F 2 (г) → 2HF (г) + 130 ккал
- 2C(т) + H 2 (г) + 5,3 ккал → C 2 H 2 (г)
- Ответить
а.
 Энергия (130 ккал) вырабатывается, следовательно, реакция экзотермическая
Энергия (130 ккал) вырабатывается, следовательно, реакция экзотермическаяб. Энергия (5,3 ккал) поступает или поглощается в ходе реакции, следовательно, реакция эндотермическая
Энергетические диаграммы
Эндотермические и экзотермические реакции могут быть визуально представлены с помощью диаграммы уровней энергии такие же, как в Рисунок \(\PageIndex{2}\) . В эндотермических реакциях реагенты имеют более высокую энергию связи (более прочные связи), чем продукты. Сильные связи имеют более низкую потенциальную энергию, чем слабые связи . Следовательно, энергия реагентов ниже, чем у продуктов . Этот тип реакции представлен восходящей диаграммой энергетических уровней, показанной на рисунке \(\PageIndex{2A}\). Чтобы протекала эндотермическая химическая реакция, реагенты должны поглощать энергию из окружающей среды, чтобы превратиться в продукты.
В экзотермической реакции связи в продукте имеют более высокую энергию связи (более прочные связи), чем реагенты. Другими словами, энергия продуктов ниже, чем энергия реагентов, следовательно, энергетически нисходящая, как показано на рисунке \(\PageIndex{2B}\). Энергия выделяется при превращении реагентов в продукты. Выделяемая энергия обычно имеет форму тепла (хотя в некоторых реакциях энергия выделяется в виде света). В ходе экзотермической реакции тепло переходит из системы в окружающую среду и, таким образом, нагревается.
Другими словами, энергия продуктов ниже, чем энергия реагентов, следовательно, энергетически нисходящая, как показано на рисунке \(\PageIndex{2B}\). Энергия выделяется при превращении реагентов в продукты. Выделяемая энергия обычно имеет форму тепла (хотя в некоторых реакциях энергия выделяется в виде света). В ходе экзотермической реакции тепло переходит из системы в окружающую среду и, таким образом, нагревается.
| Эндотермические реакции | Экзотермические реакции |
|---|---|
| Тепло поглощается реагентами с образованием продуктов. | Тепло выделяется. |
| Тепло поглощается из окружающей среды; в результате все вокруг становится холодным. | При реакции на окружающую среду выделяется тепло; вокруг жарко. |
| Δ H rxn положительный | Δ H rxn отрицательный |
| Связи, разорванные в реагентах, прочнее, чем связи, образованные в продуктах | Связи, образующиеся в продуктах, прочнее, чем связи, разорванные в реагентах |
| Энергия реагентов ниже, чем у продуктов | Энергетическая ценность продуктов ниже, чем у реагентов |
| Представлено энергетической диаграммой «в гору» | Представлено энергетической диаграммой «спуск» |
Ключевые выводы
- Атомы удерживаются вместе за счет определенного количества энергии, называемой энергией связи.
- Для разрыва связей требуется энергия. Энергия высвобождается при образовании химических связей, потому что атомы становятся более стабильными.
- Химические процессы обозначаются как экзотермические или эндотермические в зависимости от того, выделяют они энергию или поглощают ее соответственно.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
