Структура и характеристики Льюиса K2CO3 (13 полезных фактов) —
K2CO3 или Карбонат калия — это неорганическое соединение, которое используется в промышленности, производящей стекло, мыло и т. Д. Давайте обсудим некоторые факты о нем.
Структура К2CO3 состоит из двух атомов элемента калия, трех атомов кислорода и одного атома элемента углерода. Его также называют калием, и его наблюдаемая плотность составляет около 2.43 г/смXNUMX.3. Его молярная масса составляет 138.20 г/моль.
Что касается его физических свойств, то он плавится при температуре 891°С. Разлагается при кипячении. Теплоемкость калия 114 Дж моль.-1K-1. Его получают при взаимодействии гидроксида калия с углекислым газом. Давайте изучим некоторые важные факты об этом в следующих разделах.
Как нарисовать К2CO3 структура Льюиса?Мы можем лучше понять процесс связывания в поташе с помощью концепции структуры Льюиса. Давайте разберемся с рисующей структурой Льюиса для K2CO3 в деталях.
Давайте разберемся с рисующей структурой Льюиса для K2CO3 в деталях.
Общее число валентных электронов в K2CO3 Структура Льюиса равна 26. Количество электронов, вносимых калием, равно 1 каждому из 2 атомов калия. Следовательно, 1 × 2 = 2 электрона у калия.
Вклад углерода равен 4, у кислорода 6 валентных электронов и 3 атома кислорода. Следовательно, 6 × 3 = 18. На карбонате есть 2 дополнительных электрона, что символизирует заряд от -2. Всего валентных электронов 2+5+18+2 = 26 электронов.
2. Определение наименее электроотрицательного атомаЭтот шаг включает в себя определение атома с наименьшей электроотрицательностью. Атом в середине должен быть атомом с меньшей электроотрицательностью по сравнению с другими атомами в структуре. Атом углерода будет находиться в середине структуры, так как его электроотрицательность наименьшая.
Первый шаг включает удовлетворение валентности углерода. Поскольку имеется 3 атома кислорода, 2 атома O будут иметь одну пару электронов, каждый из которых образует одинарную связь. 3rd Атом O разделяет 2 пары электронов, в результате чего образуется двойная связь. Таким образом удовлетворяются соответствующие валентности.
Но на карбонате существует заряд -2, а это значит, что доступно еще 2 электрона. Калий с валентностью 1 передаст эти электроны карбонату (2 атома калия). Итак, по обеим сторонам карбонатной структуры записано по 2 атома К. Теперь заряды уравновешены.K2CO3 структура льюиса
K2CO3 форма структуры ЛьюисаТип расположения атомов в структуре играет ключевую роль в геометрии. Давайте обсудим форму K2CO3.
Структура Льюиса K2CO3 является ионным, и при этом типе связи молекула не имеет определенной формы. Но они будут иметь систему кристаллической решетки. Так К2CO3 имеет моноклинный тип системы кристаллической решетки.
Но они будут иметь систему кристаллической решетки. Так К2CO3 имеет моноклинный тип системы кристаллической решетки.
Формальный заряд любого атома поможет в предсказании энергии (ниже). Найдем для К.2CO3 структура Льюиса.
Формальное обвинение К.2CO3 Льюиса равна 0. Это нейтральная молекула.
Уравнение для расчета формальных сборов:
- Формальный заряд = валентные электроны — неподеленные пары электронов — количество связей
- Формальный заряд карбонат-иона (C) = -2
- Формальный заряд калия (2 атома) = +2
Заряды карбонат-иона -2 и калия +2 уравновешивают друг друга, поэтому формальный заряд всей молекулы равен 0.
K2CO3 угол структуры ЛьюисаУгол в структуре даст представление о типе расположения атомов. Найдем для К. 2CO3 структура Льюиса.
2CO3 структура Льюиса.
Валентный угол в K2CO3 Льюиса 90°С. Углы, описывающие моноклинический кристаллическая система обозначаются как альфа и гамма. Итак, для К2CO3, эти углы равны α=γ=90°.
K2CO3 Правило октета структуры ЛьюисаЭтот термин простыми словами означает, что на внешней оболочке любого атома должно быть 8 электронов. Проверим К.2CO3.
K2CO3 структура Льюиса соответствует Правило октета. Калий имеет один электрон на внешней оболочке, который он может легко отдать. Таким образом, существует связь между валентными электронами калия и ионом карбоната. В этом процессе связывания все атомы удовлетворяют свои валентности.
K2CO3 Одинокие пары структуры ЛьюисаНеподеленные пары электронов не участвуют в процессе связывания. Посмотрим на К2CO3.
Одинокие пары на K2CO3 Льюиса, 8 неподеленных пар на карбонат-ионе и 3 неподеленных пары электронов на калии, но есть два атома калия. Следовательно, неподеленных пар на 2 атомах К 6.
K2CO3 валентные электроныОбщее количество электронов, находящихся на внешней оболочке молекулы, называется валентными электронами. Посмотрим на К2CO3.
Валентные электроны в K2CO3 Льюиса 26. Калий имеет 1 электрон на внешней оболочке, 2 атома К, поэтому 2 электрона. Что касается карбонатной структуры, то у углерода 4 электрона на внешней оболочке, а у кислорода 6. У кислорода 3 атома, поэтому 18 электронов. Два электрона от заряда-2.
K2CO3 гибридизацияГибридизация — это процесс смешивания орбиталей с образованием новых орбиталей с различной энергией, формой и т. д. Найдем для K2CO3.
Гибридизация центрального атома в K2CO3 структура льюиса sp2. Вычислив стерическое число, мы можем легко определить гибридизацию. Формула для расчета стерического числа обсуждается ниже.
- Стерическое число = количество атомов, связанных с центральным атомом + количество неподеленных пар электронов (на центральном атоме)
- Стерическое число = 3 + 0 = 3
Отсюда видно, что стерическое число 3 дает sp2 Тип гибридизации.
K2CO3 РастворимостьРастворимость — это свойство, которое говорит о том, до какой степени вещество может раствориться в том или ином растворителе. Проанализируем для K2CO3.
Список соединений, в которых K2CO3 растворим:
- Вода (110 г/100 мл при 20°C)
- Метанол (3 г/100 мл при 25°C)
Но К2CO3 нерастворим в этаноле и органических растворителях, таких как ацетон.
Выясним, в каком физическом состоянии находится K2CO3 существует в обычных условиях.
K2CO3 существует в твердом состоянии. На вид он белого цвета. Но это гигроскопический в природе. Он может поглощать влагу из окружающей среды. Поэтому хранить его следует соответствующим образом.
К2CO3 полярный или неполярный?Полярные вещества будут иметь различия в электроотрицательности, тогда как неполярные вещества не будут иметь. Будем учиться на К.2CO3.
К2CO3 будучи ионным соединением, мы можем рассмотреть полярность его центрального атома и сказать, что оно неполярно. Это означает, что не будет большой разницы в электроотрицательности элементов, участвующих в связывании.
К2CO3 кислотный или основной?Основываясь на диапазоне pH, мы можем разделить молекулу на кислую или основную. Проверим К.2CO3.
Проверим К.2CO3.
K2CO3 является базой. Он образуется при проведении реакции угольной кислоты (сравнительно слабой кислоты) и КОН (достаточно сильного основания). Продукт представляет собой соль основного характера, карбонат калия.
К2CO3 электролит?Вещество, которое может переходить в ионную форму и проводить электричество, называется электролитом. Найдем для К2CO3.
K2CO3 является электролитом. Мы знаем, что он находится в ионной форме. Поэтому, когда он будет растворен в растворителе (рассмотрите воду), он может разбиться на ионы, ион калия и ион карбоната. Тогда эти ионы могут течь и иметь возможность проводить электричество.
К2CO3 ионный или ковалентный?При ковалентной связи электроны разделяются для образования связей. Тогда как для ионных электрон скорее переносится.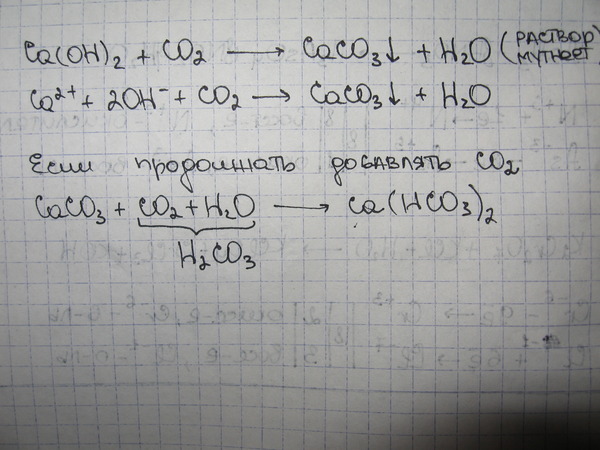 Проверим К.2CO3.
Проверим К.2CO3.
K2CO3 имеет ионный характер. Образование связи в молекуле происходит за счет переноса валентных электронов от калия к карбонату. Кроме того, тип связи бывает металлическим и неметаллическим, что является важным свойством для того, чтобы вещество называлось ионным или ковалентным.
ЗаключениеK2CO3 является ионным и твердым веществом, гигроскопичным по своей природе. Он имеет моноклинную кристаллическую систему и используется в промышленности, производящей стекло, мыло и т. д.
Энергия из воздуха, виски, фекалий и другие удивительные проекты
- Анастасия Зырянова
- Русская служба Би-би-си
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Wessex Water
Подпись к фото,Биоотходы одного человека за год могут обеспечить такой автобус топливом на 60 км
Российские ученые разработали способ утилизации углекислого газа и преобразования его в топливо. В случае реализации их идея позволит аккумулировать и использовать энергию, добытую так называемым чистым путем — буквально из воздуха.
В случае реализации их идея позволит аккумулировать и использовать энергию, добытую так называемым чистым путем — буквально из воздуха.
О возможности накапливать энергию и одновременно перерабатывать вредные выбросы в атмосферу сообщило 17 октября 2017 года издание сибирского отделения РАН «Наука в Сибири».
Водород (h3), который высвобождается в результате электролиза воды, при определенных условиях реагирует с углекислым газом (CO2), который ученые предлагают брать прямо из воздуха. В результате химической реакции получается метан Ch5 и вода.
- Исследование: закисление океана угрожает океанской жизни
- Почему полный переход на электромобили случится не сразу
- Летающая колония в атмосфере Венеры — реальность?
«Энергия в этом топливе хранится в форме химических связей, и ее можно использовать по мере потребности. Инфраструктура для таких технологий уже существует — способные транспортировать Ch5 на большие расстояния газопроводы, хранилища, системы доставки к конечному потребителю», — рассказала научный сотрудник Института катализа им.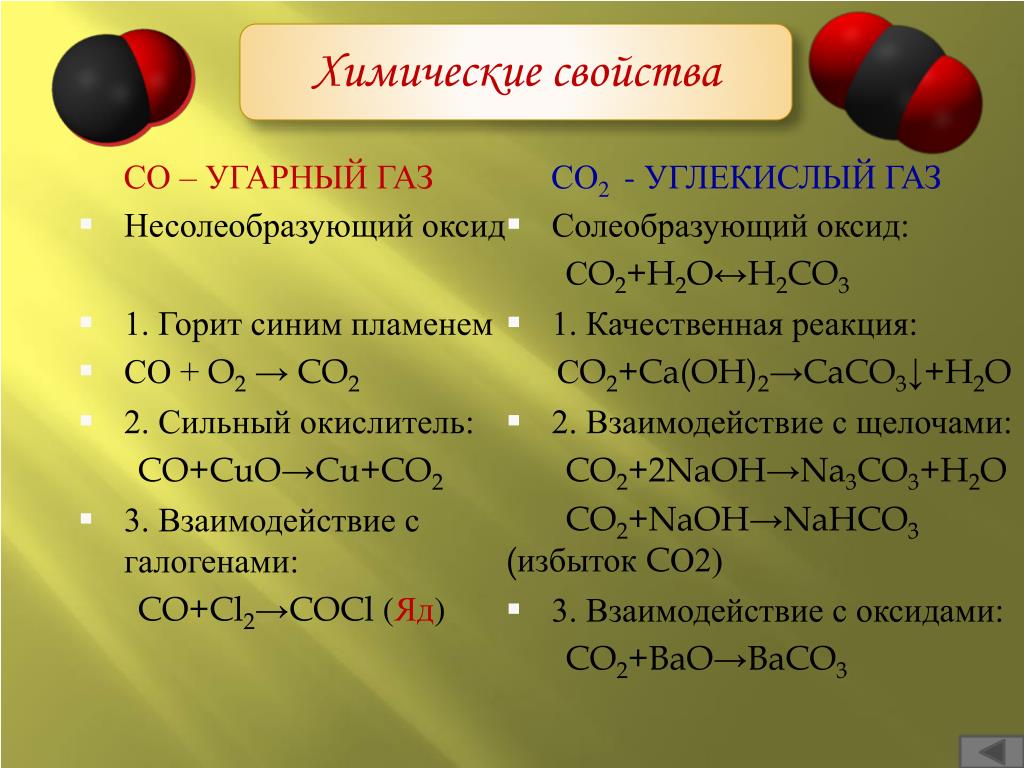 Г.К.Борескова СО РАН кандидат химических наук Жанна Веселовская.
Г.К.Борескова СО РАН кандидат химических наук Жанна Веселовская.
Добыть углекислый газ можно где угодно, но для этого необходим сорбент, который будет «собирать», то есть концентрировать CO2. В качестве сорбента ученые новосибирского института использовали карбонат калия (K2CO3).
Чтобы ускорить процесс концентрации CO2, ученые подключили к реакции пористый носитель (похожий на губку с наноразмерными порами, пишет «Наука в Сибири»), специально разработанный ими для этой реакции.
Автор фото, Sean Gallup/Getty Images
Подпись к фото,Содержание углекислого газа в атмосфере планеты стремительно растет
«Тот факт, что карбонат калия взаимодействует с углекислым газом на воздухе, хорошо известен и открыт не нами. Сорбенты на основе карбоната калия тоже изучались ранее. Вместе с тем работ по применению этих материалов для сорбции углекислого газа из воздуха практически не было — равно как и по совмещению технологии концентрирования атмосферного CO2 с его последующим метанированием», — передает издание слова Веселовской.
В действительности все не так просто. Из школьного курса химии известно, что водород и углекислый газ реагируют напрямую лишь при высокой температуре, что требует дополнительной энергии.
Однако недавно химики из университета Дьюка в США нашли способ упростить эту реакцию. Они обнаружили, что при наличии ультрафиолета и катализатора — наночастиц родия — реакция получения метана из водорода и углекислого газа протекает легко и быстро.
Такой процесс получения синтетического газового топлива становится не только энергоэффективным, но и максимально чистым.
Резкий скачок
Мы уже привыкли к тому, что энергия добывается из воды, из ветра, из солнечных лучей. Но они есть не везде.
Воздух же и углекислый газ в его составе есть всюду. И концентрация СО2 в земной атмосфере растет — люди дышат, печи горят, двигатели выбрасывают отработанный газ.
Диоксид углерода — один из парниковых газов. Сейчас содержание углекислого газа в атмосфере планеты равно 400 ppm (долей на миллион). Это значит, что в одном кубометре воздуха 400 мл CO2.
Сейчас содержание углекислого газа в атмосфере планеты равно 400 ppm (долей на миллион). Это значит, что в одном кубометре воздуха 400 мл CO2.
На протяжении сотен тысяч лет в атмосфере Земли не было такого объема CO2, какой мы наблюдаем в последние несколько десятков лет. Это заставляет ученых искать новые способы добычи чистой энергии.
Холодно, тепло, горячо
Существуют проекты, позволяющие добывать энергию из лавы, растительного масла, человеческих тел и отходов жизнедеятельности, а также микроорганизмов, мусора и некоторых напитков.
Самым очевидным из вышеперечисленного кажется жидкая магма: она раскаленная, у нее огромный объем тепловой энергии — так почему бы этим не воспользоваться?
Но использование жидкой магмы в качестве источника энергии не распространено: за это пока взялись лишь в Исландии. В рамках проекта Iceland Deep Drilling бур «Тор» сверлит Срединно-Атлантический хребет земной коры, который проходит через остров Исландия.
Автор фото, HALLDOR KOLBEINS/AFP/Getty Images
Подпись к фото,Геотермальная электростанция в Исландии, участвующая в проекте The Iceland Deep Drilling
На глубине в несколько километров, в условиях огромного давления вода нагревается расплавленной магмой до сверхкритического состояния, при котором исчезает различие между жидкостью и газом. Сверхкритическая вода, имеющая температуру 400-600 градусов по Цельсию, извлекается на поверхность и используется в качестве источника энергии.
Как замечает в своей статье Пит Роули, вулканолог из Университета Портсмута, сверхкритическая вода может генерировать энергию объемом до десяти раз больше, чем обычные геотермальные источники. Потенциальными местами ее добычи могут стать территории, где находятся молодые вулканы.
Автор фото, BERNARD MERIC/AFP/Getty Images
Подпись к фото,Нагретая лавой до сверхкритического состояния вода может быть источником энергии
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
В качестве альтернативных и возобновляемых источников энергии ученые рассматривают не только высокотемпературные. Некоторые специалисты уверены, что температуры человеческого тела может быть вполне достаточно.
Шведская компания Jernhusen еще несколько лет назад придумала, как обогревать здание в Стокгольме энергией теплом тел пассажиров расположенного рядом Центрального вокзала.
Как отмечала компания, она не отнимала тепло у пассажиров, а лишь использовала избыточное — то, что все равно бы ушло в атмосферу.
Этот способ экологичен, но у него есть свои минусы. Для того, чтобы транспортировать такую энергию из одного здания в другое, нужно, чтобы они находились относительно близко, а людской поток в помещении-источнике должен быть интенсивным. Это сужает возможности применения технологии.
Это сужает возможности применения технологии.
То же самое можно сказать о способе, который предложила американская компания EnGoPlanet: она установила в Лас-Вегасе фонари, которые обеспечиваются электричеством благодаря кинетической энергии — аккумуляторы заряжаются, когда мимо кто-то проходит.
Один человеческий шаг генерирует 4-8 ватт, но чтобы фонари работали всю ночь, нужно много прохожих. Это реально, но применимо не везде.
Шокирующие технологии
В Дании, Швеции и Британии крематории продают избытки энергии, которая получается в результате сжигания тел умерших. Эта энергия идет на обогрев домов, а британский крематорий в Дареме даже преобразовывает ее в электричество.
Автор фото, YE AUNG THU/AFP/Getty Images
Подпись к фото,В некоторых странах крематории продают избытки энергии, которая получается в результате сжигания тел
За одну кремацию выделяется энергия, которой хватит на питание полутора тысяч телевизоров в течение часа. Кого-то такой источник энергии может шокировать, но сторонники этой идеи считают, что вклад в экологию — достаточный аргумент.
Кого-то такой источник энергии может шокировать, но сторонники этой идеи считают, что вклад в экологию — достаточный аргумент.
Неоднозначным выглядит еще один источник энергии — фекалии. Так называемый Bio-Bus, который отправила на британские дороги бристольская компания GENeco, ездит на полученном из фекалий биогазе.
За один 15-мильный маршрут Bio-Bus отрабатывает отходы более 30 тысяч домохозяйств. Сначала он ездил между городами Бат и Бристоль, затем его пустили и по улицам Бристоля.
Технология подобная той, что использует GENeco, применяется широко по всему миру, рассказывает на своем сайте норвежская компания Cambi. Запатентованный ей способ термального гидролиза используют в более чем 20 странах мира.
Автор фото, Sean Gallup/Getty Images
Подпись к фото,Фабрики по переработке навоза активно строят в Германии с 2000-х годов
Он применяется в том числе и на заводе по переработке биоотходов в Вашингтоне. Биомассу нагревают под высоким давлением примерно до 160℃, после чего она проходит процедуру анаэробного (то есть в отсутствие кислорода) разложения. В результате получается биогаз, который потом и становится источником энергии.
Биомассу нагревают под высоким давлением примерно до 160℃, после чего она проходит процедуру анаэробного (то есть в отсутствие кислорода) разложения. В результате получается биогаз, который потом и становится источником энергии.
«Когда в следующий раз вы будете нажимать на кнопку слива в своем туалете в столице [американской] нации, учтите, что вы — или, точнее, то, что вы слили, — помогает генерировать чистую энергию», — писала газета Washington Post.
Не только биомасса годна для переработки в топливо, но и твердый мусор. Это хорошо усвоили в Швеции — процент мусора, который отправляется на свалки, там стремится к нулю. Почти все отходы перерабатываются, в том числе в тепло и электричество. Мусор же на свалках выделяет метан и вредит экологии.
С этим также пытаются бороться британские компании Bio-Bean и Celtic Renewables. Первая была основана в 2013 году и занимается переработкой отходов кофейной индустрии в биотопливо. Среди ее партнеров — крупная сеть кофеен Costa Coffee, чьи производственные отходы на территории Британии составляют примерно 3 тысячи тонн в год.
Celtic Renewables же занимается сбором и переработкой отходов от производства скотча, которым занимается сотня вискокурен в Шотландии. Чистый виски на выходе из дистиллятора составляет лишь 10% от общего объема сырья, остальное идет в отходы.
Celtic Renewables перерабатывает эти отходы в электричество, а также путем ABE-брожения (процесса ацетоно-бутилового разложения углеводов, открытого в начале XX века химиком Хаимом Вейцманом) синтезирует топливо для дизельных двигателей. В июле 2017 года компания впервые продемонстрировала автомобиль на своем «вискотопливе».
Автор фото, Alexander Hassenstein/Getty Images
Подпись к фото,Современный самолет может летать не только на авиакеросине
Возможно, уже скоро заправка автомобиля топливом, полученным из виски или кофе, перестанет казаться чем-то из ряда вон выходящим. Как и самолет на растительном масле.
В мае 2017 года авиакомпания Singapore Airlines отправила в рейс Сан-Франциско — Сингапур первый лайнер, заправленный керосином с добавкой топлива из отработанного растительного масла. Тогда компания объявила, что планирует запустить по этому маршруту еще 12 таких рейсов в течение трех последующих месяцев.
Тогда компания объявила, что планирует запустить по этому маршруту еще 12 таких рейсов в течение трех последующих месяцев.
Ранее на подобное решилась китайская авиакомпания Hainan Airlines в марте 2015 года — ее самолет выполнил рейс из Шанхая в Пекин на топливе, частично синтезированном из отработанного растительного масла.
Биотопливо, сделанное из масла, при сгорании выделяет меньше вредных веществ, чем нефтепродукты. Кроме того, его использование позволит снизить потребность в добыче углеводородов.
Но у него есть и минусы: эксперты опасаются, что переход на растительное биотопливо повлечет вырубку лесов ради расширения плантаций пальм, из которых добывают масло.
.
Структура, свойства и использование K2CO3
Карбонат калия представляет собой неорганическое химическое вещество, содержащее калий, углерод и кислород. Кроме того, хорошо известна способность калия отдавать один электрон для создания стабильной электронной структуры октета в самой внешней оболочке. В результате формула карбоната калия будет содержать два иона калия и один анион карбоната. Следовательно, он имеет химическую формулу K 2 CO 3 . Альтернативные названия включают дикарбонат калия, жемчужную золу и карбонат калия.
В результате формула карбоната калия будет содержать два иона калия и один анион карбоната. Следовательно, он имеет химическую формулу K 2 CO 3 . Альтернативные названия включают дикарбонат калия, жемчужную золу и карбонат калия.
Согласно формуле карбоната калия, это белый минерал, который разделяется на калий и карбонат ионов при смешивании с водой. Из-за своей способности удерживать частицы воды он часто приобретает вид влажного или мокрого материала.
В следующей таблице перечислены некоторые типичные физические характеристики карбоната калия, включая его молярную массу:
- Карбонат калия Молярная масса составляет 138,21 г/моль, рассчитанная по формуле карбоната калия.
- Вещество имеет плотность 2,43 г/см3.
- Его статус белого гигроскопичного твердого вещества, то есть его способность удерживать молекулы воды, хорошо описан.

- 891°C — температура плавления. У него нет температуры кипения, потому что он разрушается при нагревании до очень высоких уровней.
- Так же, как сульфат калия, является огнеупорным веществом.
Структуры включают два катиона калия, присоединенные к центральному углеродному аниону, 9000 3 CO 3 2 . При температуре ниже -47𝇈C он также имеет тенденцию быть ценным камнем. Кроме того, его сложная структура может быть представлена следующим образом, используя стандартные представления для природных частиц.
Производство карбоната калия ( K 2 CO 3 )- Взаимодействие с участием калия гидроксид и диоксид углерода производят сульфат калия для промышленного использования.
 Сбалансированное химическое взаимодействие для получения K 2 CO 3 в качестве конечного продукта выглядит следующим образом:
Сбалансированное химическое взаимодействие для получения K 2 CO 3 в качестве конечного продукта выглядит следующим образом:
2KOH + CO 2 → K 2 CO 3 + H 2 O
- Подобно тому, как производится сульфат калия, промышленность также может производить карбонат калия таким же образом. Этот процесс заставляет хлорид калия взаимодействовать с диоксидом углерода, когда присутствует молекула ароматического амина, с образованием бикарбоната калия в качестве побочного продукта. При восстановлении бикарбоната калия образуются карбонат калия, вода и углекислый газ. Следующее скорректированное химическое уравнение представляет собой химическую формулу карбоната калия, а также других веществ:
2KHCO 3 → K 2 CO 3 + H 2 O + CO 2
Более современный , но все еще грубый, способ производства карбоната калия заключается в сжигании смеси мелкодисперсных молотый нитрат калия и углерод (или нитрат калия и сахар), обычно в виде кокса или древесного угля. Чтобы обеспечить реакцию всего нитрата калия, используйте избыток углерода и тщательно перемешайте два реагента.
Чтобы обеспечить реакцию всего нитрата калия, используйте избыток углерода и тщательно перемешайте два реагента.
Рассмотрим следующие применения карбоната калия:
- K 2 CO 3 название соединения – карбонат калия, который является первичным материал в легкой промышленности, фармацевтическом секторе и в основной неорганической химической обработке. Он в основном использовался для изготовления электродных трубок, сборок оптических трубок, телевизионных трубок, расходных материалов для печати, лампочек, красителей, фотооборудования, пигментов, гальванических покрытий, полиамидного порошка, воловьей кожи, кристаллов, калийных моющих средств, фармацевтических препаратов и керамических строительных материалов.
- Сухой порошок, средство для защиты резины и адсорбция газа находятся на обратной стороне.

- Синтез-газ, полученный при производстве химических удобрений, может уменьшить выбросы углекислого газа с помощью этого вещества.
- Кроме того, он служит калийным удобрением.
- Кроме того, это расширяет спектр его применения в различных отраслях промышленности, включая гастрономию, производство продуктов питания и моющих средств.
Гидрокарбонат калия представляет собой монокалиевую форму угольной кислоты. Он используется в органическом сельском хозяйстве для борьбы с грибковым ростом и гнилью яблок, поскольку обладает фунгицидными свойствами. Он действует как пестицид, контролирующий кислотность пищи, и как противогрибковое средство.
Гидрокарбонат калия представляет собой как органическую, так и калиевую соль. Основное различие между карбонатом калия и гидрокарбонатом калия заключается в наличии одного иона водорода в молекулах гидрокарбоната калия, а не в молекулах карбоната калия. Оба они являются солями калия, что делает их очень щелочными веществами.
Оба они являются солями калия, что делает их очень щелочными веществами.
По сравнению с другими осушителями, такими как хлорид кальция и сульфат магния, это щадящий осушитель. Он может не работать с кислотными веществами и не подходит для них. Однако, если в органической фазе присутствует небольшое количество кислого загрязнителя, это может помочь высушить фазу. Перед дистилляцией его можно использовать для отверждения части метиловых эфиров, кетонов и других органических соединений.
2. Пищевая промышленность : Он используется при приготовлении травяного желе, популярного блюда в Юго-Восточной Азии и Китае, наряду с китайской вермишелью, вытянутой вручную, и лунным пирогом, которые являются обычными приложениями для него в еда. Используется для размягчения спелых ягод. Рубец — это форма слизистой оболочки желудка, которую вы можете есть у различных сельскохозяйственных животных. Рубец в основном поступает от крупного рогатого скота, свиней и овец.
Используется для размягчения спелых ягод. Рубец — это форма слизистой оболочки желудка, которую вы можете есть у различных сельскохозяйственных животных. Рубец в основном поступает от крупного рогатого скота, свиней и овец.
Часто используется в качестве ингредиента для выпечки в рецептах немецких имбирных пряников. Чтобы избежать травм, потребление карбоната калия должно быть ограничено до определенного уровня, и использование без присмотра настоятельно не рекомендуется.
3. Шоколадная промышленность:Регулируя pH (т. е. снижая кислотность) органических кофейных зерен в какао-порошке, подщелачивание может создать голландский технологический шоколад с усилением аромата. Датчинг относится к технике настаивания какао-порошка с карбонатом калия. Полученные продукты метко называют какао-порошком голландской переработки. Голландец впервые создал процедуру в 1828 году.
4. Фармацевтическая промышленность : Шипучие таблетки также содержат карбонат калия. Низкий уровень калия в организме возникает из-за недостаточного питания, тошноты, рвоты, диареи или приема определенных лекарств, таких как кортикостероиды или диуретики. В таких случаях для введения калия назначают шипучие таблетки и порошки. Они быстро распадаются, прочны, практичны и легки.
Низкий уровень калия в организме возникает из-за недостаточного питания, тошноты, рвоты, диареи или приема определенных лекарств, таких как кортикостероиды или диуретики. В таких случаях для введения калия назначают шипучие таблетки и порошки. Они быстро распадаются, прочны, практичны и легки.
K 2 CO 3 с составным названием карбонат калия, широко известный как жемчужный пепел из-за его белого цвета, является odou бесцветный порошок. Он используется в жидких шампунях, тональных кремах, молниеносных кремах, средствах от прыщей и в промышленном производстве мыла. Пожалуйста, избегайте прямого воздействия, так как в своей естественной форме он вызывает разъедание кожи.
Информация о безопасности карбоната калия- Контакт с кожей:
Может вызывать раздражение и отек кожи. Исследования ученых этого соединения показывают, что это вещество не является сенсибилизатором кожи.
 Исследования кожной сенсибилизации оценивают способность вещества изменять иммунную систему таким образом, что последующее прикосновение приводит к более интенсивной реакции, чем первоначальное.
Исследования кожной сенсибилизации оценивают способность вещества изменять иммунную систему таким образом, что последующее прикосновение приводит к более интенсивной реакции, чем первоначальное. - Попадание в глаза:
Может раздражать конъюнктиву и вызывать сильную эритему век. Попадание в глаза в течение длительного времени без лечения может нанести серьезный и необратимый вред вашим глазам.
- Проглатывание:
Пищевод, покраснение полости рта, волдыри, дискомфорт, воспаление кишечника и кишечника, отек и сыпь могут возникнуть в результате приема внутрь этого вещества. Чрезмерное употребление может привести к тошноте, язвам, судорогам и даже смерти.
- Вдыхание:
Вдыхание этого вещества может раздражать верхние дыхательные пути, вызывая кашель и вызывая эритему рта и дыхательного горла.
В случае непреднамеренного контакта
- Контакт с глазами:
Если кислота случайно попала в глаза, тщательно промывайте их водой в течение не менее 30 минут, поднимая верхние и нижние веки.
 Снимите все контактные линзы, которые вы носите. Запишитесь на прием к врачу прямо сейчас.
Снимите все контактные линзы, которые вы носите. Запишитесь на прием к врачу прямо сейчас. - Контакт с кожей:
При попадании на кожу немедленно снимите зараженную одежду. Тщательно промойте кожу большим количеством воды.
- Вдыхание:
Если кто-то его вдохнет, вывести его из зоны. Если сердце перестало качать кровь, сделайте сердечно-легочную реанимацию; если дыхание остановилось, начать искусственное дыхание.
К 2 СО 3 , с названием соединения карбонат калия, представляет собой неорганическое вещество, в основном полученное из поташа. Это белый порошок, который растворяется в жидкости. Он имеет тенденцию становиться жидкостью и часто принимает форму влажного или влажного твердого вещества. Среди многих названий карбоната калия — жемчужная зола, карбонат калия, соль винного камня и калий. Он часто бывает в виде кристаллизованного порошка или гранул. Он не имеет цвета, запаха и прозрачности.
Он часто бывает в виде кристаллизованного порошка или гранул. Он не имеет цвета, запаха и прозрачности.
Поташ можно производить различными способами, хотя обычно его производят на заводах с использованием метода электролиза. Среди многих применений карбоната калия — производство химических соединений, удобрений, моющих средств и термостойкой стеклянной посуды. Стекло и мыло — два основных продукта, изготавливаемых с использованием карбоната калия.
Часто задаваемые вопросы Q1. Является ли карбонат калия летучим соединением? A: Да, K 2 CO 3 является реактивным. Карбонат калия растворяется в воде с образованием щелочного раствора. Однако, когда он реагирует с кислотами, он образует воду, соль и углекислый газ в жидкой фазе. Вот химическая реакция: Благодаря фундаментальным характеристикам этого вещества, оно использовалось в некоторых продуктах питания в качестве стабилизатора, кондиционера для воды и регулятора кислотности.
A: Хотя не все из них подходят для смешивания с пищей, пищевые карбонаты калия легко доступны в продаже. Сопоставимый карбонат калия можно добавлять в пищу без риска. Это мощная основа, поэтому, если бы нам дали больше, чем скромное количество, это было бы не очень приятно на вкус.
Q3. Почему карбонат калия вступает в игру при изготовлении мыла?A: Мыло производится из карбоната калия, иногда называемого поташем. Будучи основным веществом, он действует как наполнитель, нейтрализуя жирные кислоты в мылах. Омыление — это метод, при котором жирные кислоты превращаются в мыла с помощью раствора щелочи или карбоната калия.
Карбонат калия – структура, свойства и использование K2CO3
Что такое карбонат калия?
K 2 CO 3 представляет собой неорганическое соединение с химическим названием Карбонат калия.
Его также называют Карбонат калия, или двукалийный карбонат, или жемчужная зола. Дикалиевая соль угольной кислоты. Он широко используется в производстве стекла и мыла.
Перламутровая зола гигроскопична, расплывается в порошке белого цвета. Он не имеет запаха и имеет щелочной вкус. Он хорошо растворим в воде, но не растворим в этаноле, ацетоне и спирте. Он имеет рН 11,6. Это основной компонент калия.
Исторически сложилось так, что карбонат дикалия был получен путем обжига поташа в печи. Полученный белый порошок представлял собой карбонат калия. В 179 году0, Сэмюэл Хопкинс получил первый патент, выданный Патентным ведомством США, на усовершенствованный метод получения жемчужной золы и поташа.
Содержание
- Свойства карбоната калия
- Структура карбоната калия
- Использование карбоната калия
- Производство карбоната калия
- Опасности для здоровья
- Часто задаваемые вопросы
Свойства карбоната калия – K
2 СО 3| К 2 СО 3 | Карбонат калия |
| Молекулярная масса/молярная масса K 2 CO 3 | 138,205 г/моль |
| Плотность карбоната калия | 2,43 г/см 3 |
| Температура кипения карбоната калия | Разлагается |
| Температура плавления карбоната калия | 891 °С |
Структура карбоната калия – K
2 CO 3Структура карбоната калия – K 2 CO 3
K
2 CO 3 Применение (карбонат калия)- Карбонат калия используется в качестве мягкого осушителя.

- Используется для приготовления травяного желе.
- Используется для производства голландского шоколада путем подщелачивания.
- Используется в производстве проволоки или медовухи в качестве буферного агента.
- Используется для смягчения жесткой воды.
- Используется в сварочных флюсах.
- Используется в качестве средства пожаротушения.
Производство карбоната калия
1. Его получают в промышленных масштабах путем взаимодействия гидроксида калия (КОН) с диоксидом углерода (CO 2
2 KOH + CO 2 → K 2 CO 3 + H 2 O
2. Альтернативным методом является обработка хлорида калия двуокисью углерода в присутствии органического амина с получением бикарбоната калия, который затем прокаливают с получением карбоната калия.
2 KHCO 3 → K 2 CO 3 + H 2 O + CO 2
Опасности для здоровья
Перламутровая зола негорючая. При попадании на кожу, глаза и дыхательные пути может вызвать раздражение.
При попадании на кожу, глаза и дыхательные пути может вызвать раздражение.
Часто задаваемые вопросы
Каковы области применения карбоната калия?
Карбонат калия широко используется для производства стекла и мыла. Он также используется в качестве сушильного агента, который является мягким по своей природе. Многие процессы производства вина включают использование этого соединения в качестве буферного агента. Карбонат калия также используется в качестве средства пожаротушения.
Как можно получить карбонат калия?
Карбонат калия промышленно получают с помощью реакции с участием двуокиси углерода и гидроксида калия. В альтернативном методе хлорид калия можно обработать диоксидом углерода в присутствии органического амина с получением бикарбоната калия, который затем прокаливают с получением карбоната калия
.Отметьте растворимость карбоната калия в воде.
Карбонат калия хорошо растворим в воде. Однако при растворении в воде это соединение диссоциирует на ионы калия и карбоната.
