ПАТИНА: ЧТО ЭТО ТАКОЕ? | Наука и жизнь
Собор в Хильдесхайме (Германия), кровля которого не нуждается в замене уже около 700 лет.‹
›
Слово патина (итал. patina) обозначает пленку различных оттенков, образующуюся на поверхности меди и медьсодержащих сплавов под воздействием атмосферных факторов при естественном или искусственном старении. Иногда патиной называют пленки оксидов на поверхности металлов, а также пленки или слои, возникающие со временем на поверхности камня, например мрамора, или деревянных предметов.
Первые сведения об изготовлении медных изделий человеком относятся к IV-III тысячелетиям до н. э., и с той поры люди постоянно сталкиваются с медной патиной разных типов. Особенно много оттенков патины бывает на старинных монетах из медных сплавов: зеленый, оливковый, черный, красный, голубой, землистый и другие. Цвет часто зависит от типа почвы, в которой найдена монета, а также от условий ее хранения. Многообразие оттенков обусловлено возможностью перехода от зеленого через оливковый в черный цвет.
При атмосферном старении изделий из меди и двух ее основных сплавов — бронзы и латуни — образуются карбонаты меди: ярко-зеленый малахит Cu2(CO3)(OH)2 и лазурно-голу бой азурит Cu3(CO3)2(OH) 2. Для цинксодержащей латуни возможно образование зелено-синего розазита состава (Сu,Zn)2(СO3)(OH) 2. Основные карбонаты меди можно легко синтезировать в домашних условиях, приливая водный раствор кальцинированной соды к водному раствору соли меди, например медного купороса. При этом в начале процесса, когда в избытке находится соль меди, образуется продукт, более близкий по составу к азуриту, а в конце процесса — при избытке соды — к малахиту.
В естественных условиях зеленая патина образуется на поверхности медного кровельного листа в течение 5-25 лет, в зависимости от климата и химического состава атмосферы и осадков. В первые 3-6 месяцев медь тускнеет, затем за 1-3 года постепенно приобретает темно-коричневый цвет и только потом — зеленый.
В географических зонах с относительно высоким содержанием солей хлора в воде и воздухе, то есть вблизи морей, изделия из меди и медных сплавов подвергаются разрушительному воздействию хлоридов меди (I и II), которые участвуют в сложном циклическом процессе окисления меди с участием воды и кислорода. В результате реакций образуются основные хлориды меди: темно-зеленый атакамит, синевато-зеленый боталлакит и зеленый паратакамит состава Cu2Cl(OH)3. Эти соединения являются изомерами, то есть у них одинаковый химический состав, однако они отличаются строением кристаллических решеток, что приводит к различию в цветовых оттенках и к разным физическим свойствам.
Естественное образование патины на поверхности меди препятствует ее дальнейшей коррозии. При этом важно, чтобы не менялся химический механизм ее образования, так как в противном случае можно получить обратный эффект. Толстые, 3-6-миллиметро вые, кованые листы кровельной меди, которые использовали мастера в древности, обладают высокой атмосферо стойкостью. Рекордсменом, по-видимому, является медная крыша собора в Хильдесхайме в Нижней Саксонии (Германия), которому уже 700 лет.
Толстые, 3-6-миллиметро вые, кованые листы кровельной меди, которые использовали мастера в древности, обладают высокой атмосферо стойкостью. Рекордсменом, по-видимому, является медная крыша собора в Хильдесхайме в Нижней Саксонии (Германия), которому уже 700 лет.
Декоративные свойства патины толкают производите лей кровельной меди, а также людей, занимающихся декоративной обработкой металлов, на совершенствование способов ускоренного образования патины. Ряд фирм уже выпускают и реализуют искусственно состаренный медный кровельный лист.
Цинк и его сплавы — производство, свойства, виды и применение
Цинк — хрупкий голубовато-белый металл. В природе без примесей не встречается. В 1738 году Уильям Чемпион добыл чистые пары цинка с помощью конденсации. В периодической системе Менделеева находится под номером 30 и обозначается символом Zn.Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.

- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м2.
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 | |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | — | 2,5 |
* В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%.
** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%.
|
|||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Производств цинка
Добыча металла
Цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).
Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).
Концентраты цинка обжигают в печах. Сульфид цинка переводится в оксид ZnO. При этом выделяется сернистый газ SO2, который используется в производстве серной кислоты.
Получение металла
Существуют два способа получения чистого цинка из оксида ZnO.
Самый древний метод — дистилляционный. Обожженный концентрированный состав подвергают термообработке, чтобы придать ему зернистость и газопроницаемость.
Затем концентрат восстанавливают коксом или углем при температуре 1200–1300 °C. В процессе образуются пары металла, которые конденсируют и разливают в изложницы. Жидкий металл отстаивают от железа и свинца при температуре 500 °C. Так достигается цинк чистотой 98,7%.
Иногда используется сложная и дорогая обработка цинка ректификацией — разделением смесей за счет обмена теплом между паром и жидкостью. Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Второй метод производства цинка — электролитический. Обожженный концентрат обрабатывается серной кислотой. Готовый сульфатный раствор очищается от примесей, после чего подвергается электролизу в свинцовых ваннах. Цинк дает осадок на алюминиевых катодах. Полученный металл удаляют с ванн и плавят в индукционных печах. После этого получается электролитный цинк чистотой 99,95%.
Литье металла
Горячий цинк — жидкий и текучий металл. Благодаря таким свойствам он легко заполняется в литейные формы.
Примеси влияют на величину натяжения поверхности цинка. Технологические свойства металла можно улучшить, добавив небольшое количество лития, магния, олова, кальция, свинца или висмута.
Чем выше температура перегрева цинка, тем лучше он заполняет формы. При литье металла в чугунные изложницы его объем уменьшается на 1,6%. Это затрудняет получение крупных и длинных цинковых отливок.
Применение цинка
Для защиты металлов от коррозии
Чистый цинк используется для защиты металлов от коррозии. Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
В автомобильной отрасли
Сплавы на цинковой основе используют для оформления декора автомобильного салона, в производстве ручек дверей, замков, зеркал и корпусов стеклоочистителей.
В автомобильные покрышки добавляют окись цинка, которая повышает качество резины.
В батарейках, аккумуляторах и других химических источниках тока цинк используется как материал для отрицательного электрода. В производстве электромобилей применяются цинк-воздушные аккумуляторы, которые обладают высокой удельной энергоемкостью.
В производстве ювелирных украшений
Ювелиры добавляют цинк в сплавы на основе золота. В итоге они легко поддаются ковке и становятся пластичными — прочно соединяют мелкие детали изделия между собой.
Металл также осветляет ювелирные изделия, поэтому его часто используют в изготовлении белого золота.
В медицине
Окись цинка применяется в медицине как антисептическое средство. Окись добавляют в мази и другие составы для заживления ран.
Окись добавляют в мази и другие составы для заживления ран.
Благодаря своим свойствам, цинк широко применяется в различных областях промышленности. Металл пользуется спросом из-за относительно низкой цены и хороших физических свойств.
Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Водные растворы и смеси для обработки металлов — мытья, обезжиривания, нанесения покрытий, очистки и т.п. Составы для очистки и обезжиривания поверхности и нанесения покрытий.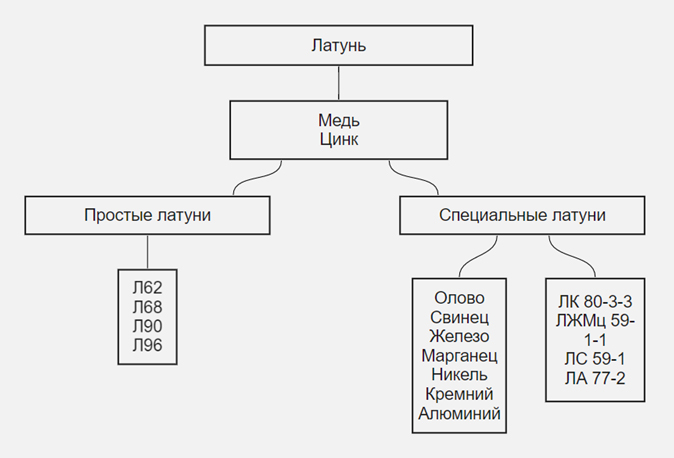 / / Обезжиривающие водные растворы и органические растворители. Составы для очистки и обезжиривания поверхности. / / Составы обезжиривающих водных растворов для меди и медных сплавов (медь, бронзы и латуни). Обезжиривание меди, бронзы и латуни. / / Обезжиривающие водные растворы и органические растворители. Составы для очистки и обезжиривания поверхности. / / Составы обезжиривающих водных растворов для меди и медных сплавов (медь, бронзы и латуни). Обезжиривание меди, бронзы и латуни.Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нанопорошок латуни — Металлические нанопорошки
Образец сертификата
Разработан компанией ООО «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ», Россия.
Соответствует ТУ 1791-003-36280340-2008
Идентификаця продукта
ЭТИКЕТКА ИДЕНТИФИКАЦИИ: торговое наименование: НАНОПОРОШОК ЛАТУНИ; химическое наименование: нанопорошок сплава медь-цинк; химическая формула: CuZn. Нанопорошок получен методом электрического взрыва проводника в атмосфере аргона и упакован в стеклянные ампулы в инертной атмосфере.
Химический состав
Материал содержит около 60% меди и 40% цинка. Адсорбированные газы (воздух, аргон, оксид углерода) не определялись. При контакте с воздухом содержание активного металла падает до 85-90 %.
Физические и химические свойства
Порошок золотистого цвета. Среднеарифметический размер частиц 50-80 нм. Отдельные частицы имеют размер 70-200 нанометров и образуют микроагломераты. Насыпная плотность около 3 г/см³. Температура плавления в инертной атмосфере 900°С. Может воспламеняться при непродолжительном контакте (до 30 с) с низкокалорийным источником (например, горящая спичка).
Опасность
Порошок латуни — горючий металлический порошок, который может давать открытое пламя.
Угроза для здоровья
Неприятная пыль, которая может оказать общетоксическое действие и вызвать раздражение органов дыхания. Предельно допустимая среднедневная концентрация — 0,22 мг/м³. При постоянном контакте может вызвать хронические заболевания органов дыхания и заболевание почек и печени. Вредного действия на окружающую среду не оказывает и не требует специальных мер предосторожности.
Меры предосторожности в работе
Применять средства защиты как в работе с пылью. Использовать респираторы. Не допускать контакта с открытым огнем.
Бериллиевая бронза БрБ2
БрБ2 — это безоловянная бериллиевая бронза, обрабатываемая давлением. Химический состав сплава БрБ2 описан в ГОСТ 18175-78 и включает в себя следующие компоненты: медь 96,9-98,0 %, бериллий 1,8-2,1 %, никель 0,2-0,5 % и до 0,5 % примесей.
Сплав выделяется среди прочих бронз высокой износостойкостью и стойкостью к коррозионной усталости. Наряду с другими бронзами БрБ2 обладает хорошими антифрикционными и пружинящими свойствами, а также средними тепло и электропроводностью, что обуславливает применение ленты и проволоки БрБ2. Кроме того можно улучшить механические качества этого сплава, если подвергнуть его процедурам закалки и старения. Так, например, широко используют пруток БрБ2Т.
Свойства БрБ2
Рассмотрим свойства бериллиевой бронзы марки БрБ2 — химические, технологические, механические, физические.
Химический состав БрБ2
| Fe | Si | Ni | Al | Cu | Pb | Be | Примесей |
| до 0.15 | до 0.15 | 0.2 — 0.5 | до 0.15 | 96.9 — 98 | до 0. 005 005 |
1.8 — 2.1 | всего 0.5 |
Примечание: Cu — основа; процентное содержание Cu дано приблизительно
| Температура плавления БрБ2 | 955 °C |
| Температура горячей обработки БрБ2: | 750 — 800 °C |
| Температура отжига БрБ2: | 530 — 650 °C |
| Сортамент | Предел кратковременной прочности sв | Предел пропорциональности (предел текучести дляостаточной деформации) sT | Относительное удлинение при разрыве d5 |
| — | МПа | МПа | % |
Проволока мягк. , ГОСТ15834 — 77 , ГОСТ15834 — 77 |
343-686 | 15-60 | |
| Проволока тверд.,ГОСТ 15834 — 77 | 735-1372 | ||
| Полоса мягк., ГОСТ1789-70 | 390-590 | 20-30 | |
| Полоса твердая, ГОСТ1789-70 | 590-930 | 2.5 | |
| Сплав мягкий , ГОСТ1789-70 | 400-600 | 196-344 | 40-50 |
| Сплав твердый, ГОСТ1789-70 | 600-950 | 588-930 | 2-4 |
Твердость прутков из БрБ2 прописана в ГОСТ 15835-2013 (взамен ГОСТ 15835-70)
| Твердость БрБ2, Пруток мягкий ГОСТ 15835-2013 | HB 10 -1= 100 — 150 МПа |
| Твердость БрБ2, Пруток твердый ГОСТ 15835-2013 | HB 10 -1= 150 МПа |
HB — Твердость по Бринеллю бериллиевой бронзы
| Температура T | Модуль упругости первого рода E 10-5 | Коэффициент температурного (линейного) расширения a10 6 | Теплоемкость l | Плотность | Удельная теплоемкость C | Удельное электросопротивление R 109 |
| Град | МПа | 1/Град | Вт/(м·град) | кг/м3 | Дж/(кг·град) | Ом·м |
| 20 | 1. 31 31 |
84 | 8200 | 70 | ||
| 100 | 16.6 | 419 |
| США | Германия | Япония |
| DIN,WNr | JIS | |
Применение бериллиевой бронзы БрБ2
Прутки из бронзы БрБ2 применяются в приборостроении и автомобилестроении. Ленты БрБ2 также применяются в приборостроении и производстве упругих и пружинящих деталей. Аналогичное применение нашла проволока в машиностроении и приборостроении. Бронза БрБ2 используется в различных областях производства. Из неё изготавливают антифрикционные детали и пружинящие детали: пружинящие детали и пружины. Из неё изготавливают детали ответственного назначения. Также из неё изготавливают неискрящие инструменты.
Аналогичное применение нашла проволока в машиностроении и приборостроении. Бронза БрБ2 используется в различных областях производства. Из неё изготавливают антифрикционные детали и пружинящие детали: пружинящие детали и пружины. Из неё изготавливают детали ответственного назначения. Также из неё изготавливают неискрящие инструменты.
Технологические характеристики позволяют изготавливать из бериллиевых бронз сложные отливки высокого качества, но обычно детали из них производят из заготовок, подвергнутых предварительной пластической деформации (листы и полосы, проволока, ленты и др). Широкое применение сплавов бериллиевой группы обусловлено еще и тем, что они хорошо поддаются различным видам обработки, а для соединения деталей из них можно использовать все известные способы (сварка и пайка).
Пайка и сварка БрБ2
Пайку бериллиевых бронз следует выполнять сразу же, как была выполнена тщательная механическая зачистка соединяемых элементов. В качестве припоя при выполнении такой технологической операции используются сплавы на основе серебра, а в защитном флюсе, использование которого необходимо, должны в обязательном порядке содержаться фтористые соли. Высокое качество пайки деталей из данных сплавов обеспечивает технология, предполагающая выполнение соединения в вакууме и использование слоя защитного флюса.
Высокое качество пайки деталей из данных сплавов обеспечивает технология, предполагающая выполнение соединения в вакууме и использование слоя защитного флюса.
Детали из бериллиевых бронз не соединяют при помощи электродуговой сварки, для этого успешно используют другие технологии: точечную, шовную, роликовую и сварку в среде инертных газов. Такое ограничение в применении электродуговой сварки обусловлено тем, что сплавы данной группы обладают большим температурным интервалом кристаллизации. Кроме этого, сварку бронз бериллиевой группы нельзя выполнять после термической обработки, что обусловлено их особыми механическими свойствами.
Износостойкость и коррозионной устойчивость бронзы БрБ2
Детали из бериллиевой бронзы не истираются и в то же время бережно воздействуют на сопрягаемые механизмы, хорошо сопрягаются с друг другом, полируются и идеальным образом взаимодействуют в механизмах при заданных параметрах. Но даже если условия эксплуатации нарушены, детали из БрБ2 способны выдерживать большие нагрузки трения и других механических воздействий. При работе механизмов в ходе изнашивания БрБ2 не откалывается большими кусками, а истирается постепенно, давая очень мелкую стружку.
При работе механизмов в ходе изнашивания БрБ2 не откалывается большими кусками, а истирается постепенно, давая очень мелкую стружку.
Коррозионная усталость – это один из показателей коррозионной стойкости металлов. Когда детали работают под воздействием большой массы, циклических динамических нагрузок в коррозионной среде, велика вероятность выхода из строя конструкций, в которых они используются. Сплав БрБ2 хорошо проявляет себя в различных коррозионных средах и может быть использован для изготовления ответственных деталей, так как коррозия проявляется достаточно медленно и не оказывает значительного воздействия на механические и физические свойства деталей из этого материала долгое время. Однако, под действием влажных паров аммиака и воздуха бериллиевые бронзы склонны к межкристаллизационной коррозии и растрескиванию. В газовой среде, насыщенной галогенами (фтором, бромом, хлором и йодом), на их поверхности образуются галогениды бериллия, из-за чего происходят уменьшение его концентрации в сплаве. Особенно активно процесс взаимодействия с галогенами происходит при повышенных температурах. В связи с этим, бериллиевую бронзу БрБ2 не рекомендуют использовать для изготовления деталей, эксплуатируемых в указанных газах.
Особенно активно процесс взаимодействия с галогенами происходит при повышенных температурах. В связи с этим, бериллиевую бронзу БрБ2 не рекомендуют использовать для изготовления деталей, эксплуатируемых в указанных газах.
Облагораживание и закалка БрБ2
Путём облагораживания изделия из БрБ2 получаются более твёрдыми и более пластичными. Соответственно выпускаются полуфабрикаты в мягком (М) и твёрдом (Т) состоянии. В ходе процедуры закалки металл нагревают до некоторой температуры, после чего остужают в воде. В результате пластичные свойства металла повышаются и его применяют для изготовления деталей путём прокатки, ковки, вытяжки и гибки в холодном состоянии. Также выпускаются полуфабрикаты из БрБ2 с закалкой и холодной деформацией. БрБ2 закаливают при температуре 750-790 °C, после чего сплав отпускают при температуре в пределах 300-350 °C. После холодной деформации механические качества твёрдости, прочности и текучести улучшаются. БрБ2 Т выделяется среди прочих бронз самым высоким показателем прочности на растяжение. Медно-бериллиевый сплав БрБ2, подвергаемый термическому закаливанию, становится более прочным, упругим и пластичным. Первоначально его приводят в мягкое состояние, нагревая до 760-780°С, а затем подвергают старению в воде при температуре 310-330°С в течение 3 часов. При нагревании и последующем охлаждении сплава до комнатной температуры бериллий растворяется в меди с образованием насыщенного твердого раствора. Последующая закалка приводит к его осаждению, в результате чего бронза БрБ2 приобретает высокую твердость до 350 — 400 НВ.
Медно-бериллиевый сплав БрБ2, подвергаемый термическому закаливанию, становится более прочным, упругим и пластичным. Первоначально его приводят в мягкое состояние, нагревая до 760-780°С, а затем подвергают старению в воде при температуре 310-330°С в течение 3 часов. При нагревании и последующем охлаждении сплава до комнатной температуры бериллий растворяется в меди с образованием насыщенного твердого раствора. Последующая закалка приводит к его осаждению, в результате чего бронза БрБ2 приобретает высокую твердость до 350 — 400 НВ.
Формула Меди структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: Cu
Молекулярная масса: 63,546
Медь — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Cuprum). Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
История
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий. В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришел на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди. На Кипре уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае.
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришел на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди. На Кипре уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.). С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.). С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Нахождение в природе
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет. Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота. Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4. Медь обладает высокой тепло и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м[15]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком. Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет. Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота. Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4. Медь обладает высокой тепло и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м[15]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком. Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие. Атомная плотность меди (N0) = 8,52*1028(атом/м³).
Атомная плотность меди (N0) = 8,52*1028(атом/м³).
Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu и 65Cu с распространённостью 69,1 и 30,9 атомных процентов соответственно. Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°. Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём. Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди. Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
В расплав для связывания оксида железа добавляют кремнезём. Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди. Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
Химические свойства
Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
Вступает в реакцию при нагревании с галогеноводородами.
- На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины)
- Реагирует с концентрированной холодной серной кислотой
- С концентрированной горячей серной кислотой
- С безводной горячей серной кислотой
- C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха
- С концентрированной азотной кислотой
- С разбавленной азотной кислотой
- С «царской водкой»
- С концентрированной горячей соляной кислотой
- C разбавленной хлороводородной кислотой в присутствии кислорода
- С газообразным хлороводородом при 500—600 °C
- С бромоводородом
- Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода
- Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов
- Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C
- Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре
- При 300—400 °C реагирует с серой и селеном
- С концентрированной соляной кислотой и хлоратом калия
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства. Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют. В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I). Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства. Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов. Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют. В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I). Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет: Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы). Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску. Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы). Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску. Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724-0,0180 мкОм·м/), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[18], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[18], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры.
Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[19]. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[19]. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %. Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006. Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека. Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм.
Стоимость
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долл. в феврале 2011 г. На 2011 год стоимость меди составляет около $8900 за тонну. Вследствие торможения мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышает $4700.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных. Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных. Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка». В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта. Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка». В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта. Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»).
Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»).
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет. Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет. Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
| Компания | Тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 |
| Уралэлектромедь | 351 | 37 |
| Русская медная компания | 166 | 18 |
- Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
- США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).

По объёму мирового производства и потребления медь занимает третье место после железа и алюминия. Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили. 90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди. Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига. После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах.
Расположен в Чили. 90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди. Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига. После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C. С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине. Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Температура в зоне плавки — 1450 °C. С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине. Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования. Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной.
 Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков.
Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков. - В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов, не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).
- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов.
Какая химическая формула латуни? – Theburningofrome.com
Какова химическая формула латуни?
CuPbZn
Латунь | CuPbZn — PubChem.
Какие сплавы металлической латуни?
Латунь, сплав меди и цинка, имеющий историческое и непреходящее значение благодаря своей твердости и обрабатываемости.
Какова формула бронзы?
CuSn
Бронза
| Идентификационный номер PubChem | 15920287 |
|---|---|
| Структура | Найти похожие структуры |
| Молекулярная формула | CuSn |
| Синонимы | Бронза Медно-оловянный сплав медь; олово 158113-12-3 11099-34-6 Подробнее… |
| Молекулярный вес | 182.26 |
Какова формула сплава?
Сплав Деварда
| Идентификационный номер PubChem | 16211762 |
|---|---|
| Молекулярная формула | AlCuZn |
| Синонимы | Сплав Деварда 8049-11-4 алюминий,медь,цинк Al.Cu.Zn Сплав Деварда, п.а. Подробнее… |
| Молекулярный вес | 155,9 |
| Соединения компонентов | CID 23994 (цинк) CID 5359268 (алюминий) CID 23978 (медь) |
Какого цвета латунь?
Латунь против бронзы
| Латунь | Бронза | |
|---|---|---|
| Цвет: | Приглушенный желтый, чем-то похожий на золото, но более тусклый. | Красновато-коричневый. |
Что такое сплав нейзильбера?
Германское серебро представляет собой сплав меди, цинка и никеля, иногда также содержащий свинец и олово. Первоначально он был назван из-за своего серебристо-белого цвета, но термин «серебро» теперь запрещен для сплавов, не содержащих этот металл. Нейзильбер широко используется из-за его твердости и устойчивости к коррозии.
Какова формула латуни и бронзы?
Для бронзы используются обозначения C51000, C51100, C51900 и C52000 с содержанием Sn, как правило, 5%, 4%, 6% и 8% соответственно.В результате оба сплава обладают разной степенью физических и механических свойств, которые полезны при выборе в зависимости от применения материала.
Каков химический состав латунных сплавов?
Латунные сплавы. 60,66% меди, 36,58% цинка, 1,02% олова и 1,74% железа. Коррозионная стойкость, твердость и ударная вязкость делают его пригодным для морских применений.
Какой цветной металл, медь или латунь?
Как и медь, латунь представляет собой цветной металл красного цвета. Однако, в отличие от чистого металла, это металлический сплав, который в основном состоит из меди и цинка. Другие металлы, такие как свинец, олово, железо, алюминий, кремний и марганец, также добавляются для получения более уникальных комбинаций характеристик.
Однако, в отличие от чистого металла, это металлический сплав, который в основном состоит из меди и цинка. Другие металлы, такие как свинец, олово, железо, алюминий, кремний и марганец, также добавляются для получения более уникальных комбинаций характеристик.
Что прочнее медный сплав или латунь?
Добавление цинка повышает прочность и пластичность основного медного материала. Чем выше концентрация цинка, тем прочнее и пластичнее сплав. Высокопрочная латунь содержит ≥39% цинка.Как медный сплав, латунь обладает многими свойствами, характерными для меди.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Формулы патины для латуни, бронзы и меди
Научная компания собирала эти рецепты из разных источников на протяжении многих лет. Формулы не тестировались лично, поэтому нет гарантии, что они будут работать. Мы предлагаем использовать их сначала методом проб и ошибок, чтобы пользователь мог оценить их эффективность. Холодный процесс = Холодный раствор, Холодный металл, Холодная промывочная вода.
Горячий процесс = Горячий раствор, Горячий металл, Горячая промывочная вода.
ИНДЕКС
Выберите эффект окрашивания и узнайте, как создать его с помощью формулы.
Нажмите на название предпочтительного химического вещества, чтобы подтвердить цену и разместить заказ.
1. Светло-темно-коричневый
Ингредиенты
Процесс
Горячий или холодный процесс. (При использовании этого рецепта также сообщалось о красном или красновато-коричневом цвете.)
Вернуться к индексу
2. От коричневого до черного
Ингредиенты
Процесс
Горячий или холодный процесс. Каждый раз используйте свежий раствор.
Вернуться к индексу
3.Черновато-коричневый
Ингредиенты
Процесс
Горячий или холодный процесс. Смешайте в указанном порядке.
Вернуться к индексу
4. Флорентин Браун
Ингредиенты
Процесс
Горячий или холодный процесс. Эта старая итальянская формула дает богатую коричневую патину.
Вернуться к индексу
5. Античный зеленый
Ингредиенты
Процесс
Горячий процесс. Горячий раствор (от 180 до 190°F), металл горячий (200°F), холодная промывочная вода наносится после того, как металл остынет примерно до 100°F. Промойте раствором металлическую поверхность, дайте высохнуть, затем промойте деталь в прохладной воде. Повторяйте, пока не появится цвет.
Промойте раствором металлическую поверхность, дайте высохнуть, затем промойте деталь в прохладной воде. Повторяйте, пока не появится цвет.
Вернуться к индексу
6. Основной зеленый
Ингредиенты
Процесс
Горячий процесс, полупрозрачная патина. Нагрейте металл и нанесите свежую смесь для каждого окрашивания.
Вернуться к индексу
7. Синий Зеленый
Ингредиенты
Процесс
Горячий процесс. Горячий раствор (от 180 до 190°F), металл горячий (200°F), холодная промывочная вода наносится после того, как металл остынет примерно до 100°F.Промойте раствором металлическую поверхность, дайте высохнуть, затем промойте деталь в прохладной воде. Повторяйте, пока не появится цвет. Желто-зеленый окуните в разбавленную азотную кислоту, затем промойте и высушите.
Вернуться к индексу
8. Холодный процесс Зеленый
Ингредиенты
Процесс
Холодный процесс, непрозрачная патина. Результаты лягушачьей зелени после нескольких применений с интервалом в 1/2 часа. Цвет не является удовлетворительным в одиночку. Хорошо сочетается с большинством коричневых и черных патин холодного производства.
Результаты лягушачьей зелени после нескольких применений с интервалом в 1/2 часа. Цвет не является удовлетворительным в одиночку. Хорошо сочетается с большинством коричневых и черных патин холодного производства.
Вернуться к индексу
9.Светло-зеленый
Ингредиенты
Процесс
Горячий процесс. Раствор и металл в горячем состоянии (от 140 до 160°F).
Вернуться к индексу
10. Зеленый
Ингредиенты
Процесс
Холодный процесс, который, как говорят, хорошо работает на латуни.
Вернуться к индексу
11. Зелено-синий (фламандский)
Ингредиенты
Процесс
Температура от 170 до 190°F, горячий процесс, особенно для латуни.
Вернуться к индексу
12. От фиолетового до светло-зеленого
Ингредиенты
Процесс
Массовые части. Ранние стадии этого рецепта производят фиолетовый цвет. Дополнительные применения и химическое воздействие делают металл светло-зеленым.
Дополнительные применения и химическое воздействие делают металл светло-зеленым.
Вернуться к индексу
13. Прозрачный синий
Ингредиенты
Процесс
Прозрачная патина методом погружения. Необходим консервант, такой как восковая паста или полиуретан.При использовании водопроводной воды может образовываться серо-синий цвет.
Вернуться к индексу
14. Синий
Ингредиенты
Процесс
Нанесите кистью на поверхность.
Вернуться к индексу
15. Соломенно-желтый
Ингредиенты
Процесс
Нагрейте металл и нанесите горячую жидкость.
Вернуться к индексу
16. Золотисто-желтый
Ингредиенты
Процесс
Нагрейте раствор до кипения.Окунать.
Вернуться к индексу
17. Глубокий красный ржавчины
Ингредиенты
Процесс
Нанесите кистью на поверхность для цвета. Затем окунуть в разбавленную (1 кислота:8 воды) азотную кислоту на 1/2 часа, вынуть, промыть и высушить.
Затем окунуть в разбавленную (1 кислота:8 воды) азотную кислоту на 1/2 часа, вынуть, промыть и высушить.
Вернуться к индексу
18. Фиолетовый
Ингредиенты
Процесс
Массовые части. Кисть на поверхность.
Вернуться к индексу
19. Античный белый
Ингредиенты
Процесс
Нагрейте металл и нанесите жидкость.Варианты этой формулы добавляют щепотку сульфата калия, нитрата железа или нитрата меди для легкого окрашивающего эффекта.
Вернуться к индексу
Предлагаемые формулы для конкретных металлов.
20. Красный — полуматовый (для меди и медной пластины)
Ингредиенты
Процесс
Погружение в кипящую воду (A) 15 мин.
Погружение в кипящую воду (A)+(B) 10 мин.
Погрузить в кипящий раствор сульфата меди примерно на 15 мин. или до тех пор, пока хорошо не разовьется цвет.
Перенести в горячую воду, добавляя хлорид аммония к раствору сульфата меди. Затем погрузите примерно на 10 мин. Снять и постирать в горячей воде. Высушите и закончите.
Затем погрузите примерно на 10 мин. Снять и постирать в горячей воде. Высушите и закончите.
Важное примечание: Как правило, химически индуцированные покрытия не подходят для использования на изделиях, предназначенных для пищевых продуктов.
Вернуться к индексу
21. Тускло-розовый (для меди и медной пластины)
Ингредиенты
Процесс
Горячее погружение — 5 мин.
Погрузить в горячий раствор (140-158°F, 60-70°C), который травит поверхность.Снимите через 5 минут, промойте теплой водой и высушите на воздухе. Восковая отделка.
Вернуться к индексу
22. Красно-фиолетовый сатин (для литой бронзы и латуни)
Ингредиенты
Процесс
Погружение в кипящую воду (от 10 до 30 мин.)
Погрузить в кипящий раствор. Красновато-оранжевая окраска начинается через 2-3 мин. и углубляется при дальнейшем погружении. При достижении красновато-фиолетовой окраски от 10 до 30 мин. снять и хорошо постирать в горячей воде. Сухая и восковая отделка, если хотите.
Вернуться к индексу
23. Оранжево-коричневый (для литья бронзы и латуни)
Ингредиенты
Процесс
Тепловое погружение (15 мин)
Погрузить в горячий раствор (176°F, 80°C). Цвет развивается постепенно и удаляется через 15 мин. Вымойте и высушите воском, если хотите.
Вернуться к индексу
24. Черный — полуматовый (для литья бронзы и латуни)
Ингредиенты
Процесс
Горячее погружение (20 мин.)
Погрузить в горячий раствор (140–158°F, 60–70°C). Через минуту поверхность окрашивается в сине-фиолетовый цвет. Он отступает до коричневого цвета, затем переходит в серый. Через 20 мин снять, промыть горячей водой и высушить на воздухе. Обрабатывайте как можно меньше.
Вернуться к индексу
25. Сине-зеленый (для литой бронзы и латуни)
Ингредиенты
Процесс
Прикладная паста — несколько дней.
С помощью ступки и пестика разотрите ингредиенты в кремообразную пасту с уксусной кислотой.Нанесите пасту на объект с помощью мягкой кисти, создав густое покрытие. Сухой в течение одного дня. Смойте сухой остаток под холодной водой, используя мягкую щетку. Нанесите тонкий слой пасты мягкой тканью и снова просушите в течение суток. Снова смойте остатки. Нанесите тонкий слой и высушите до получения хорошей пестрой патины. По окончании обработки тщательно просушите. Можно воском.
Вернуться к индексу
26. Золотисто-желтый (для литой бронзы и латуни)
Ингредиенты
Процесс
Погружение в кипящую воду (15 мин.)
Погрузить предмет в кипящий раствор. Через 1-2 мин на поверхности образуется темно-коричневый слой. Удалите предмет и щетину-щетку под горячую воду. Повторно погрузите и повторите процесс через 2 мин. если необходимо. Погрузите снова примерно на 15 мин. снимите и тщательно промойте в горячей воде, используя щетку из щетины, если это необходимо. Сухая и восковая отделка на выбор.
Сухая и восковая отделка на выбор.
Вернуться к индексу
27. Сине-зеленый — полуматовый (для литой бронзы и латуни)
Ингредиенты
Процесс
Наносимая жидкость.
С помощью ступки и пестика измельчите ингредиенты с небольшим количеством воды. Затем добавьте к оставшейся воде. Нанесите и осторожно протрите мягкой тканью, чтобы поверхность оставалась равномерно влажной. Дать высохнуть на воздухе. Повторяйте процедуру один раз в день в течение нескольких дней по мере развития цвета. Сушат несколько дней, в течение которых патина развивается дальше. Когда больше не будет изменений поверхности, нанесите воск для финишной обработки.
Самое главное, дать ему полностью высохнуть между нанесениями и до двух недель перед нанесением воска.
Вернуться к индексу
28. Коричневый – зеленовато-желтый (для литой бронзы и латуни)
Ингредиенты
Процесс
Погрузить в горячий раствор (140-158°F, 60-70°C), чтобы вызвать травление поверхности и постепенное потемнение. Через 5 минут снять и постирать в теплой воде. Дайте высохнуть на воздухе. Когда высохнет, покрыть воском.
Через 5 минут снять и постирать в теплой воде. Дайте высохнуть на воздухе. Когда высохнет, покрыть воском.
Вернуться к индексу
29. Красновато-коричневый (для литой бронзы и латуни)
Ингредиенты
Процесс
Погружение в кипящую воду (10-15 мин)
Цвет проявляется через 10-15 мин.Снять и постирать в горячей воде. Тщательно высушите, покройте воском.
Вернуться к индексу
30. Черный (для литой бронзы и латуни)
Ингредиенты
Процесс
Тепловое погружение — 1 минута.
При погружении изделия в горячий раствор (120-140°F, 50-60°C) возникает последовательность цветов. Примерно через 45 секунд он становится пурпурным. Цвет быстро темнеет, и изделие снимается примерно через 1 минуту. Тщательно промойте в горячей воде и высушите на воздухе, покройте воском.
Вернуться к индексу
31. Пестрая золотисто-коричневая (для литья бронзы и латуни)
Ингредиенты
Процесс
Горячее погружение (3-5 мин. )
)
Погрузить в горячий раствор (194°F, 90°C). Золотой блеск развивается в течение одной минуты и становится более интенсивным. Когда через 3-5 минут глянец полностью проявится, снимите и промойте в горячей воде, что также является процессом охлаждения. Наконец, постирайте изделие в холодной воде. Сначала тщательно высушите, промокнув лишнюю влагу впитывающей салфеткой, а затем высушите на воздухе.Восковая отделка после высыхания.
Вернуться к индексу
32. Красный (для литой бронзы и латуни)
Ингредиенты
Процесс
Нагрейте металл и нанесите горячую жидкость
Обработайте патину погружением, погрузите объект в раствор на несколько минут, затем удалите. Повторяйте, пока не появится цвет. Консервант необязателен. Сообщается, что эта патина дает больше бирюзового, чем зеленого цвета. Цвет появляется при извлечении из раствора. Нанесение кистью — нормальный вариант.
Интенсивный процесс погружения, прозрачная патина. Погрузите объект на 20-30 минут. Консервант следует наносить сразу после извлечения и сушки объекта.
Погрузите объект на 20-30 минут. Консервант следует наносить сразу после извлечения и сушки объекта.
Холодный процесс, тяжелая непрозрачная патина, вступающая в силу после нескольких применений. Консервант необязателен.
Методы определения химического состава сплавов
Определение точного химического состава сплавов чрезвычайно важно по ряду причин, например, может быть необходимо проверить, что критический компонент изготовлен из правильного сплава, когда мельница сертификат об испытаниях недоступен или действительность указанного сертификата находится под вопросом.
Существуют сотни различных составов сплавов, каждый из которых обладает собственным набором специфических свойств. Некоторые сплавы одного и того же состава основного металла часто могут иметь очень разные наборы свойств. Одним из примеров этого является устойчивость сплавов нержавеющей стали к коррозии под действием кислоты; некоторые стальные сплавы обладают высокой устойчивостью к определенным кислотам, а другие нет. Выбор неправильного сорта может привести к внезапным и непредсказуемым сбоям.
Выбор неправильного сорта может привести к внезапным и непредсказуемым сбоям.
Метод правильной идентификации сплава называется положительной идентификацией материала (PMI).Это общий термин для различных технологий и методов, используемых для определения состава сплава. PMI может определять как элементный состав (количественный), так и марку сплава (качественный). Существует множество различных методов, используемых для определения состава сплава, но два основных метода, используемых в промышленности PMI, XRF и OES, обсуждаются ниже.
Химический состав сплавов по данным рентгенофлуоресцентной спектроскопии (XRF)
Рентгеновская флуоресцентная спектроскопия, или XRF, представляет собой метод PMI, который использует низкоэнергетические рентгеновские лучи для сканирования химического состава сплавов.Используется портативный прибор, который может определить состав сплава за считанные секунды.
Рентгеновские лучи возбуждают атомы в образце, которые затем флуоресцируют, производя вторичные рентгеновские лучи, которые отражаются на детекторе. Энергия (или длина волны) этих отраженных рентгеновских лучей может использоваться для точного определения того, какие элементы содержатся в образце. Таким образом, состав сплава может быть определен прибором.
Энергия (или длина волны) этих отраженных рентгеновских лучей может использоваться для точного определения того, какие элементы содержатся в образце. Таким образом, состав сплава может быть определен прибором.
Следует отметить, что из-за сильного рассеяния рентгеновских лучей атомами металлов рентгеновские лучи достигают глубины только около 100 микрон в легких сплавах.Эта глубина уменьшается по мере того, как сплавы становятся более плотными. Поэтому очень важно, чтобы поверхность материала представляла объемный материал. Любое покрытие на поверхности, такое как гальваническое покрытие, краска или поверхностное загрязнение, резко изменит результат сканирования.
Таблица 1. Преимущества/недостатки XRF
Преимущества | Недостатки |
Устройство легкое и простое в использовании | Может измерять только несколько сотен микрон на поверхности образца для легких сплавов и несколько десятков микрон для более тяжелых сплавов |
Для образца требуется очень небольшая подготовка поверхности.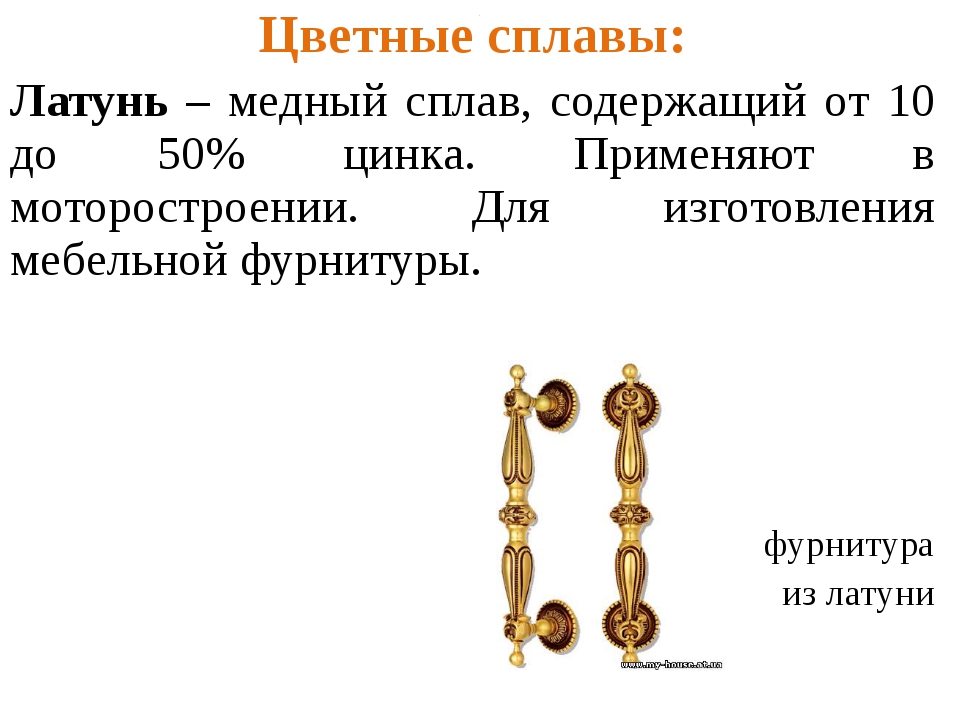 | Не все элементы могут быть обнаружены с помощью этого метода |
Может отбирать небольшие куски материала, такие как проволока |
|
Химический состав сплавов с использованием оптической эмиссионной спектроскопии (ОЭС)
Оптическая эмиссионная спектроскопия, или OES, представляет собой метод PMI, который создает искру на образце в присутствии газообразного аргона.Искра возбуждает атомы внутри образца. Эти возбужденные атомы излучают свет на определенных частотах, которые затем используются для точного определения состава сплава. Измерения можно проводить без использования аргона за счет точности результата.
Одним из основных преимуществ OES является его способность измерять легкие элементы, которые невозможно обнаружить с помощью XRF. Таким образом, ОЭС является очень универсальным методом определения химического состава сплавов.
Таблица 1. Преимущества и недостатки OES
Преимущества | Недостатки |
Может обнаруживать легкие легирующие элементы | Система громоздка и требует газообразного аргона для получения точных результатов |
| На материале остается след от прожога |
Требуется значительная подготовка поверхности |
Материалы, идентифицируемые PMI
XRF может идентифицировать до 90 % элементов периодической таблицы, т. е.е. элементов тяжелее магния. Некоторые из типичных сплавов, которые можно идентифицировать с помощью PMI, указаны ниже.
е.е. элементов тяжелее магния. Некоторые из типичных сплавов, которые можно идентифицировать с помощью PMI, указаны ниже.
- Медные сплавы
- Алюминиевые сплавы
- Титановые сплавы
- Бронза и латунные сплавы
- Хромо-молибденовые сплавы
- Сплавы из нержавеющей стали
- Никелевые и кобальтовые сплавы
XRF не может определить точный состав сплавов, содержащих элементы легче магния (включая литий, бериллий, бор, углерод, азот), таких как следующие:
- Алюминиевые сплавы, содержащие литий
- Медные сплавы, содержащие бериллий
- Низкоуглеродистая сталь
Следует отметить, что, несмотря на то, что XRF не может обнаружить эти элементы, сплав иногда все же можно идентифицировать, идентифицируя другие легирующие элементы.{3} . Предположим, что плотность латуни зависит от состава линейно.
Стенограмма видео
нам сказали, что у нас есть латунный цилиндр, а латунь — это медно-цинковый сплав, поэтому у каждого есть свои компоненты, и у каждого своя плотность. Этот латунный цилиндр имеет длину, которую мы также можем назвать высотой 1,62 дюйма, и диаметр 0,514 дюйма. Мы также знаем, что это 67% меди и 33% цинка. По массе. У нас есть плотности обоих, и мы хотим найти массу в граммах этого цилиндра.Поэтому, прежде чем мы сможем это сделать, потому что плотность воздуха дает граммы на кубический сантиметр, нам, вероятно, следует вместо этого сделать эти дюймы сантиметрами. Итак, давайте сначала конвертируем их. Полезно знать, что на каждый дюйм на самом деле приходится 2,54 сантиметра, поэтому сначала мы получаем, что 4,11 сантиметра — это высота. Затем давайте сделаем диаметр, так что мы сделаем 0,514 дюйма по 2,54 сантиметра в каждом дюйме, и мы получим, что диаметр равен 1,31 сантиметра. Далее попробуем найти объем этого цилиндра, что мы можем сделать по следующей формуле.Объем прямого цилиндра равен pi r Квадрат высоты. У нас нет своего, но есть. Диаметр и диаметр в два раза больше радиуса, поэтому давайте разделим это на два и найдем, что радиус равен 20,653 сантиметра.
Этот латунный цилиндр имеет длину, которую мы также можем назвать высотой 1,62 дюйма, и диаметр 0,514 дюйма. Мы также знаем, что это 67% меди и 33% цинка. По массе. У нас есть плотности обоих, и мы хотим найти массу в граммах этого цилиндра.Поэтому, прежде чем мы сможем это сделать, потому что плотность воздуха дает граммы на кубический сантиметр, нам, вероятно, следует вместо этого сделать эти дюймы сантиметрами. Итак, давайте сначала конвертируем их. Полезно знать, что на каждый дюйм на самом деле приходится 2,54 сантиметра, поэтому сначала мы получаем, что 4,11 сантиметра — это высота. Затем давайте сделаем диаметр, так что мы сделаем 0,514 дюйма по 2,54 сантиметра в каждом дюйме, и мы получим, что диаметр равен 1,31 сантиметра. Далее попробуем найти объем этого цилиндра, что мы можем сделать по следующей формуле.Объем прямого цилиндра равен pi r Квадрат высоты. У нас нет своего, но есть. Диаметр и диаметр в два раза больше радиуса, поэтому давайте разделим это на два и найдем, что радиус равен 20,653 сантиметра. Давайте используем то, что включено в нашу формулу объема Пи, умноженное на 0,653 сантиметра в квадрате, умноженное на 4,11 сантиметра, и, вычислив это, мы получим, что объем цилиндров теперь равен 5,51 кубического сантиметра. Поскольку мы знаем, каков объем, и знаем, что этот цилиндр на 67% состоит из меди и на 33% из цинка, мы знаем, какой процент будет вносить каждый объем.Итак, давайте умножим 0,670 на 5,51 и найдем, что из этих 3,69 кубических сантиметра будет медь, а затем проделаем то же самое. Для цинка сток составил 0,330. Судя по 33% и умножая это, получаем, что это 1,82 кубических сантиметра цинка. Теперь нам нужно выяснить, как отсюда добраться до Массы, потому что у нас есть объемы и плотности, которые нам даны. Формула плотности — это отношение массы к объему, но этого недостаточно. Мы хотим получить массу. Итак, давайте умножим обе части на объем, и мы получим уравнение объема умноженное.Плотность равна массе. У нас есть объем, и у нас есть плотность. Итак, давайте сделаем это.
Давайте используем то, что включено в нашу формулу объема Пи, умноженное на 0,653 сантиметра в квадрате, умноженное на 4,11 сантиметра, и, вычислив это, мы получим, что объем цилиндров теперь равен 5,51 кубического сантиметра. Поскольку мы знаем, каков объем, и знаем, что этот цилиндр на 67% состоит из меди и на 33% из цинка, мы знаем, какой процент будет вносить каждый объем.Итак, давайте умножим 0,670 на 5,51 и найдем, что из этих 3,69 кубических сантиметра будет медь, а затем проделаем то же самое. Для цинка сток составил 0,330. Судя по 33% и умножая это, получаем, что это 1,82 кубических сантиметра цинка. Теперь нам нужно выяснить, как отсюда добраться до Массы, потому что у нас есть объемы и плотности, которые нам даны. Формула плотности — это отношение массы к объему, но этого недостаточно. Мы хотим получить массу. Итак, давайте умножим обе части на объем, и мы получим уравнение объема умноженное.Плотность равна массе. У нас есть объем, и у нас есть плотность. Итак, давайте сделаем это. Плотность меди составляет 8,92 грамма на кубический сантиметр. Когда мы умножим их, мы уравняем сантиметры в кубе. Следовательно, масса меди 32,9 грамма, а значит возьмем наш цинк и умножим его на 7,14 грамма на кубический сантиметр. Кроме того, это также приводит к отмене единиц объема и оставляет нас в беспорядке. Это оставит нам массу цинка 13,0 грамм. Мы можем сложить их вместе, чтобы получить общую конечную массу 45.Оба металла в сплаве
Плотность меди составляет 8,92 грамма на кубический сантиметр. Когда мы умножим их, мы уравняем сантиметры в кубе. Следовательно, масса меди 32,9 грамма, а значит возьмем наш цинк и умножим его на 7,14 грамма на кубический сантиметр. Кроме того, это также приводит к отмене единиц объема и оставляет нас в беспорядке. Это оставит нам массу цинка 13,0 грамм. Мы можем сложить их вместе, чтобы получить общую конечную массу 45.Оба металла в сплаве
Медный сплав Бесплатная резка латуни C38500
Химический состав
AS2738.2 – 1984, составы и обозначения
| Медь | Свинец | Цинк | |
| Мин. | 56,0 | 2,5 | – |
Макс. | 60.0 | 4,5 | Остаток |
Технические характеристики эквивалентного сплава
| Спецификация | Обозначение |
| УНС | С38510 |
| ИСО | CuZn39Pb3 |
| БСИ | КЗ121 |
Спецификации продукции для Австралии
| Спецификация | Форма продукта |
| AS1567 | Кованые стержни, прутки и профили |
| AS2738 | Составы и обозначения |
Свойства изготовления
|
|
Механические свойства
AS1567, Кованые стержни, прутки и профили
Характер | . 2% доказательство стресса 2% доказательство стресса | Прочность на растяжение | Удлинение | Твердость |
M (заводской) | МПа | МПа | % | ХВ |
| Типичные значения | 215 | 495 | 15 | 150 |
| Минимум | – | 380 | 12 | – |
Доступные формы Компания Austral Wright Metals может поставлять этот сплав в виде прессованных стержней.
Общее описание Свободная латунь представляет собой значительно улучшенную форму латуни 60/40 с превосходными характеристиками свободной резки. Он используется в массовом производстве латунных деталей на высокоскоростных токарных станках, где требуется максимальная производительность и максимальный срок службы инструмента, а также когда не требуется дополнительная холодная штамповка после механической обработки.
Превосходные механические характеристики сплава 385 обусловлены эффектом быстрого охлаждения при непрерывном литье, который обеспечивает мелкое равномерное распределение свинца без сегрегации и подавляет образование хрупких фаз, вызывающих износ инструмента.
Сплав дает:
- Превосходное качество поверхности без модификации инструмента
- Увеличенный срок службы инструмента и сокращение времени его заточки
- Более чистая резьба без наростов и поломок
- Режущие инструменты, ранее использовавшиеся с отрицательным передним углом, можно изменить на нулевой верхний передний угол
Типичные области применения: гайки, болты и резьба
Физические свойства
| Имущество | Метрические единицы | Имперские единицы |
Точка плавления (ликвидус) | 890°С | 1635°F |
Точка плавления (Солидус) | 875°С | 1610°F |
Плотность | 8. | 0,306 фунта/дюйм³ при 68°F |
Удельный вес | 8,47 | 8,47 |
Коэффициент теплового расширения | 20,9 x 10 -6 / °C (20-300°C) | 11,0 x 10 -6 / °F (68-392°F) |
Теплопроводность | 121 Вт/м.°К при 20°С | 70 БТЕ/фут³/фут/час/°F при 68°F |
Теплоемкость (удельная теплоемкость) | 377 Дж/кг. °К при 20°С | 0,09 БТЕ/фунт/°F при 68°F |
Электропроводность | 0,162 мкОм¹. | 28% МАКО |
Удельное электрическое сопротивление | 6.16 мкОм.см при 20°C | 38 Ом (окр. мил/фут) при 68°F |
Модуль упругости (растяжение) | 97 ГПа при 20°C | 14,2 x 10 6 фунтов на кв. дюйм при 68°F |
Модуль жесткости (кручение) | 37 ГПа при 20°C | 5,3 x 10 6 фунтов на кв. дюйм при 68°F |
Коэффициент Пуассона | 0.32 | 0,32 |
Фазовая диаграмма и механические свойства
Коррозионная стойкость
Сплав 385 обладает хорошей коррозионной стойкостью к атмосферным воздействиям и хорошей устойчивостью ко многим водам.

 Химическая формула, Na2CO3
Химическая формула, Na2CO3 Химическая формула: Na3PO4 * 12h3O
Химическая формула: Na3PO4 * 12h3O Введите свой запрос:
Введите свой запрос:
 47 г/см³ при 20°C
47 г/см³ при 20°C см¹ при 20°C
см¹ при 20°C