Металлы и неметаллы — урок. Химия, 8–9 класс.
Простые вещества по их свойствам делят на металлы и неметаллы.
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Ртуть
Алюминий
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Хлор
Бром
Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Красный фосфор
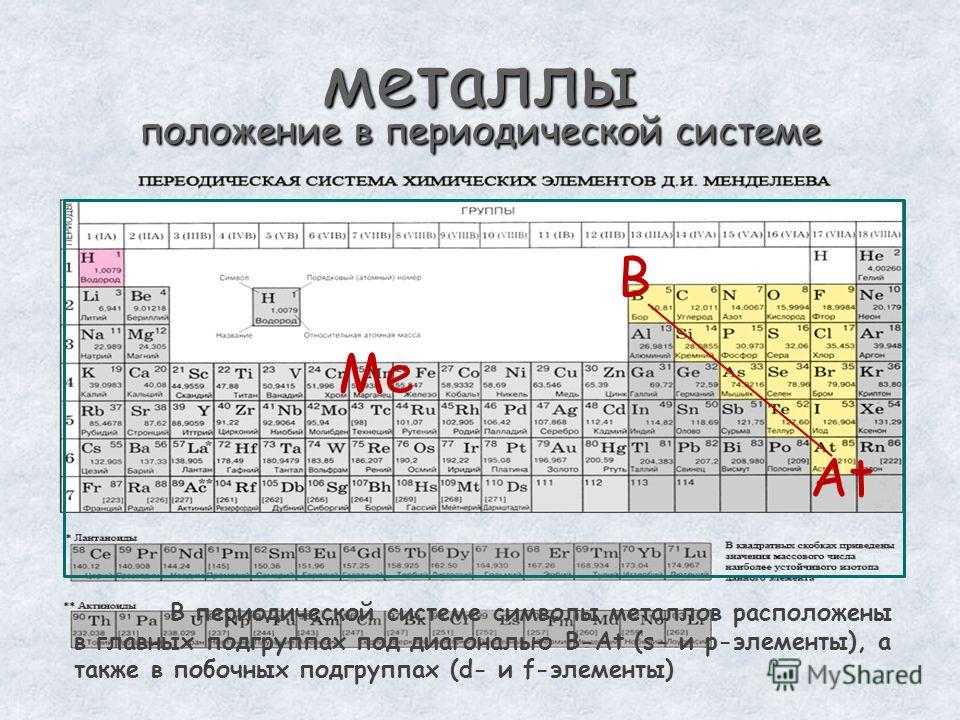
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
Почему редкоземельные элементы стали оружием в экономической войне США и Китая
Редкоземельные металлы превратились в ключевой элемент в торговой войне между Соединенными Штатами и Китаем.
В начале августа 2019 г. Ассоциация китайской редкоземельной промышленности выступила с протестом против новых тарифов, введенных президентом Трампом: китайцы обвинили американскую администрацию в экономическом «запугивании». Они отметили, что новые пошлины должны быть оплачены (в той или иной форме) потребителями и рынком США.
Разозлить китайское лобби редкоземельных элементов — дело не шуточное. В настоящее время около 80% редких металлов, используемых в США, импортируется из Китая. Несмотря на то, что производство в США остаётся одним из крупнейших в мире (15.000 тонн в 2018 году, немного меньше, чем в Австралии), объём его всё же незначителен по сравнению с производством в Китае: 120.000 тонн в год.
Что такое редкоземельные элементы и в чём их ценность?
Редкоземельными считаются 17 элементов таблицы Менделеева, в частности скандий, иттрий и 15 других элементов лантаноидной группы металлов, включая такие как неодим, диспрозий и гольмий.
Все редкоземельные элементы — металлы. Они обладают схожими свойствами и их можно обнаружить в геологических отложениях. Иногда их также называют «редкоземельными оксидами», поскольку обычно они встречаются в природе в виде оксидных соединений.
«Несмотря на название, дело вовсе не в их редкости: их так называют, потому что они сильно разбросаны в земной коре по сравнению с некоторыми другими элементами или композитами, такими как пирит или золото», — поясняет профессор наноминералогии из Тринити-колледжа Дублина Хуан Диего Родригес-Бланко.
Редкоземельные элементы ценятся из-за их использования в производстве бытовой электроники и технологиях, связанных с возобновляемыми источниками энергии (такими как ветряные турбины и электромобили). С распространением высокотехнологичной продукции растёт и спрос на редкоземельные металлы.
«И это, в свою очередь, порождает конкуренцию на уровне геополитики: эти элементы крайне важны для развития новых технологий, что резко повышает их ценность [для промышленности и экономики]», — говорит Родригес-Бланко.
Крупнейшее месторождение редкоземельных металлов расположено в Баян-Обо, на севере Китая. На его долю приходится примерно половина объема производства редкоземельных металлов с 2005 года.
«Голмий используется для изготовления панелей управления в атомной промышленности и микроволновых печах. Неодим используется для изготовления мощных магнитов, роботов, автомобилей, жестких дисков и ветряных турбин», — рассказывает Родригес-Бланко. Кроме того редкоземельные элементы используются в аэрокосмической и военной отрасли, для производства высокостойкого стекла, топливных присадок и лазеров.
В дополнение к высоким технологиям, редкоземельные элементы используются в медицинских исследованиях, а также в лечении некоторых видов онкологических болезней (рака легких, простаты и костей).
Все их ищут, но не все находят
Хотя эти элементы и не являются «редкими», процесс их извлечения и последующей обработки — очень сложный и дорогостоящий. По данным Геологической службы США (USGS), несмотря на то, что они достаточно часто встречаются в земной коре, они широко рассеяны по земному шару. Это означает, что трудно найти значительный объём редкоземельных элементов для последующей добычи.
Именно поэтому для добычи используются агрессивные методы, как например извлечение из руды с помощью органических растворителей, магнитное деление и добыча при сверхвысоких температурах около 1000°C.
«Это очень неэффективные и экологически агрессивные методы, при которых более 50% элементов теряется в процессе разложения породы», — сказал Родригес-Бланко.
Во многих случаях сточные воды рудника содержат больше редкоземельных металлов, чем сами горные породы. Почему бы не подвергнуть переработке эти воды? Дело в том, что «эффективных методов для этого не существует: они настолько дороги, что их применение бессмысленно», — говорит наш эксперт.
Всего 1% редкоземельных элементов подвергается переработке.
В то же время, добыча этих полезных ископаемых сопряжена с высокими экологическими издержками. В некоторых процессах для разделения и сжигания при высоких температурах используются кислоты, выделяющие CO₂, что приводит к загрязнению окружающей среды.
«Редкоземельные элементы часто содержат радиоактивный элемент — торий. Хотя концентрация этого металла невысокая, мы не знаем, как контакт с ним влияет на окружающую среду и людей во время добычи», — сетует геолог.
Ключевой элемент в международной торговле
Китай осознает, что обладает мощным оружием в торговой войне против США, поскольку американская сторона сильно зависит от китайского экспорта редкоземельных элементов.
Визит китайского президента Си Цзиньпина на завод по переработке руды в конце мая дал повод для всевозможных догадок и взбудоражил международные рынки редкоземельных элементов.
По данным властей США, на долю Китая приходится около 36,7% известных мировых запасов редкоземельных металлов и 70,6% мирового производства этих металлов. Если бы Пекин вдруг заявил, что экспорт этих элементов прекращается, было бы очень непросто достичь уровня их производства, необходимого для поддержки индустрии стран Запада.
Коммунистическая партия Китая намекнула, что рассматривает возможность ограничения экспорта редкоземельных металлов. «Не стоит недооценивать способность Китая противостоять нападкам. Не говорите потом, что мы вас не предупреждали», — говорится в материале центрального органа Компартии Китая «Жэньминь Жибао».
В мире есть страны, обладающие крупными запасами редкоземельных элементов, которые, в случае их грамотной добычи, могут удовлетворить потребности американского и европейского рынков и положить конец китайской гегемонии на этом рынке.
Но добыча этих элементов, по словам нашего эксперта, требует проведение ряда серьёзных исследований: «Особенностью редкоземельных металлов является то, что их месторождения имеют совершенно иную природу, а методы их добычи не могут быть просто перенесены их одной страны в другую».
Так, способ извлечения минералов, задействованный в китайском Баян-Обо, оказался бы совершенно бесполезным на австралийском месторождении, поясняет Родригес-Бланко.
Элемент ExcludeOtherLists (металла) | Microsoft Docs
- Чтение занимает 2 мин
В этой статье
Применимо к: SharePoint 2016 | SharePoint Foundation 2013 | SharePoint Online | SharePoint Server 2013Applies to: SharePoint 2016 | SharePoint Foundation 2013 | SharePoint Online | SharePoint Server 2013
Указывает на то, что в металлах создается код только для списков, которые явно представлены в элементах списка .Specifies that SPMetal generates code only for lists that are explicitly represented by List elements.
<ExcludeOtherLists />
Элементы и атрибутыElements and attributes
В следующих разделах описываются атрибуты, дочерние и родительские элементы.The following sections describe attributes, child elements, and parent elements.
АтрибутыAttributes
Нет.None.
Дочерние элементыChild elements
Нет.None.
Родительские элементыParent elements
| ЭлементElement | ОписаниеDescription |
|---|---|
| WebWeb | Задает имя и уровень доступа (общедоступный или внутренний) класса (производного от DataContext), который генерируется системой. Specifies the name and access level (public or internal) of the class (derived from DataContext) that SPMetal generates. Specifies the name and access level (public or internal) of the class (derived from DataContext) that SPMetal generates. |
ПримечанияRemarks
Веб- элемент не может одновременно содержать элементы ExcludeOtherLists и IncludeHiddenLists .A Web element cannot have both an ExcludeOtherLists
element and an IncludeHiddenLists element.ПримерExample
Ниже приведен пример использования элемента ExcludeOtherLists .The following is an example of an ExcludeOtherLists element in use. В этом случае выполняется проверка того, что список «Team Members» — единственный, для которого SPMetal создает объявление свойства.In this case, it ensures that the «Team Members» list is the only one for which SPMetal generates a property declaration.
<?xml version="1.0" encoding="utf-8"?>
<Web AccessModifier="Internal" xmlns="http://schemas.microsoft.com/SharePoint/2009/spmetal">
<List Name="Team Members">
<ContentType Name="Item" />
</List>
<ExcludeOtherLists />
</Web>
См. такжеSee also
Можно ли заменить металлические элементы на печатные CF?
Технология 3D-печати дает нам преимущество в сокращении затрат и времени производства, а доступные на рынке материалы для 3D-печати позволяют нам заменять даже самые сложные элементы на производственных линиях. Поэтому неудивительно, что можно заменить металл на 3D-печать. Сегодня мы ответим на вопрос: почему стоит пойти на такой шаг?
3D-печать заменяет металлические элементы
Не только промышленные 3D-принтеры большого размера позволяют печатать из материалов, заменяющих металл. Настольный принтер Omni3D – Omni200 CF, достигающий температуры 400 ° C, является лучшим решением для клиентов, которым требуются отпечатки меньшего размера при соблюдении промышленных стандартов. Каковы преимущества 3D-печати, которая заменит металл?
Каковы преимущества 3D-печати, которая заменит металл?
- снижение цены
- экономия времени
- быстрое реагирование на простои производства
- уменьшение веса печатаемого элемента
- более легкое изготовление даже геометрически сложных элементов
Какой материал в 3D-печати лучше всего может заменить металл?
Самый универсальный материал, используемый в таких случаях, – нейлон с добавлением углеродного волокна. Этот материал в первую очередь отличается высокой усталостной прочностью, хорошей ударной вязкостью, а также устойчив к коррозии.
Характерной особенностью этой нити является ее температура прогиба под давлением 160 ° C и хорошая химическая стойкость.
Материал CF-PA-12 от Omni3D представляет собой композит с матрицей из полиамида 12 (PA 12), армированный углеродными волокнами. Именно содержание углеродных волокон обеспечивает в 2,5 раза более высокую прочность на разрыв по сравнению с популярным ABS-42.
Благодаря этим функциям мы можем печатать на 3D-принтере прочные, жесткие и легкие детали.
Посмотрите примеры приложений, в которых 3D-печать заменяет металл:
Нить CF-PA-12 поддерживается промышленными сериями 3D-принтеров от Omni3D:
Factory 2.0, Factory 2.0 NET, Omni500 LITE.
и настольный принтер Omni200
Kontakt:
LinkedIn: Jacek Krzyżanowski
m. +48 886 618 690
e-mail: [email protected]
Исследование процессов рафинирования металла с использованием редкоземельных элементов с целью повышения качества стали
Исследование процессов рафинирования металла с использованием редкоземельных элементов с целью повышения качества стали | НИТУ «МИСиС»Дауд Ахмед Дауд Али
Специальность:
Искомая ученая степень:
кандидат технических наук
Дата и время защиты:
28. 06.2018 10:00
06.2018 10:00
Место защиты:
НИТУ «МИСиС»
Диссертационная работа выполнена на кафедре «Металлургия стали, новые производственные технологии и защита металлов»
Национального исследовательского технологического университета «МИСиС»Специальность 05.16.02 — «Металлургия черных, цветных и редких металлов»
Научный руководитель: | |
д.т.н., профессор, профессор кафедры «Металлургия стали, новые производственные технологии и защита металлов» НИТУ «МИСиС» | Семин Александр Евгеньевич |
Официальные оппоненты: | |
д.т.н., профессор, профессор кафедры «Экономика и управление в промышленности» Государственного университета управления | Богданов Сергей Васильевич |
научный сотрудник лаборатории металлофизических исследований ВИАМ | Мовенко Дмитрий Александрович |
Ведущая организация: | Федеральное государственное бюджетное учреждение науки «Институт металлургии и материаловедения им. А.А. Байкова» Российской академии наук |
Защита диссертации состоится «28» июня 2018 г. в 10:00 на заседании Диссертационного совета Д 212.132.02 при Национальном исследовательском технологическом университете «МИСиС» по адресу: 119049, г. Москва, Ленинский проспект, д. 6, аудитория А-312.
С диссертацией можно ознакомиться в библиотеке и на сайте Национального исследовательского технологического университета «МИСиС» — http://misis.
Наш сайт использует файлы cookie.
Мы не идентифицируем вас, а улучшаем работу сайта.
Оставаясь, вы даете согласие на обработку файлов cookie.
Page not found — Kanthal®
61 результатов поиска
61 результатов поиска для «%d0%bc%d0%b5%d1%82%d0%b0%d0%bb%d0%bb%d0%b8%d1%87%d0%b5%d1%81%d0%ba%d0%b8%d0%b5 %d0%bd%d0%b0%d0%b3%d1%80%d0%b5%d0%b2%d0%b0%d1%82%d0%b5%d0%bb%d1%8c%d0%bd%d1%8b%d0%b5 %d1%8d%d0%bb%d0%b5%d0%bc%d0%b5%d0%bd%d1%82%d1%8b» в весь веб-сайт
PROCHROM-COMP d.o.o.
hr,si Distributor for: Furnace products, heating materials and services +386 4 537 82 15 +386 4 537 82 11 … for: Furnace products, heating materials and services +386 4 537 82 15 +386 4 537 82 11Sandvik Korea Ltd.
kr Sales office for: Resistors and capacitors +82 2 369 08 00 +82 2 761 04 35Sandvik Materials Technology Korea Co., Ltd.
kr Sales office for: Furnace products, heating materials and services +82 51 201 59 41 +82 51 207 72 37 … Sales office for: Furnace products, heating materials and services +Sandvik Korea Ltd.
kr Sales office for: Resistors and capacitors +82 51 201 59 41 +82 51 207 72 37Bosnia and Herzegovina
Контактная информация для Босния и Герцеговинаs-ka026-b-eng-2012-01.pdf
Kanthal D, Alkrothal® 4 Austenitic alloys (NiCr, NiCrFe) 4 Nikrothal® 80, Nikrothal TE, Nikrothal 70, Nikrothal 60, Nikrothal 40 and Nikrothal … Alkrothal 54 Nikrothal 80, Nikrothal TE and Nikrothal 70 60 Nikrothal 60 62 Nikrothal 40 and Nikrothal 20 64 Nikrothal 80, Nikrothal 60 and NikrothalNikrothal®
80 Nikrothal® 80 is an austenitic nickel-chromium alloy (NiCr alloy) for use at temperatures up to 1200°C (2190°F). The alloy is characterized by high resistivity … stability. It has good ductility after use and excellent weldability.
Nikrothal® 80 is used for electric heating elements in home appliances and industrial furnaces
The alloy is characterized by high resistivity … stability. It has good ductility after use and excellent weldability.
Nikrothal® 80 is used for electric heating elements in home appliances and industrial furnacesNikrothal®
80 Nikrothal® 80 is an austenitic nickel-chromium alloy (NiCr alloy) for use at temperatures up to 1200°C (2190°F). The alloy is characterized by high resistivity … resistivity, good oxidation resistance and very good form stability. Nikrothal 80 has good ductility after use and excellent weldability. It has good corrosionNikrothal®
80 Nikrothal® 80 is an austenitic nickel-chromium alloy (NiCr alloy) for use at temperatures up to 1200°C (2190°F). The alloy is characterized by high resistivity … stability. It has good ductility after use and excellent weldability. Nikrothal®Элементы декора из металла
Собственники всегда заинтересованы в том, чтобы их дома были не только безопасными и комфортными для проживания, но и привлекательными. Чтобы сделать интерьер объекта эстетичным, необходимо тщательно продумать его стиль, подобрать множество декоративных элементов и деталей, которые создадут общую картину, целостный дизайн каждого помещения.
Современный рынок предлагает покупателям большое количество различных украшений, включая элементы декора из металла, которые могут сделать любую комнату более изысканной и привлекательной.
Виды металлических аксессуаров
Человечество на протяжении всего своего существования создавало украшения для жилищ из самых разных материалов. Когда люди научились обрабатывать металлы, они начали делать декор и из него. В настоящее время технологии создания металлических элементов интерьера отточены до совершенства. Многие компании занимаются изготовлением подобных аксессуаров.
Многие компании занимаются изготовлением подобных аксессуаров.
Большая часть металлических украшений изготавливается по методу ковки и литья. Художественная ковка давно стала отдельным видом декоративного искусства и позволяет делать очень эстетичные, эффектные изделия, способные дополнить, украсить собой интерьер любой комнаты, будь то гостиная, спальня, кухня или прихожая.
К наиболее распространенным технологиям изготовления украшений принято относить:
- горячую ковку;
- холодную ковку;
- бронзовое литье;
- изготовление из сплавов.
Весь декор отличается сходным набором преимуществ. Сталь обладает прекрасными характеристиками прочности и надежности. Он на протяжении длительного времени сохраняет все свои исходные характеристики, свою привлекательность и эстетичность.
Кроме того, железо прекрасно сочетается с различными облицовочными материалами. Металлы хорошо смотрятся в интерьере вместе с изделиями из натуральной древесины и камня, рядом с каминами и книжными полками, на фоне облицованных обоями и досками стен.
Широкие возможности примененич и большой ассортимент на рынке позволяет реализовывать на практике с помощью металлических изделий самые разные решения и идеи. Они могут быть придуманы как профессиональными дизайнерами, так и собственниками объекта, в полном соответствии с их индивидуальными вкусами, требованиями и нуждами.
Рассчитать стоимость
Металл для стен
Среди всех возможностей декорирования помещений с помощью изделий из металла, самой популярной и часто реализуемой является применение аксессуаров из стали в оформлении стен. Такой декор можно разместить над диваном или в обеденной зоне, над кроватью в спальной зоне, на кухне и в любом другом уголке дома.
Изделия подходят для стен в домах разных стилей. Их используют в классических и современных интерьерах, в стилях модерн, хай-тек, лофт и многих других. Чтобы правильно украсить помещение рекомендуется предварительно разработать дизайн-проект внутренней отделки и выбирать все элементы обстановки по нему.
Чтобы правильно украсить помещение рекомендуется предварительно разработать дизайн-проект внутренней отделки и выбирать все элементы обстановки по нему.
Для стен можно использовать как аксессуары, представленные на рынке различными производителями, так и заказывать создание определенных изделий именно для себя. Сегодня многие фирмы предлагают своим клиентам услуги по изготовлению металлических изделий на заказ.
Список металлов
Выделенные элементы считаются металлическими элементами.Большинство элементов можно считать металлами. Они сгруппированы в середине левой части таблицы Менделеева. Металлы состоят из щелочных металлов, щелочноземельных металлов, переходных металлов, лантаноидов и актинидов.
Свойства металлов
Металлы обладают несколькими общими свойствами, в том числе:
- твердым при комнатной температуре (за исключением ртути)
- обычно блестящим
- высокой температурой плавления
- хорошим проводником тепла
- хорошим проводником тепла электричество
- с низкой энергией ионизации
- с низкой электроотрицательностью
- ковкий — может быть измельчен в листы
- пластичный — можно натянуть на проволоку
- высокая плотность (исключения: литий, калий и натрий)
- коррозия в воздухе или морской воде
- теряет электроны в реакциях
* Бонусный факт * При определенных условиях водород может действовать как металлический элемент.Эти условия обычно встречаются в экстремальных условиях, таких как высокое давление или замерзшее твердое вещество.
Список металлов
Это список металлов в порядке возрастания атомного номера.
| НОМЕР | СИМВОЛ | ЭЛЕМЕНТ | ||
| 3 | Li | Литий | ||
| 4 | Be | Бериллий | ||
| 11 | Na | Натрий | 1251||
| Mg | Магний | |||
| 13 | Al | Алюминий | ||
| 19 | K | Калий | ||
| 20 | Ca | Кальций | ||
| 21 | Sc | Скандий | ||
| 22 | Ti | Титан | ||
| 23 | V | Ванадий | ||
| 24 | Cr | Хром | ||
| 25 | Mn | Марганец | ||
| 26 | Fe | Железо | ||
| 27 | 900 45 CoКобальт | |||
| 28 | Ni | Никель | ||
| 29 | Cu | Медь | ||
| 30 | Zn | Цинк | ||
| 31 | Ga | Галлий | ||
| 37 | Rb | Рубидий | ||
| 38 | Sr | Стронций | ||
| 39 | Y | Иттрий | ||
| 40 | Zr | Цирконий | ||
| 41 | Nb | Ниобий | ||
| 42 | Mo | Молибден | ||
| 43 | Tc | Технеций | ||
| 44 | Ru | Рутений | ||
| 45 | Rhd46 | |||
| 46 | Pd | Палладий | ||
| 47 | Ag | Серебро | ||
| 48 | Cd | Кадмий | ||
| 49 | In | Индий | ||
| 50 | Sn | Олово | ||
| 55 | Cs | Цезий | ||
| 56 | Ba | Барий | ||
| 57 | La | Лантан | ||
| 58 | Ce | Церий | ||
| 59 | Pr | Празеодим | ||
| 60 | Nd | Неодим | ||
| 61 | Pm | Прометий | ||
| 62 | Sm | Самарий | ||
| 63 | Eu | Европий | ||
| 64 | Gadolinium | |||
| 65 | Tb | Тербий | ||
| 66 | Dy | Диспрозий | ||
| 67 | Ho | Гольмий | ||
| 68 | Er | Эрбий | ||
| 69 | Tm | Тулий | ||
| 70 | Тулий | Y | Иттербий | |
| 71 | Lu | Лютеций | ||
| 72 | Hf | Гафний | ||
| 73 | Ta | Тантал | ||
| 74 | W | Вольфрам | ||
| 75 | Re | Рений | ||
| 76 | Os | Осмий | ||
| 77 | Ir | Иридий | ||
| 78 | Pt | Платина | ||
| 79 | Au | Золото | ||
| 80 | Hg | Меркурий | ||
| 81 | Tl | Таллий | ||
| 82 | Pb | Свинец | ||
| 83 | Bi | Висмут | ||
| 84 | Po | Полоний | ||
| 8746 | Fr | Франций | ||
| 88 | Ra | Радий | ||
| 89 | Ac | Актиний | ||
| 90 | Th | Торий | ||
| 91 | Па | Протактиний | ||
| 92 | U | Уран | ||
| 93 | Np | Нептуний | ||
| 94 | Pu | Плутоний | ||
| 95 | Am | Америций | ||
| 96 | C | Кюрий | ||
| 97 | Bk | Берклий | ||
| 98 | Cf | Калифорний | ||
| 99 | Es | Эйнштейний | ||
| 100 | Fm | Фермий | ||
| 101 | Md | Менделевий | 102№ | Нобелиум |
| 103 | Lr | Лоуренсий | ||
| 104 | Rf | Резерфордий | ||
| 105 | Db | Дубний | 106 | Сегаборг |
| 107 | Bh | Бориум | ||
| 108 | Hs | Калий | ||
| 109 | Mt | Мейтнерий | ||
| 110 | Ds | Дармштадций | ||
| Rg | Рентгений 900 46 | |||
| 112 | Cn | Copernicium | ||
| 113 | Nh | Nihonium | ||
| 114 | Fl | Flerovium | ||
| 115 | Mc | Moscovium | ||
| 116 | Lv | Livermorium |
Металлы, металлоиды и неметаллы — группы классификации элементов
Элементы периодической таблицы можно разделить на три группы: металлы, металлоиды и неметаллы.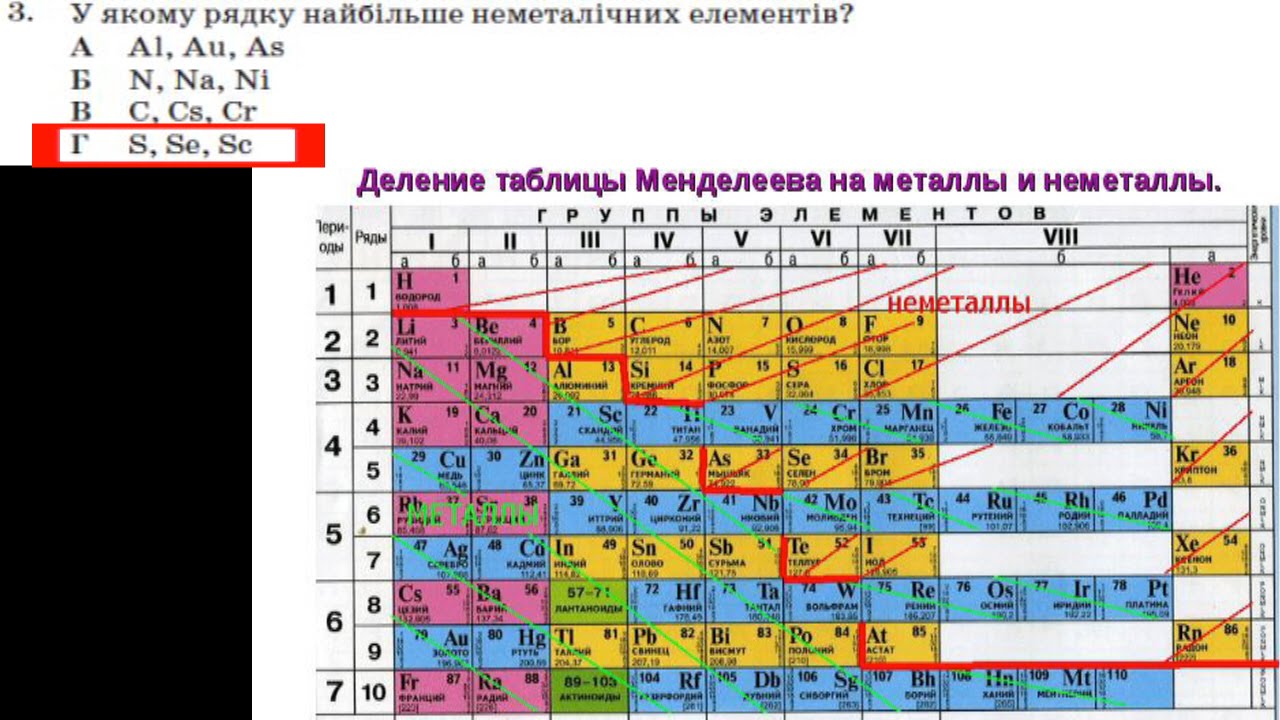 .
.
В этой периодической таблице показаны три разные группы элементов. Металлоидная группа отделяет металлы от неметаллов. Элементы слева — это металлы, а неметаллы — справа. Исключение составляет элемент водород. Водород обладает свойствами неметалла при нормальных температурах и давлениях и щелочного металла при чрезвычайно высоком давлении.
Некоторые периодические таблицы включают зигзагообразную линию, чтобы различать металлы и металлоиды. Линия начинается ниже бора (B) и проходит между висмутом (Bi) и полонием (Po) или вниз между ливерморием (Lv) и теннессином (Ts).На самом деле металлы вблизи линии часто проявляют неметаллические свойства, а неметаллы имеют какой-то металлический характер.
Свойства металлов
Большинство элементов — металлы. Металлы включают группы щелочных металлов, щелочноземельных металлов, переходных металлов, основных металлов, лантаноидов и актинидов. Металлы обладают следующими свойствами:
- Твердое вещество при комнатной температуре (за исключением ртути)
- Обычно блестящее, с металлическим блеском
- Высокая температура плавления
- Хороший проводник тепла
- Хороший проводник электричества
- Податливый — способный для измельчения в листы
- Пластичный — можно натянуть на проволоку
- Высокая плотность (исключения: литий, калий и натрий)
- Коррозия на воздухе или в морской воде
- Терять электроны в реакциях
Свойства металлоидов или полуметаллов
Металлоиды или полуметаллы обладают некоторыми свойствами металлов и некоторыми неметаллами.Металлоиды обычно имеют несколько форм или аллотропов с очень разными свойствами. Характеристики металлоидов включают:
- Может быть тусклым или блестящим
- Проводить тепло и электричество, но не так хорошо, как металлы
- Хорошие полупроводники
- Обычно пластичные
- Обычно пластичные
- Могут как приобретать, так и терять электроны в реакциях
Свойства неметаллов
Неметаллы включают группу неметаллов, а также галогены и благородные газы.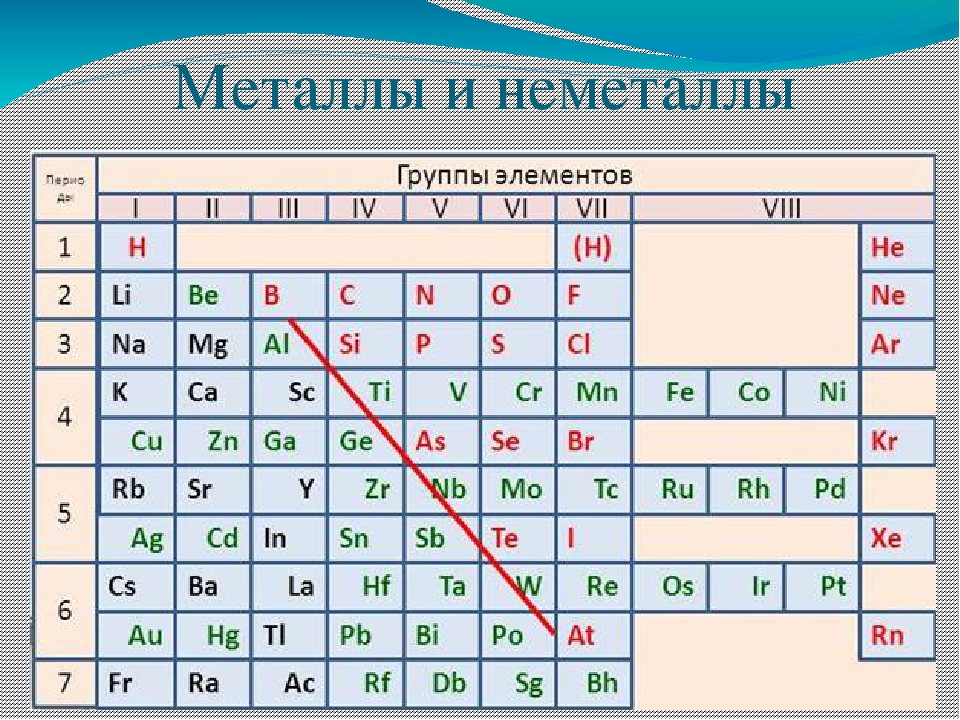 Свойства неметаллов включают:
Свойства неметаллов включают:
- Тусклый, не блестящий
- Плохой проводник тепла
- Плохой проводник электричества
- Не ковкий или пластичный, обычно хрупкий
- Более низкая плотность (по сравнению с металлами)
- Более низкая температура плавления и кипения баллов (по сравнению с металлами)
- Получение электронов в реакциях
Металлы и неметаллы
Быстрое сравнение металлов и неметалловЭлементы могут быть классифицированы как металлы, неметаллы или металлоиды.Элементы с некоторыми характеристиками металлов и некоторых неметаллов являются металлоидами. Металлы находятся в левой части таблицы Менделеева. Неметаллы находятся в правой части таблицы. Металлоиды расположены зигзагообразно на столе, разделяя металлы и неметаллы. Вот посмотрите на разницу между металлами и неметаллами.
Металлы, металлоиды и неметаллы в таблице Менделеева| Металлы | Неметаллы |
| Металлический блеск (блестящий) | Бесцветный |
| Хорошие проводники тепла и электричества | Плохие проводники тепла и электричества |
| Податливый — можно расколоть на листы | Хрупкие твердые тела |
| Податливый — можно растянуть на проволоку | Непластичный |
| Непрозрачные тонкие листы | Прозрачные тонкие листы |
| Звонкие (звук колокола при ударе) | Бесшумный |
| Обычно твердое вещество при комнатной температуре | Твердое вещество, жидкость или газ при комнатной температуре |
| Образует катионы (положительно заряженные ионы) | Образует анионы (отрицательно заряженные ионов) |
| Обычно 1-3 электрона во внешней оболочке | Обычно 4-8 электронов во внешней оболочке |
| Образуют основные оксиды | Образуют кислые оксиды |
| Хорошие восстановители | Хорошие окислители |
| Низкая электроотрицательность | Высокая электроотрицательность |
| Низкая энергия ионизации | Высокая энергия ионизации |
| Преимущественно высокие температуры плавления | Низкие температуры плавления |
| От среднего до большого атомного радиуса | От малого до среднего атомного радиуса |

Металлы
Около 75% элементов в таблице Менделеева — металлы. Поскольку многие элементы являются металлами, они подразделяются на более мелкие группы, включая щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные или основные металлы, лантаноиды и актиниды. Большинство металлов легко узнать по их блестящему металлическому виду. Но у них есть общие свойства друг с другом.
Физические свойства металла
- Блестящий (блестящий)
- Хорошие проводники тепла и электричества
- Высокая температура плавления
- Высокая плотность (тяжелая для своих размеров)
- Ковкий (может быть забит молотком)
- Пластичный (может быть втянутым в проволоку)
- Обычно твердая при комнатной температуре (исключение — ртуть)
- Непрозрачная, как тонкий лист (не видно сквозь металлы)
- Металлы звонкие или издают колоколообразный звук при ударе
M и др. Химические свойства
- Имеют 1-3 электрона на внешней оболочке каждого атома металла и легко теряют электроны
- Легко подвержены коррозии (например.g., повреждены окислением, например, потускнением или ржавчиной)
- Легко теряют электроны
- Образуют основные оксиды
- Имеют низкие значения электроотрицательности
- Хорошие восстановители
Неметаллы
Неметаллы включают неметаллы, галогены и группы благородных газов в периодической таблице. Хотя большинство металлов являются твердыми при комнатной температуре, существуют неметаллические твердые вещества, жидкости и газы. Неметаллы — это разнообразный набор элементов, но у них есть некоторые общие свойства.
Физические свойства неметалла
- Не блестящий (тусклый, иногда бесцветный)
- Плохие проводники тепла и электричества
- Непластичные твердые вещества
- Хрупкие твердые вещества
- Могут быть твердыми, жидкостями или газами при комнатной температуре
- Прозрачный в виде тонкого листа
- Неметаллы не звучат
Неметаллы Химические свойства
- Обычно имеют 4-8 электронов на внешней оболочке
- Легко получают или делятся валентными электронами
- Образуют кислые оксиды
- электроотрицательность
- Хорошие окислители
Металлоиды
Для идентификации металлоидов полезно знать разницу между металлами и неметаллами. Металлоиды обладают некоторыми свойствами металлов и некоторыми свойствами неметаллов. В общем, металлоиды часто кажутся металлическими, но, скорее всего, это полупроводники, чем проводники. Как и неметаллы, металлоиды не являются ни пластичными, ни пластичными. В твердом состоянии при комнатной температуре металлоиды имеют более низкие температуры плавления, чем большинство металлов. Металлоиды имеют промежуточные значения электроотрицательности между металлами и неметаллами.
Металлоиды обладают некоторыми свойствами металлов и некоторыми свойствами неметаллов. В общем, металлоиды часто кажутся металлическими, но, скорее всего, это полупроводники, чем проводники. Как и неметаллы, металлоиды не являются ни пластичными, ни пластичными. В твердом состоянии при комнатной температуре металлоиды имеют более низкие температуры плавления, чем большинство металлов. Металлоиды имеют промежуточные значения электроотрицательности между металлами и неметаллами.
Источники
- Askeland, D.R .; Fulay, P.P .; Райт, Дж. (2011). Наука и инженерия материалов (6-е изд.). Cengage Learning, Стэмфорд, Коннектикут. ISBN 0-495-66802-8.
- Lide, D.R .; Фредерикс, Г. (ред.) (1998). CRC Справочник по химии и физике (79-е изд.). CRC Press, Бока-Ратон, Флорида. ISBN 0-849-30479-2.
- Tilley, R.J.D. (2004). Понимание твердых тел: материаловедение (4-е изд.). Джон Вили, Нью-Йорк.
Список всех элементов, которые считаются металлами
Большинство элементов — металлы.В эту группу входят щелочные металлы, щелочноземельные металлы, переходные металлы, основные металлы, лантаноиды (редкоземельные элементы) и актиниды. Хотя лантаноиды и актиниды разделены в периодической таблице, на самом деле это особые типы переходных металлов.
Вот список всех элементов периодической таблицы, являющихся металлами.
Щелочные металлы
Щелочные металлы находятся в группе IA в крайней левой части таблицы Менделеева. Это высокореакционные элементы, отличающиеся степенью окисления +1 и, как правило, низкой плотностью по сравнению с другими металлами.Поскольку они обладают такой реакционной способностью, эти элементы находятся в соединениях. В природе свободен только водород как чистый элемент, то есть как двухатомный водород.
- Водород в металлическом состоянии (обычно считается неметаллом)
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
Щелочноземельные металлы
Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов.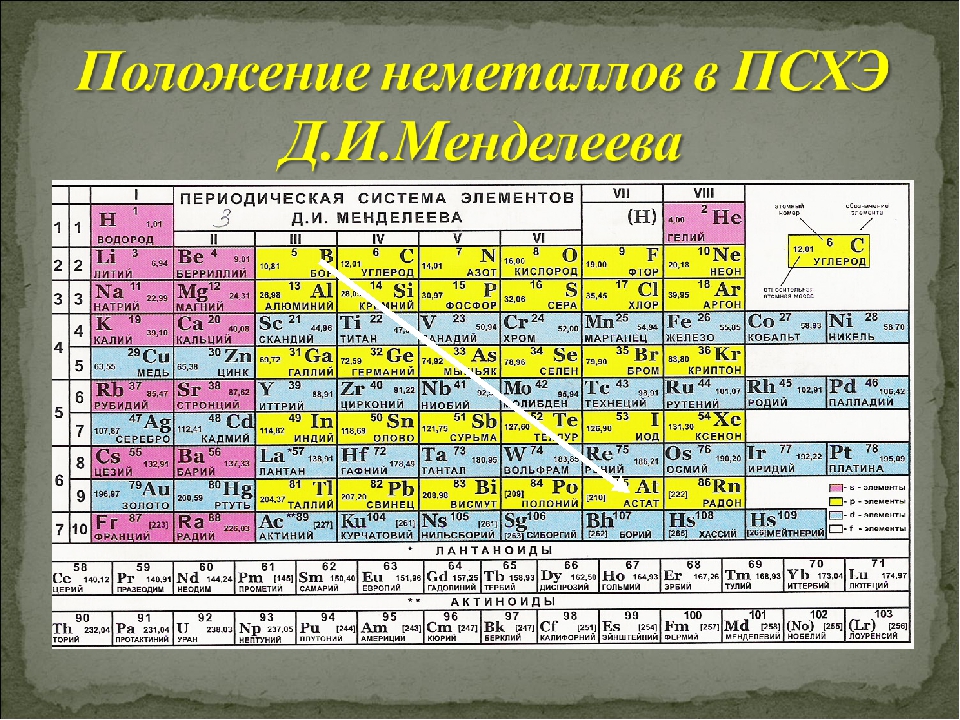 Все атомы щелочноземельных металлов имеют степень окисления +2. Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. Щелочноземельные металлы обладают меньшей реакционной способностью, чем щелочные металлы. Металлы группы IIA твердые и блестящие, обычно ковкие и пластичные.
Все атомы щелочноземельных металлов имеют степень окисления +2. Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. Щелочноземельные металлы обладают меньшей реакционной способностью, чем щелочные металлы. Металлы группы IIA твердые и блестящие, обычно ковкие и пластичные.
- Бериллий
- Магний
- Кальций
- Стронций
- Барий
- Радий
Основные металлы
Основные металлы обладают характеристиками, которые люди обычно ассоциируют с термином «металл».«Они проводят тепло и электричество, имеют металлический блеск и имеют тенденцию быть плотными, пластичными и пластичными. Однако некоторые из этих элементов обладают неметаллическими характеристиками. Например, один аллотроп олова ведет себя больше как неметалл. твердые, свинец и галлий являются примерами мягких элементов. Эти элементы, как правило, имеют более низкие температуры плавления и кипения, чем переходные металлы (за некоторыми исключениями).
- Алюминий
- Галлий
- Индий
- Олово
- Таллий
- Свинец
- Висмут
- Нихоний: вероятно, основной металл
- Флеровий: вероятно, основной металл
- Московий: возможно, основной металл
- основной металл
- Теннессин: относится к группе галогенов, но может вести себя больше как металлоид или металл
Переходные металлы
Переходные металлы характеризуются наличием частично заполненных электронных подоболочек d или f.Поскольку оболочка заполнена не полностью, эти элементы проявляют несколько степеней окисления и часто образуют окрашенные комплексы. Некоторые переходные металлы встречаются в чистом или самородном виде, включая золото, медь и серебро. Лантаноиды и актиниды встречаются только в природных соединениях.
- Скандий
- Титан
- Ванадий
- Хром
- Марганец
- Железо
- Кобальт
- Никель
- Медь
- Цинк
- Иттрий
- Цирконий
- 000
- 000
- 000
- 000
- 000
- 000
- Цирконий
- 000
- 000 Родий
- Палладий
- Серебро
- Кадмий
- Лантан
- Гафний
- Тантал
- Вольфрам
- Рений
- Осмий
- Иридий
0
- Дубин
- Ртуть
0
- Платина
- Дубин
- Платина
- Платина
- Дубин
- Платина
- Сиборгий
- Борий
- Калий
- Мейтнерий
- Дармштадций
- Рентгений
- Коперниций
- Церий
- Празеодим
- Неодим
- Прометий
- 09 Европий
- Гадолиний
- Тербий
- Диспрозий
- Гольмий
- Эрбий
- Тулий
- Иттербий
- Лютеций
- Торий
- Протактиний
- Протактиний 910
- Плутон
- Протактиний 910
- Уран
- Калифорний
- Эйнштейний
- Фермий
- Менделевий
- Нобелий
- Лоуренсий
Подробнее о металлах
В общем, металлы расположены в левой части таблицы Менделеева, их металлический характер уменьшается по мере продвижения вверх и вправо.
В зависимости от условий элементы, принадлежащие к группе металлоидов, могут вести себя как металлы. Кроме того, металлами могут быть даже неметаллы. Например, в определенных ситуациях вы можете найти металлический кислород или металлический углерод.
Частей Периодической таблицы
Когда элементы объединяются, чтобы сформировать соединения, есть два основных типа соединение, которое может возникнуть. Ионные связи образуются при наличии перенос электронов от одного вида к другому, производя заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим взаимодействия и ковалентных связей , которые возникают, когда атомы делятся электронами , чтобы произвести нейтральные молекулы.В целом металл и неметаллы объединяются с образованием ионных соединений , а неметаллы соединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
Поскольку металлы в периодической таблице расположены левее, они имеют низкую энергию ионизации и низкое сродство к электрону, поэтому они относительно легко теряют электроны и с трудом их приобретают. Они также имеют относительно мало валентных электронов и могут образовывать ионы (и тем самым удовлетворять правилу октетов) легче, теряя свою валентность электронов с образованием положительно заряженных катионов .
- Металлы основной группы обычно образуют такие же заряды, как и номер их группы: то есть металлы группы 1А, такие как натрий и калий образуют заряд +1, металлы группы 2А, такие как магний и кальций образуют 2+ зарядов, а металлы группы 3A, такие как в виде алюминия образуют 3+ заряда.
- Металлы, следующие за переходными металлами (в сторону
нижняя часть групп 4A и 5A) могут потерять либо их крайние s и p электронов, образующих заряды, идентичные их
номер группы, или они могут потерять только p электронов, пока
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два.
 Другими словами, олово и свинец в Группе
4A может образовывать заряды 4+ или 2+, а висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+.
Другими словами, олово и свинец в Группе
4A может образовывать заряды 4+ или 2+, а висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда. теряя свою валентность s электронов, но также могут терять электроны со своих d орбиталей с образованием других зарядов. Большинство переходных металлов могут образовывать более одного возможного заряда. в ионных соединениях.
Неметаллы находятся правее в таблице Менделеева и имеют высокие энергии ионизации и высокое сродство к электрону, поэтому они относительно легко получают электроны и с трудом теряют их. У них также есть большее количество валентных электронов, и они уже близко к полному октету из восьми электронов. Неметаллы набирать электроны до тех пор, пока у них не будет того же количества электронов, что и у ближайший благородный газ (Группа 8А), образующий отрицательно заряженные анионы которые имеют заряды, равные номеру группы минус восемь.Это, неметаллы группы 7A образуют заряды 1, неметаллы группы 6A образуют 2- заряды, а металлы группы 5А образуют 3- заряды. Группа 8А элементы уже имеют восемь электронов в их валентных оболочках и имеют малая тенденция к получению или потере электронов, и образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в регулярном массиве, называемом кристаллом .
решетка силами притяжения между противоположно заряженными
катионы и анионы.Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (Для
Например, хлорид натрия, NaCl, плавится при 80 ° С, а оксид алюминия,
Al 2 O 3 , плавится при 2054 ° C.) Ионные соединения:
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворяются в
вода.
Когда неметаллы объединяются с другими неметаллами, они имеют тенденцию делиться электроны в ковалентных связях вместо образования ионов, что приводит к образование нейтральных молекул. (Имейте в виду, что поскольку водород также неметалл, сочетание водорода с другим неметаллом также будет образовывать ковалентную связь.) Молекулярные соединения могут быть газы, жидкости или твердые вещества с низкой температурой плавления и включают широкий спектр веществ. (См. Галерея молекул для Примеры.)
Когда металлы соединяются друг с другом, обычно описывается соединение.
как металлическое соединение (вы уже догадались). В этом
модели, каждый атом металла отдает один или несколько своих валентных электронов
сделать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Поскольку электроны в электроне
море может свободно перемещаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы.Атомы металлов могут
проходят друг мимо друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях притяжениями между катионами и
анионы), позволяя металлу раскалывать листы или втягивать
провод. Различные металлы можно легко комбинировать, чтобы получить сплавы , физические свойства которых могут сильно отличаться от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
которое намного тверже самого железа; хром, ванадий, никель и
другие металлы также часто добавляют в железо для производства сталей различных
типы. Латунь — это сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах. Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была обнаружена древними цивилизациями, она ознаменовала
значительный шаг вперед от использования менее прочных каменных орудий.
Чем металлические элементы отличаются от неметаллических
В настоящее время в таблице Менделеева известно 118 элементов, многие из которых классифицируются как металлические или неметаллические.Первые находятся в левой части таблицы Менделеева, а вторые — в правой части таблицы Менделеева. Однако, помимо их размещения в таблице Менделеева, есть несколько ключевых различий между металлическими и неметаллическими элементами.
Что такое металлический элемент?
По определению, металлический элемент — это элемент, который образует положительные ионы и имеет металлические связи. Большинство элементов периодической таблицы — металлы. Примеры металлических элементов включают железо, медь, серебро, ртуть, свинец, алюминий, золото, платину, цинк, никель и олово.
Что такое неметаллический элемент?
С другой стороны, неметаллический элемент — это элемент, которому не хватает характеристик своих металлических аналогов. Неметаллические элементы не образуют положительных ионов и не обладают металлическими связями. Примеры неметаллических элементов включают водород, гелий, азот, кислород, фтор, хлор, серу, аргон, ксенон, радон и фосфор. Неметаллические элементы встречаются реже, чем металлические элементы, но их все еще доступно на периодической диаграмме.
Различия между металлическими и неметаллическими элементами
Теперь, когда вы знаете основные определения металлических и неметаллических элементов, вам может быть интересно, чем они отличаются. Хотя каждый элемент в периодической таблице имеет свои уникальные свойства, все металлические элементы обычно имеют некоторые общие характеристики, и все неметаллические элементы также имеют некоторые общие характеристики.
Во-первых, металлические элементы обладают высокими свойствами электропроводности. Они способны пропускать электричество с минимальными ограничениями, что делает их идеальными для использования в проводах и кабелях.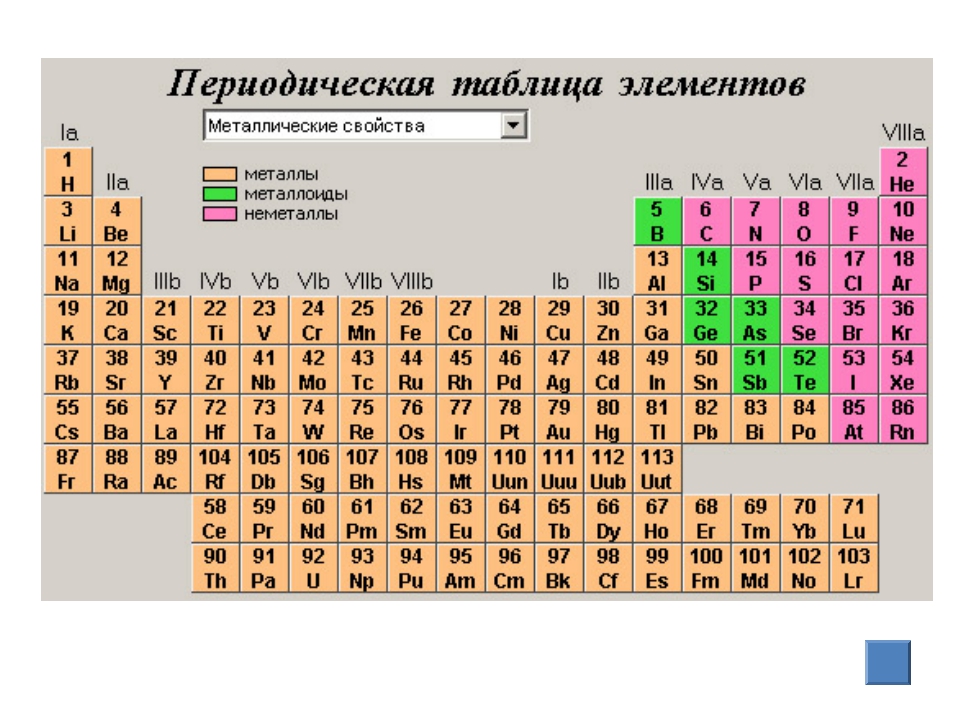 Кроме того, металлические элементы имеют более высокую температуру плавления, чем неметаллические элементы. Другими словами, для плавления металлического элемента требуется больше тепла, чем для плавления неметаллического элемента. Металлические элементы также податливы и пластичны, что позволяет «обрабатывать» их.
Кроме того, металлические элементы имеют более высокую температуру плавления, чем неметаллические элементы. Другими словами, для плавления металлического элемента требуется больше тепла, чем для плавления неметаллического элемента. Металлические элементы также податливы и пластичны, что позволяет «обрабатывать» их.
Неметаллические элементы обладают плохой электрической, а также теплопроводностью. Они не способны пропускать электричество или тепло, а также металлические элементы. Кроме того, неметаллические элементы имеют тусклый вид, который резко контрастирует с блестящим внешним видом металлических элементов.
А как насчет металлоидов?
Помимо металлов и неметаллов, в таблице Менделеева также есть металлоиды. Металлоиды уникальны, потому что их свойства находятся где-то между металлическими и неметаллическими элементами. Они не особенно блестящие и не особо тусклые. Скорее, они находятся где-то посередине по внешнему виду и другим свойствам.
Нет тегов для этого сообщения. Щелочноземельный металл| Свойства, список и реактивность
Щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы.Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
таблица МенделееваСовременная версия периодической таблицы элементов (для печати).
Encyclopædia Britannica, Inc.Возникновение, свойства и использование
До XIX века неметаллические, нерастворимые в воде и неизмененные в результате пожара вещества назывались землей. Эти земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированная сода и поташ), назывались щелочноземельными.Таким образом, щелочные земли отличались от щелочных и других земель, таких как глинозем и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные земли, затем стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году.
Металлы, оксиды которых составляют щелочноземельные земли, затем стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году.
Как и в случае щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны и становятся положительными ионами (катионами). Поэтому большинство их типичных соединений являются ионными: соли, в которых металл присутствует в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат ионы M + ), хлориду натрия ( NaCl) и оксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (то есть щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, наиболее тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются очень реактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести наиболее распространенных элементов на Земле) и играют важную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Этот металл никогда не производился в промышленных масштабах, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, их в значительной степени вытеснили менее дорогие альтернативы.
Этот металл никогда не производился в промышленных масштабах, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, их в значительной степени вытеснили менее дорогие альтернативы.
История
Самым ранним из известных щелочноземельных металлов была известь (латинское calx ), которая теперь известна как оксид кальция; его использовали в древности в составе раствора. Магнезия (название происходит, вероятно, от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочноземельный элемент, отличный от извести; он заметил, что магнезия дает растворимый сульфат, тогда как полученный из извести, как известно, нерастворим.В 1774 году шведский химик Карл Вильгельм Шееле, открывший кислород, обнаружил, что минерал под названием тяжелый шпат или барис (по-гречески «тяжелый») содержит новую землю, которая стала известна как барита (оксид бария). Другая земля, стронция (оксид стронция), была идентифицирована лондонскими химиками Уильямом Крукшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), обнаруженного в свинцовой шахте в Стронтиане в Аргайлшире, Шотландия. Бериллия (оксид бериллия) была извлечена из минерала берилла и признана землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году.Хотя сначала его путали с глиноземом (оксидом алюминия), потому что оба они растворяются в щелочи, бериллий оказался отличным от других; в отличие от оксида алюминия, он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально бериллия называлась glucina (греч. glykys , «сладкий») из-за ее сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Кристалл аквамарина Кристалл аквамарина, драгоценной формы минерала берилла (силикат бериллия и алюминия).Берилл также является коммерческим источником бериллия.