Удельная теплоемкость водных растворов | это… Что такое Удельная теплоемкость водных растворов?
Толкование
- Удельная теплоемкость водных растворов
× Источник: Краткий справочник физико-химических величин.Вещество Температура, °С ср, Дж/(г·К), при концентрации m, моль/кг H2O 2,22 1,11 0,555 0,278 CdSO4 12 2,91 3,40 3,74 — CuSO4 18-23 — 3,52 3,98 HCl 18 3,68 3,90 4,04 4,10 HNO3 18 3,62 3,89 4,03 — H2SO4 21 3,57 3,83 4,00 4,09 KCl 18 3,46 3,78 3,97 4,06 KNO3 18-23 3,48 3,77 3,95 4,04 KOH 18 3,00 3,83 3,99 4,08 MgSO4 18 3,24 3,59 3,84 3,99 NH4CH3COO 17,5 3,81 3,98 4,08 — NH4Cl 18 3,67 3,92 4,04 4,11 NH4NO3 3,68 3,89 4,03 — NaCH3COO 18 — 3,93 4,04 — NaCl 18 3,68 3,90 4,03 4,09 NaNO3 18 3,61 3,83 3,98 4,08 NaOH 18 3,80 3,94 4,05 —  Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой — СПб.: «Иван Федоров», 2003 г. С. 53
Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой — СПб.: «Иван Федоров», 2003 г. С. 53
Химический справочник. 2014.
Игры ⚽ Нужно решить контрольную?
- Удельная теплоемкость водных растворов карбамида
- Удельная электрическая проводимость растворов KCl в интервале 0-30°С
Полезное
Определение удельной теплоемкости раствора
Цель работы: Расчет удельной теплоемкости раствора из экспериментальных калориметрических измерений
Приборы и реактивы: калориметр, мешалка, термометр Бекмана или другой термометр, технические весы, фильтровальная бумага, 10 — 30%-ные растворы солей, например: CaCl2, MgCl2, ZnCl2, MgSO4 и др.
 Затем по
разности весов находят массу раствора.
Внутренний стакан с раствором помещают
в калориметр, закрывают и включают
мешалку. Вследствие того, что температура
стакана, раствора, мешалки и воздуха в
помещении неодинакова, то в течение
300-600 секунд после помещения стакана с раствором в
калориметр происходит выравнивание
температур.2 Первые измерения температуры рекомендуется
начинать по истечении этого времени.
Затем по
разности весов находят массу раствора.
Внутренний стакан с раствором помещают
в калориметр, закрывают и включают
мешалку. Вследствие того, что температура
стакана, раствора, мешалки и воздуха в
помещении неодинакова, то в течение
300-600 секунд после помещения стакана с раствором в
калориметр происходит выравнивание
температур.2 Первые измерения температуры рекомендуется
начинать по истечении этого времени.Измерения температуры проводят термометром Бекмана (или другим термометром) через каждые тридцать секунд в течение 300 с. Затем включают электрический нагрев и проводят измерения силы тока в цепи, потенциала и температуры до тех пор, пока последняя не поднимется на 1,5…2 град., затем ток выключают, а измерения продолжают ещё 600 с.
После этого мешалку
выключают, раствор сливают обратно в
исходную склянку, промывают стакан
дистиллированной водой и протирают
насухо фильтровальной бумагой. Взвешивают
стакан, затем наливают в него такое же
количество воды, как и раствора, снова
взвешивают и определяют массу воды.
Затем проводят такой же опыт с водой с
измерением температуры.
Взвешивают
стакан, затем наливают в него такое же
количество воды, как и раствора, снова
взвешивают и определяют массу воды.
Затем проводят такой же опыт с водой с
измерением температуры.
Исходя из экспериментальных данных, строят графические зависимости температура [К (С)] — время, с как для воды, так и раствора, по которым находят изменение температуры Т. По уравнению (3) находят суммарные теплоемкости раствора (или воды) и калориметра, СI и СII, соответственно.
СI=Сраствор+Скалориметр (5)
СII=Свода+Скалориметр (6)
Поскольку удельная
теплоемкость воды известна (табл.1), она
позволяет рассчитать теплоемкость
взятой массы воды: Свода=Суд.(вода)
mвода.
Отсюда находят теплоемкость калориметра
и удельную теплоемкость раствора соли.
Таблица 1
Плотность (ρ) и удельный объем (υ) воды при разных температурах (t,°C)3
t, °C | ρ, кг/м 3 | υ,10-2, м3/кг | t, °C | ρ, кг/м3 | υ,10-2, м3/кг | t, °C | ρ, кг/м3 | υ,10-2, м3/кг |
6 | 999. | 1.00006 | 16 | 998.94 | 26 | 996.78 | 1.00323 | |
7 | 999.90 | 1.00010 | 17 | 998.77 | 1.00123 | 27 | 996.51 | 1.00350 |
8 | 999.85 | 1.00015 | 18 | 998.59 | 1.00141 | 28 | 996. | 1.00378 |
9 | 999.78 | 1.00022 | 19 | 998.40 | 1.00160 | 29 | 995.94 | 1.00408 |
10 | 999.70 | 1.00030 | 20 | 998.20 | 1.00180 | 30 | 995.64 | 1.00438 |
11 | 999.60 | 1.00040 | 21 | 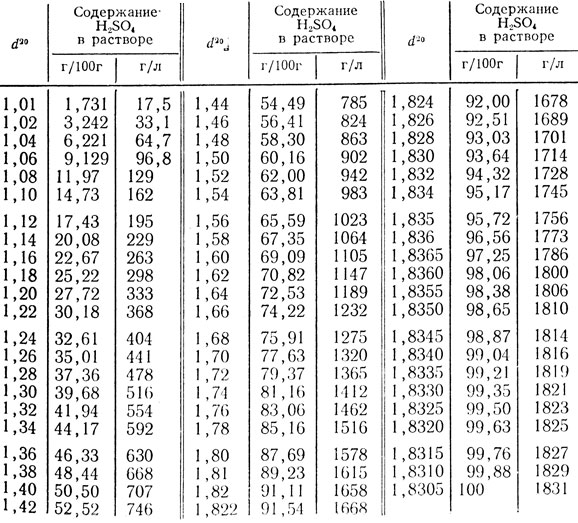 99 99 | 1.00201 | 35 | 994.03 | 1.00601 |
12 | 999.49 | 1.00051 | 22 | 997.77 | 1.00224 | 40 | 992.21 | 1.00785 |
13 | 999.37 | 1.00063 | 23 | 997.53 | 1.00247 | 45 | 990.21 | 1.00988 |
14 | 999. | 1.00076 | 24 | 999.7 | 1.00271 | 50 | 988.04 | 1.01210 |
15 | 999.10 | 1.00090 | 25 | 997.04 | 1.00297 | 55 | 985.70 | 1.01451 |
Результаты экспериментальных измерений вносят в таблицу 24
Время, с | Температура, С | Сила тока, А | Напряжение, В |
Первый период для раствора соли (пример) | |||
30 | 17. | ||
60 | 17.20 | ||
90 | 17.30 | ||
120 | 17.35 | ||
150 | 17.35 | ||
180 | 17.35 | ||
210 | 17.35 | ||
240 | 17.45 | ||
270 | 17. | ||
300 | 17.45 | ||
330 | 17.40 | ||
360 | 17.45 | ||
и т.д. | |||
Главный период (включен ток) | |||
30 | 17.45 | ||
60 | 1.2 | ||
90 | 0. | ||
120 | 17.55 | ||
150 | 1.20 | ||
180 | 0.87 | ||
и т.д. | 17.70 | ||
Отчет по работе
должен содержать:
— теоретическое обоснование экспериментальной части работы,
— методику эксперимента, включающую схему установки,
— данные по составу и количеству используемого раствора,
— таблицу 2 наблюдений,
— графические зависимости, построенные на миллиметровой бумаге,
температуры от времени5,
— расчет удельной теплоёмкости раствора,
— расчет относительной
и абсолютной погрешности измерений.
Относительная погрешность измерений не должна превышать 5%.
Работа считается зачтенной, если она отвечает всем требованиям, указанным выше. Оценка состоит из трех позиций: собственно лабораторная работа и отчет по ней – 5 баллов, коллоквиум или соответствующий тест – 10 баллов и решение задач (или контрольная работа) – 5 баллов.
Формула теплоты растворения — GeeksforGeeks
Теплота растворения определяется как разница в энтальпии между растворяющим веществом и растворителем при постоянном давлении, что приводит к бесконечному разбавлению. Когда растворенное вещество растворяется в растворителе, обнаруживается изменение энтальпии, которое называется теплотой растворения или теплотой растворения. Он равен произведению массы, изменения температуры и удельной теплоемкости растворителя. Обозначается символом ΔH. Его стандартной единицей измерения является кДж/моль.
Формула
Примеры задачΔH = m × ΔT × S
где,
ΔH – теплота растворения,
m – масса растворителя,
ΔT – изменение температуры,
S – удельная теплоемкость растворителя.
Задача 1. Вычислить теплоту растворения гидратированной соли в воде при температуре 300 К и скорости 43 кДж/моль. Удельная теплоемкость воды 0,004184 кДж/г ∘ C.
Решение:
Имеем,
m = 43
T = 300
S = 0. 004184
Используя формулу, которую мы имеем,
ΔH = m × ΔT × S
= 43 × 300 × 0,004184
= 53,97 кДж/моль
Задача 2. Вычислить теплоту раствора при растворении гидратированной соли в воде при 250 К и скорости 65 кДж/моль. Удельная теплоемкость воды 0,004184 кДж/г ∘ С.
Решение:
Имеем,
m = 65
T = 250
S = 0,004184
Используя формулу, которую мы имеем,
ΔH = m × ΔT × S
= 65 × 250 × 0,004184
= 68 кДж/моль
Задача 3. Вычислить теплоту растворения гидратированной соли в растворителе при 150 К и скорости 20 кДж/моль. Удельная теплоемкость растворителя 0,062 кДж/г ∘ С.
Вычислить теплоту растворения гидратированной соли в растворителе при 150 К и скорости 20 кДж/моль. Удельная теплоемкость растворителя 0,062 кДж/г ∘ С.
Решение:
Имеем,
m = 20
T = 150
S = 0,062
Используя полученную формулу,
ΔH = m × Δ Т × S
= 20 × 150 × 0,062
= 186 КДж/моль
Задача 4. Вычислить массу растворителя при растворении в нем гидратной соли при теплоте раствора 150 КДж/моль и 100 К. Удельная теплоемкость растворителя 0,165 кДж/г ∘ C.
Решение:
Имеем,
ΔH = 150
T = 100
S = 0,165
Используя формулу, которую мы имеем,
ΔH = m × ΔT × S
=> 150 = m × 100 × 0,165
=> м = 150 /16,5
=> m = 9,09 кДж
Задача 5. Вычислить массу растворителя при растворении в нем гидратированной соли при теплоте раствора 450 кДж/моль и 500 К. Удельная теплоемкость растворителя равна 0,542 кДж/г ∘ С.
Удельная теплоемкость растворителя равна 0,542 кДж/г ∘ С.
Решение:
Имеем,
ΔH = 450
T = 500
S = 0,542
Используя полученную формулу,
ΔH = m × ΔT × S
=> 450 = м × 500 × 0,542
=> m = 450/271
=> m = 1,66 кДж
Задача 6. Рассчитать изменение температуры растворителя при растворении в нем гидратированной соли при теплоте раствора 170 кДж/моль и скорости 70 кДж на моль. Удельная теплоемкость растворителя 0,004 кДж/г ∘ С.
Решение:
Имеем,
ΔH = 170
m = 70
S = 0,004
Используя формулу, которую мы имеем,
ΔH = m × ΔT × S
=> 170 = 70 × ΔT × 0,004
=> ΔT = 170/0,28
=> ΔT = 607 K
Задача 7. Рассчитать изменение температуры растворителя при растворении в нем гидратированной соли при теплоте раствора 60 0 кДж/моль и скоростью 120 кДж/моль. Удельная теплоемкость растворителя 0,076 кДж/г ∘ C.
Удельная теплоемкость растворителя 0,076 кДж/г ∘ C.
Решение:
Имеем,
ΔH = 600
m = 120
S = 0,076
Используя формулу, которую мы имеем,
ΔH = m × ΔT × S
=> 600 = 120 × ΔT × 0,076
=> ΔT = 600/9,12
=> ΔT = 65,78 K
17.13: Теплота раствора — Химия Бесплатные тексты
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53881
При приготовлении растворов концентрированной серной кислоты инструкции обычно требуют медленного добавления кислоты в воду при частом перемешивании. Когда эта кислота смешивается с водой, в процессе растворения выделяется много тепла. Если к кислоте добавить воду, вода быстро нагреется и разбрызгивается, причиняя вред человеку, делающему раствор. 9-} \left( aq \right) + 82,8 \: \text{kJ}\nonumber \]
Если к кислоте добавить воду, вода быстро нагреется и разбрызгивается, причиняя вред человеку, делающему раствор. 9-} \left( aq \right) + 82,8 \: \text{kJ}\nonumber \]
Молярная теплота раствора \(\left( \Delta H_\text{soln} \right)\) Вещество – это теплота, поглощаемая или выделяемая при растворении одного моля вещества в воде. Для хлорида кальция \(\Delta H_\text{soln} = -82,8 \: \text{кДж/моль}\).
Рисунок \(\PageIndex{1}\): Химические горячие и холодные компрессы работают за счет теплоты растворения химикатов внутри них. Когда пакет сжимается, внутренний пакет лопается, позволяя химическому веществу растворяться в воде. Тепло выделяется в горячем пакете и поглощается холодным пакетом. (CC BY-NC; CK-12) 9-} \left( aq \right)\nonumber \] Холодные компрессы обычно используются для лечения мышечных растяжений и болей в суставах. Холодный компресс активируется и прикладывается к пораженному участку. Когда нитрат аммония растворяется, он поглощает тепло тела и помогает уменьшить отек. \text {o} \text{C}\) воды в поролоновом калориметре. Предполагая отсутствие потерь тепла, рассчитайте конечную температуру воды.
\text {o} \text{C}\) воды в поролоновом калориметре. Предполагая отсутствие потерь тепла, рассчитайте конечную температуру воды.
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу. Известно- Масса \(\ce{NaOH} = 50,0 \: \text{g}\)
- Молярная масса \(\ce{NaOH} = 40,00 \: \text{г/моль}\)
- \(\Delta H_\text{soln} \: \left( \ce{NaOH} \right) = -44,51 \: \text{кДж/моль}\)
- Масса \(\ce{H_2O} = 1,000 \: \text{кг} = 1000. \: \text{г}\) (предполагается плотность \(= 1,00 \: \text{г/мл}\)) 9\текст{о} \текст{С}\)
Это многошаговая задача:
1) Граммы \(\ce{NaOH}\) преобразуются в моли.
2) Количество молей умножается на молярную теплоту раствора.
3) Джоули тепла, выделяемого в процессе растворения , используются с уравнением удельной теплоемкости и общей массой раствора для расчета \(\Delta T\).
4) \(T_\text{final}\) определяется из \(\Delta T\).
Шаг 2: Решить. 9\text{o} \text{C}\nonumber \] Шаг 3: Подумайте о своем результате.В процессе растворения выделяется большое количество тепла, что приводит к повышению температуры раствора. Следует соблюдать осторожность при приготовлении концентрированных растворов гидроксида натрия из-за выделения большого количества тепла.
Резюме
- Молярная теплота растворения \(\left( \Delta H_\text{soln} \right)\) вещества – это теплота, поглощаемая или выделяемая при растворении одного моля вещества в воде.
- Приведены примеры расчетов с использованием молярной теплоты раствора.
Эта страница под названием 17.13: Heat of Solution распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
 Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой — СПб.: «Иван Федоров», 2003 г. С. 53
Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой — СПб.: «Иван Федоров», 2003 г. С. 53 94
94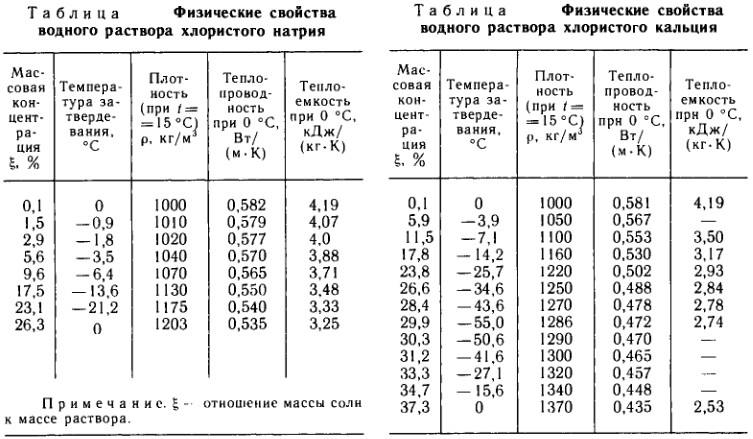 23
23 24
24 20
20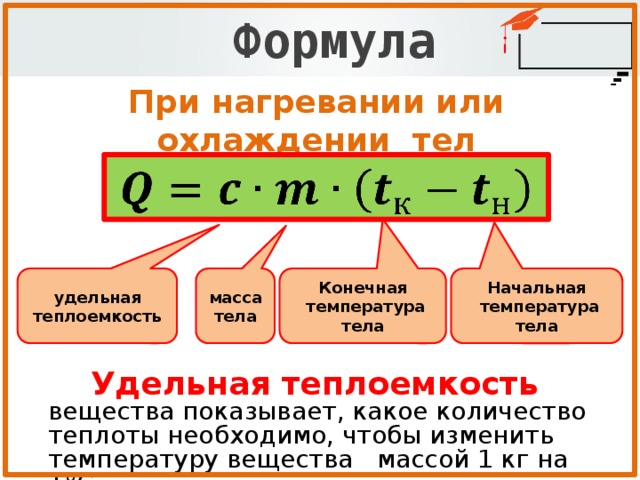 40
40 85
85