Растворы
Авторы: Гаммель И. В., Кононова С. В., Раскаткина Л. В.I. РАСТВОРЫ. ОСНОВНЫЕ ПОНЯТИЯ.
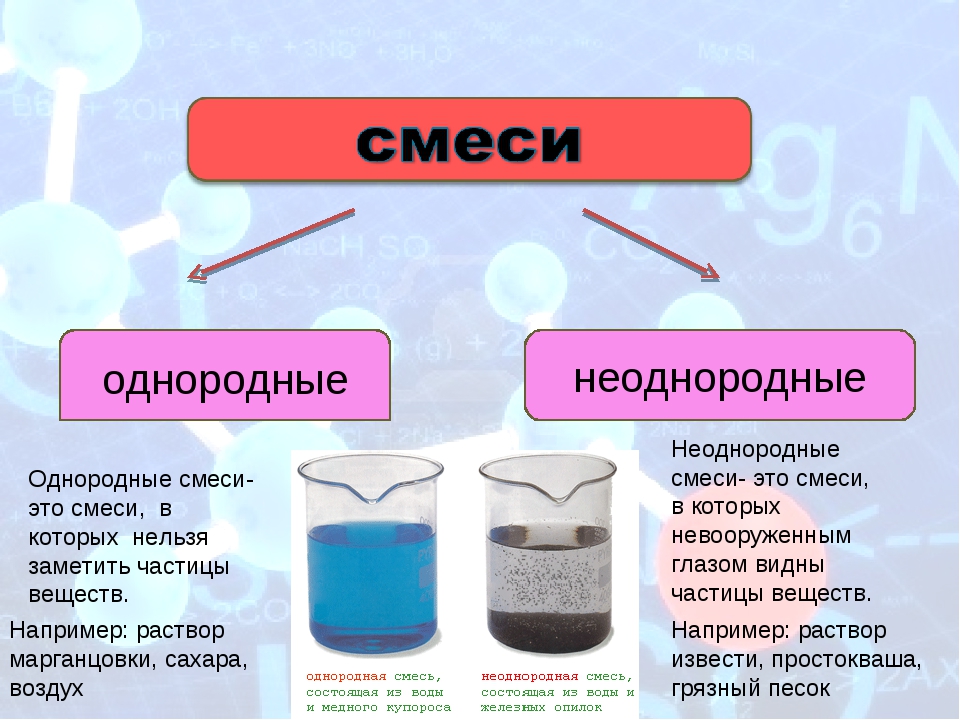
Раствор – это твердая, жидкая или газообразная однородная система, состоящая из двух или более компонентов.
Раствор – это жидкая лекарственная форма, полученная путем растворения одного или нескольких лекарственных веществ и предназначенная для внутреннего, наружного или парентерального применения.
1.1. Классификация растворов.
1.1.1. По составу:
а) Простые растворы
б) Сложные растворы
4.1.2. По способу применения:
а) Для внутреннего применения (микстуры, капли)
б) Для наружного применения (капли, примочки, полоскания)
4. 1.3. По физико-химической природе:
1.3. По физико-химической природе:
а) Гомогенные системы
— Истинные растворы
— Растворы высокомолекулярных соединений
б) Гетерогенные системы
— Коллоидные растворы
— Суспензии
— Эмульсии
1.1.4. В зависимости от применяемых растворителей:
а) Водные растворы
б) Спиртовые растворы
в) Масляные растворы
г) Глицериновые растворы
д) Растворы на синтетических растворителях
Преимущества растворов:
1) Высокая биодоступность
2) Широкий спектр назначения
3) Простота приготовления
4) Удобство применения
5) Возможность корригировать вкус, цвет, запах лекарственных веществ.
Недостатки растворов:
1) Неудобство транспортировки (некомпактность упаковки)
2) Возможность микробного загрязнения
3) Вероятность гидролиза лекарственных веществ
 2. Растворители
2. РастворителиРастворители для жидких лекарственных форм – это индивидуальные химические соединения или их смеси, способные растворять различные вещества и образовывать с ними однородные смеси – растворы, состоящие из одного или нескольких компонентов.
Классификация растворителей:
1) Неорганические (вода очищенная)
2) Органические
— Летучие
1. Этиловый спирт
2. Эфир медицинский
3. Хлороформ
— Нелетучие
1. Глицерин
2. Масла растительные
3. Масло вазелиновое
4. Диметилсульфоксид (димексид)
Требования к растворителям:
1. Достаточная растворяющая способность
2. Химическая и фармакологическая индифферентность
3. Безопасность в пожарном отношении
4. Рациональность с точки зрения биофармации
5. Должны быть экономически выгодны и доступны.
Должны быть экономически выгодны и доступны.
1.3. Истинные растворы.
Истинные растворы – это однородные системы, молекулярной или ионной степени дисперсности, то есть лекарственные вещества в ней диспергированы до ионно-молекулярного состояния.
В молекулярно-дисперсных системах размер частиц порядка 0,1 нм. К ним относят: растворы неэлектролитов (сахар, спирт). Растворенное вещество распадается на отдельные кинетические самостоятельные молекулы.
В ионно-дисперсных системах размер частиц порядка 0,1 нм. К ним относят растворы электролитов (натрия хлорид, магния сульфат). Растворенное вещество находится в виде отдельных гидратированных ионов и молекул в некоторых равновесных количествах. Истинные растворы являются однофазными системами, они гомогенны даже при рассматривании в электронный микроскоп и их компоненты не могут быть разделены фильтрованием или каким-либо другим способом.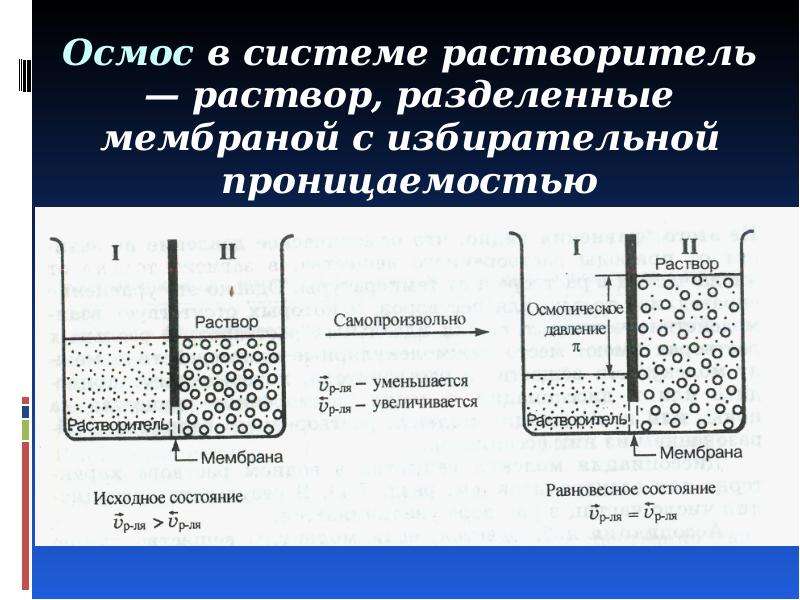
Лекарственные вещества обладают разной способностью к растворению в воде и других растворителях. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость увеличивается с повышением температуры. Некоторые лекарственные вещества растворяются медленно, с целью ускорения растворения прибегают к нагреванию, предварительному измельчению лекарственного вещества и перемешиванию смеси.
1.4. Концентрация.
Концентрация – это количество вещества, растворенного в определенном количестве растворителя.
В зависимости от метода изготовления раствора содержание лекарственных веществ в жидких лекарственных формах выражают различными способами в соответствии с приказом МЗ РФ № 308 от 21.10.1997.
1) Массо-объемная концентрация – это количество лекарственного вещества (в граммах) в общем объеме лекарственной формы (в мл),
2) Концентрация по массе – это количество лекарственного вещества (в граммах) в общей массе лекарственной формы (в граммах),
3) Объемная концентрация – это количество жидкого лекарственного вещества (в мл) в общем объеме лекарственной формы (в мл).
Способы обозначения концентрации.
В прописях рецептов концентрация может быть обозначена:
1) В процентах (%).
2) Раздельным перечислением лекарственного вещества и дисперсионной среды (растворителя).
3) С указанием растворителя до заданного объема или массы (ad).
4) С указанием соотношения массы или объема растворяемого лекарственного вещества и объема или массы раствора.
1.5. Растворимость.
Растворимостью называют свойство вещества растворяться в воде или других растворителях. В фармацевтической практике растворимость обозначается в виде отношения количества растворенного вещества к количеству насыщенного раствора, которое нужно из него приготовить. В фармацевтической практике используются таблицы растворимости в виде отношения одной массовой части вещества к необходимому количеству растворителя. Сведения о растворимости лекарственных веществ находятся в частных статьях ГФ.
Сведения о растворимости лекарственных веществ находятся в частных статьях ГФ.
Насыщенный раствор – это раствор, в котором скорость растворения лекарственного вещества и скорость оседания частиц равны.
Факторы, влияющие на растворимость:
1. Природа лекарственного вещества и растворителя
2. Сила связи между молекулами или ионами растворяемого вещества
3. Сила диффузии
4. Сила взаимодействия между веществом и растворителем
5. Температура
6. Степень дисперсности.
Чтобы читать дальше, купите книгу.
Стоимость:
Стерофундин изотонический
Стерофундин изотонический является лекарственным препаратом, отпускаемым по рецепту. Информация на данной странице предназначена исключительно для специалистов здравоохранения — для медицинских и фармацевтических работников. Полная информация по применению препарата Стерофундин изотонический содержится в инструкции по медицинскому применению.
1000 мл раствора содержит:
Концентрация электролитов:
Физико-химические характеристики: теоретическая осмолярность 309 мОсм/л, рН от 5,1 до 5,9
Описание: прозрачный бесцветный раствор без видимых механических включений
Фармакотерапевтическая группа: регидратирующее средство
Код АТХ: B05BB01
Стерофундин изотонический является изотоническим раствором электролитов с концентрацией электролитов, адаптированной к концентрации электролитов плазмы крови. Он применяется для коррекции потери внеклеточной жидкости (т. е. потери воды и электролитов в соразмерных количествах). Введение раствора направлено на восстановление и поддержание осмотического статуса во внеклеточном и внутриклеточном пространстве.
Анионный состав представлен сбалансированной комбинацией хлоридов, ацетатов и малатов, приближенной по молярной концентрации к анионному составу плазмы крови, что способствует коррекции метаболического ацидоза.
Замещение потерь внеклеточной жидкости при изотонической дегидратации у пациентов с ацидозом или угрозой его развития.
Стерофундин изотонический вводится капельно в периферические и центральные вены. Доза зависит от возраста, массы тела, клинического и биологического состояния пациента и сопутствующей терапии.
Рекомендуемые дозы
- Пожилым, взрослым и детям с 11 лет от 500 мл до 3 л/сутки, что соответствует 1–6 ммоль натрия/кг массы тела/сутки и 0,03–0,17 ммоль калия/кг массы тела/сутки;
- Детям до 11 лет от 20 мл до 100 мл/кг массы тела/сутки, что соответствует 3–14 ммоль натрия/кг массы тела/сутки и 0,08–0,40 калия/кг массы тела/сутки.
Скорость введения
Максимальная скорость введения определяется потребностями больного в жидкости и электролитах, массой тела, клиническим состоянием и биологическим статусом больного. Для детей скорость введения в среднем составляет 5 мл/кг массы тела/ч, однако она зависит от возраста:
- для детей до 1 года 6–8 мл/кг массы тела/ч;
- для детей с 1 года до 2 лет 4–6 мл/кг массы тела/ч;
- для детей с 2 до 11 лет 2–4 мл/кг массы тела/ч.

Продолжительность применения
Стерофундин изотонический может вводиться настолько долго, насколько это требуется для восстановления водно-электролитного баланса.
Чем заменить раствор для линз и можно ли класть линзы в воду
Возить с собой везде средства по уходу за линзами — крепкая привычка всех пользователей. Но что делать, если контейнер забыт, раствор внезапно закончился, а необходимо снять и где-то хранить контактные линзы? Из этой неприятной ситуации есть несколько выходов.
Чтобы понять, чем можно заменить раствор для линз, давайте разберемся, из чего он состоит и какие функции выполняет:
- основа – солевой раствор, состав и PH которого практически совпадают с естественной для глаза средой;
- дезинфицирующие ингредиенты;
- моющая составляющая – поверхностно-активные вещества, которые устраняют белковые и липидные отложения;
-
увлажняющие компоненты.

Такой состав предотвращает деформацию, препятствует испарению влаги, размножению бактерий, смывает отложения, которые непременно образуются, поскольку в слезе содержатся липиды и белки. В результате хранения в таком растворе линза надолго сохраняет первоначальные свойства, а главное не наносит вреда глазу и не становится причиной развития инфекции или травмы.
Чем можно заменить раствор для линз
Если вы оказались в ситуации, когда поблизости нет аптеки и нет возможности приобрести специальный раствор, то в качестве вариантов можно попробовать использовать:
- физраствор;
- увлажняющие глазные капли;
- дистиллированную воду с добавлением небольшого количества соли.
Физраствор максимально близок по составу как к естественным жидкостям организма, так и к многофункциональному раствору, поэтому при его наличии такой вариант будет самым предпочтительным. Однако после хранения в физрастворе необходимо при первой же возможности снова поместить линзы в мультифункциональный раствор.
Глазные капли, предназначенные для увлажнения слизистой, вполне подойдут для замены на непродолжительное время. Они предотвратят высыхание и порчу изделия, однако не обеспечивают очистку и дезинфекцию. Поэтому, как и в случае с физраствором, при первой же возможности линзы необходимо поместить с контейнер со специальным средством.
Некоторые пользователи линз рассказывают в интернет-сообществах об экстренных ситуациях, когда их спасал слабый раствор нейодированной соли с дистиллированной воде. Однако приготовление такой жидкости требует точного соблюдения пропорций.
Самое главное, о чем должны помнить все пользователи контактных линз, что все перечисленные средства – это экстренные меры и они не подходят для регулярного использования. Если периодически пользоваться такими способами очистки, то можно испортит линзы и инфицировать слизистую глаза.
Можно ли линзы положить в обычную воду
Вода – кипяченая или нет – ни в коем случае не может использоваться для хранения контактных линз. Это запрещенный вариант как минимум по двум причинам:
Это запрещенный вариант как минимум по двум причинам:
- жесткий состав – взвеси, соли, хлор и другие добавки вредят мягкому полимеру, приводят к деформации, не способствуют сохранению ее увлажненности;
- бактериальная среда – несмотря на обработку водопроводной, бутилированной и другой воды (и даже кипячение) она может стать источником бактериального заражения.
Можно ли хранить линзы в воде с солью или перекисью
Ответ врачей на данный вопрос однозначен – нет. Во-первых, как мы уже писали выше, кипяченная вода не является абсолютно безопасной. Во-вторых, водопроводная вода содержит различные добавки, которые могут навредить и глазам, и линзам. Что касается перекиси водорода, то некоторые растворы для очистки линз действительно содержат перекись в качестве активного компонента для очистки. Но эти так называемые пероксидные системы всегда подразумевают нейтрализацию перекиси для того, чтобы носитель не получил ожог слизистой.
Что категорически нельзя делать, если под рукой нет раствора
Помимо вопроса, можно ли класть линзы в воду, часто возникают идеи о слюне, Хлоргексидине и других подобных средствах. Но они не подходят в данном случае. Слюна, несмотря на естественный физиологический состав, в большом количестве содержит бактерии, дезинфицирующие препараты опасны для глаза и для материала мягких контактных линз.
Оставлять линзы на открытом воздухе тоже категорически нельзя. Высыхая, изделие деформируется и становится непригодно для дальнейшего использования. Реанимировать его будет невозможно. Учитывая стоимость оптики и срок ее эксплуатации, лучше купить новые, чем рисковать здоровьем.
Меры предосторожности
После хранения мягких контактных линз в подручных средствах даже непродолжительное время обязательно выполните следующие шаги:
- промойте специально предназначенным для этого мультифункциональным раствором;
- положите линзы в чистый контейнер со свежей жидкостью на несколько часов, по возможности – на полдня;
- перед использованием осмотрите изделие, и, если обнаружите на нем дефекты, откажитесь от его применения;
-
если при надевании линз вы чувствуете дискомфорт, они ощущаются в глазу и не надеваются так, как раньше – высока вероятность, что линзы деформировались.

Как узнать, что линзы испортились
Внимательно осмотрите их, обратите внимание на форму и цвет. Если произошли изменения, появилась сеточка трещин, искажение линии края и другие перемены, линзы не смогут полноценно выполнять свои функции – корректировать ваше зрение. Поэтому даже при малейших сомнения лучше приобрести новые линзы.
Общие правила использования контактной оптики
Только подбор контактных линз у офтальмолога может гарантировать их безопасное использование. Приобретая линзы плановой замены в салонах оптики или в специализированном интернет-магазине, обязательно купите и раствор для очистки и хранения. Даже однодневные линзы иногда могут потребовать промывания раствором, например, если вы уронили их или решили в течение дня снять. Обычно в комплекте с растворами продаются и контейнеры для линз. Но если вы пользуетесь однодневными линзами, то маленькой бутылочку раствора 30 или 50 мл вам будет достаточно, а в комплекте с такими флаконами контейнер не продается.
Если вы часто путешествуете, задерживаетесь на работе или вам приходится ночевать не дома, приобретите специальный набор, в который входят:
- контейнер для линз
- маленький флакончик для раствора
- специальный пинцет для манипуляций с линзами.
Такой комплект размером примерно с небольшую пудреницу. Его удобно носить с собой в сумке или в кармане.
Еще один лайфхак от опытных пользователей контактных линз. Приобретите несколько контейнеров и флаконов с раствором и положите их в местах, где вы наиболее часто бываете. Пусть один комплект останется на работе, один на даче, и, конечно, один в сумке или кармане повседневной одежды.
Если все же возникла неприятность и средство забыто, хранить линзу негде и подручных средств не раздобыть – не забывайте, что здоровье ваших глаз ценнее любой оптики!
Раствор Рингера: инструкция, цена, аналоги | раствор для инфузий Юрия-Фарм
плазмозамещающий солевой р-р. Содержит сбалансированную смесь катионов и является более физиологическим по сравнению с 0,9% р-ром натрия хлорида. Р-р Рингера восстанавливает водно-солевой баланс и КОР, устраняет гиповолемию, вызванную дегидратацией или аккумуляцией внеклеточной жидкости в очагах обширных ожогов и травм, при полостных операциях и перитоните. Препарат повышает щелочной резерв крови. Наряду с этим р-р Рингера улучшает реологические свойства крови и перфузию тканей, повышает эффективность гемотрансфузий при массивных кровопотерях и шоке. Обладает дезинтоксикационным эффектом вследствие снижения концентрации токсических продуктов в крови и усиления диуреза.
Содержит сбалансированную смесь катионов и является более физиологическим по сравнению с 0,9% р-ром натрия хлорида. Р-р Рингера восстанавливает водно-солевой баланс и КОР, устраняет гиповолемию, вызванную дегидратацией или аккумуляцией внеклеточной жидкости в очагах обширных ожогов и травм, при полостных операциях и перитоните. Препарат повышает щелочной резерв крови. Наряду с этим р-р Рингера улучшает реологические свойства крови и перфузию тканей, повышает эффективность гемотрансфузий при массивных кровопотерях и шоке. Обладает дезинтоксикационным эффектом вследствие снижения концентрации токсических продуктов в крови и усиления диуреза.
изо- и гипотоническая дегидратация и метаболический ацидоз вследствие профузной диареи и неукротимой рвоты, острая массивная кровопотеря, обширные ожоги, тяжелое течение послеоперационного периода, интоксикации различной этиологии; наружно при различных заболеваниях глаз, слизистых оболочек, промывания ран.
в/в капельно со скоростью 4–10 мл/кг в 1 ч в объеме от 50 мл до 3 л. Можно назначать ректально по 75–100 мл. Наружно для промывания глаз, слизистых оболочек, ран.
Можно назначать ректально по 75–100 мл. Наружно для промывания глаз, слизистых оболочек, ран.
выраженная почечная недостаточность, декомпенсированные пороки сердца, тромбофлебит, гиперкоагуляция, риск развития отека легких и мозга, гипернатриемия, гиперхлоремия, гипергидратация, метаболический алкалоз.
введение р-ра в больших объемах может приводить к развитию хлоридного ацидоза, гипергидратации.
с целью повышения эффективности дезинтоксикационной и регидратационной терапии р-р Рингера можно назначать одновременно с гемотрансфузиями, переливанием плазмы и плазмозаменителей. При длительной инфузионной терапии, особенно с введением р-ра в больших объемах, контролируют содержание электролитов в плазме крови и моче, диурез.
в защищенном от света месте при комнатной температуре.
Вскоре после первого в/в применения изотонического раствора натрия хлорида в 1881 г. стало понятно, что он не содержит необходимого набора электролитов для поддержания гомеостаза. И уже в 1882 г. австралийский врач и исследователь Сидней Рингер (Sydney Ringer) предложил новый электролитный раствор (Шлапак І.П. та співавт., 2013), впоследствии ставший родоначальником класса сбалансированных кристаллоидных растворов (Santi M. et al., 2015).
И уже в 1882 г. австралийский врач и исследователь Сидней Рингер (Sydney Ringer) предложил новый электролитный раствор (Шлапак І.П. та співавт., 2013), впоследствии ставший родоначальником класса сбалансированных кристаллоидных растворов (Santi M. et al., 2015).
В поисках идеального состава Рингер проводил эксперименты с различными растворами электролитов. В опытах на изолированном сердце животных он пытался создать раствор, позволяющий поддерживать жизнедеятельность сердца в такой экспериментальной модели. Рингер изучал in vitro влияние состава кристаллоидной жидкости на сократимость сердца (Reddy S. et al., 2016).
Созданный Рингером раствор позволил корректировать нарушения баланса электролитов, включая гипокалиемию и гипокальциемию. Кроме того, этот состав стал базой для создания в дальнейшем других инфузионных препаратов (Раствор Рингера — Локка, раствор Рингера-лактата). Раствор Рингера в 1 л содержит следующие катионы: 4 ммоль К+, 147 ммоль Na+, 4,5 ммоль Са++ и 160 ммоль анионов Cl—. Его осмолярность — 309 ммоль/л. Для сравнения осмолярность плазмы крови — 320 ммоль/л. В 1 л плазмы крови содержится 142 ммоль Na+, 4 ммоль К+, 2,5 ммоль Са++ и 103 ммоль Cl—. При этом в изотоническом растворе NaCl содержится 154 ммоль/л ионов Na+ (Шлапак І.П. та співавт., 2013). То есть концентрация натрия в нем супрафизиологическая ― выше концентрации ионов натрия в плазме крови.
Его осмолярность — 309 ммоль/л. Для сравнения осмолярность плазмы крови — 320 ммоль/л. В 1 л плазмы крови содержится 142 ммоль Na+, 4 ммоль К+, 2,5 ммоль Са++ и 103 ммоль Cl—. При этом в изотоническом растворе NaCl содержится 154 ммоль/л ионов Na+ (Шлапак І.П. та співавт., 2013). То есть концентрация натрия в нем супрафизиологическая ― выше концентрации ионов натрия в плазме крови.
По функциональной классификации инфузионных препаратов Раствор Рингера относится к препаратам для восстановления ОЦК (противошоковым), препаратам для коррекции водно-электролитного баланса, растворителям для введения других лекарственных средств и дезинтоксикационным растворам.
Другой распространенной классификацией является химическая. Ее основы были заложены еще Томасом Грэхемом более 150 лет назад. Все вещества он делил в зависимости от их способности проникать через эндотелий. Это дало возможность поделить все препараты для в/в введения на 2 большие группы ― растворы, которые свободно проникают через эндотелий — кристаллоиды, включая раствор Рингера, и коллоиды, которые не могут свободно проникать через эндотелий. По современной классификации растворов кристаллоидов раствор Рингера относится к солевым растворам, не содержащим органических анионов (Шлапак І.П. Та співавт., 2013), и к сбалансированным кристаллоидным растворам (Santi M. et al., 2015).
По современной классификации растворов кристаллоидов раствор Рингера относится к солевым растворам, не содержащим органических анионов (Шлапак І.П. Та співавт., 2013), и к сбалансированным кристаллоидным растворам (Santi M. et al., 2015).
Интересно, что группа кристаллоидов получила свое название благодаря тому, что действующие вещества этих растворов в сухом виде имеют кристаллическую структуру.
Некоторые особенности водно-электролитного баланса
Объем жидкости в организме человека превышает объем всех других химических веществ. При этом доля жидкости в организме человека подвергается значительным колебаниям (Шлапак І.П. та співавт., 2013).
Считается, что у здорового мужчины с массой тела 70 кг в организме содержится 45 л жидкости (60% массы тела) (Smorenberg A. et al., 2013).
При этом у лиц с избыточной массой тела и ожирением доля жидкости в организме меньше, чем у худых и спортивного телосложения субъектов. А у женщин меньше, чем у мужчин, поскольку обычно у женщин большая доля жировой ткани в организме (жировая ткань содержит мало жидкости).
Жидкость в организме человека находится внутриклеточно, в межклеточном пространстве, внутрисосудистом пространстве и полостях организма. При этом до ⅔ жидкости содержится внутриклеточно, что составляет около 40% массы тела здорового человека.
Межклеточной жидкости в норме обычно составляют 15–17%. В случае кровопотери эта жидкость мобилизируется в сосудистое русло. Однако до 40% этой жидкости функционально неактивны, так как связана с глюкозаминогликанами соединительной ткани, хрящей и костей.
Плазма крови является особой жидкой средой. Кровь ― это жидкая и подвижная соединительная ткань, представленная форменными элементами крови и плазмой как межклеточной жидкостью. Объем плазмы крови составляет около 7% массы тела здорового человека (Шлапак І.П. та співавт., 2013).
Минимальная же суточная потребность в жидкости взрослого человека составляет 1500 мл. При этом следует отметить, что как минимум 900 мл воды составляют незаметные потери жидкости ― с перспирацией (выделение жидкости через кожу с последующим ее испарением) и дыханием.
При повышении температуры тела возрастает и его потребность в жидкости: 10 мл/кг массы тела на каждый увеличенный 1 °C, начиная с температуры тела 37 °C.
Также для правильного расчета объема инфузии необходимо учитывать у пациента наличие и объем рвоты, диареи, повышенного потоотделения повышения частоты и глубины дыхания, а также информацию о сопутствующих заболеваниях, выпоте в полости тела (асцит, плеврит), отеках периферических тканей (голеней, периорбитальной зоны, отек диска зрительного нерва), злоупотреблении алкоголем, приеме препаратов, прежде всего диуретиков.
Клиническими симптомами гиповолемии являются адинамия, слабость, выраженная жажда, сухость и снижение тургора кожи, сухость видимых слизистых оболочек, снижение тонуса глазных яблок, нарушение сознания, снижение АД.
От тщательной оценки этих параметров может зависеть правильность оценки водного статуса пациента и адекватность расчета объема инфузионной терапии.
Также не менее важной является оценка лабораторных показателей (концентрации гемоглобина, гематокрита, общего белка плазмы крови, электролитный состав плазмы, мочевина, креатинин, относительная плотность мочи).
При введении растворов кристаллоидов рекомендуется не превышать дозу 7 мл/кг массы тела/час. В результате исследований было установлено, что введение растворов кристаллоидов в объемах, не превышающих 7 мл/кг массы тела в час позволяет минимизировать количество осложнений и обеспечивает более высокую выживаемость больных после обширных оперативных вмешательств (операции на брюшной полости, например поджелудочной железе, холецистектомия, колоректальная и сосудистая хирургия, ортопедические оперативные вмешательства), чем при применении больших объемов инфузии.
В одном из обзоров литературы было продемонстрировано, что применение физиологического раствора приводило к более значительному количеству летальных исходов, чем при применении сбалансированных растворов кристаллоидов во время и после операции (5,6% против 2,9%). Кроме того, при введении сбалансированных растворов было отмечено меньшее количество случаев серьезных инфекционных осложнений, потребности в переливании крови, проведении гемодиализа и меньшее количество дней на аппарате ИВЛ, чем у пациентов, которым проводились инфузии изотоническим раствором натрия хлорида. Поэтому пришли к выводам, что следует применять сбалансированные растворы, учитывая риск метаболических нарушений, таких как гиперхлоремический метаболический ацидоз (Smorenberg A. et al., 2013).
Поэтому пришли к выводам, что следует применять сбалансированные растворы, учитывая риск метаболических нарушений, таких как гиперхлоремический метаболический ацидоз (Smorenberg A. et al., 2013).
Инфузионная терапия применяется для пациентов с гиповолемией с синдромом системного воспалительного ответа (ССВО). Этот синдром отмечают у около 20% пациентов отделений неотложной помощи и реанимации. В нескольких исследованиях были выявлены неблагоприятные клинические исходы у пациентов с острыми заболеваниями (например инфекционными, пневмонией) или у пациентов, перенесших оперативные вмешательства, получавших изотонический раствор, по сравнению со сбалансированными растворами кристаллоидов. В результате одного из ретроспективных анализов базы данных электронных медицинских карт США (n=3116) выявили значительное снижение вероятности развития серьезных неблагоприятных осложнений, таких как сепсис, пневмония, дыхательная недостаточность, сердечная недостаточность и летальный исход, у пациентов с ССВО при применении сбалансированных растворов кристаллоидов по сравнению с применением изотонического раствора натрия хлорида. Более широкое применение сбалансированных кристаллоидов для в/в терапии может частично ограничиваться их более высокой ценой по сравнению с ценой 0,9% раствора NaCl. Например, в США цена сбалансированных растворов кристаллоидов в среднем на 70% выше, чем изотонического раствора натрия хлорида. Однако лучшая клиническая эффективность сбалансированных кристаллоидов делает их применение целесообразным (Laplante et al., 2017).
Более широкое применение сбалансированных кристаллоидов для в/в терапии может частично ограничиваться их более высокой ценой по сравнению с ценой 0,9% раствора NaCl. Например, в США цена сбалансированных растворов кристаллоидов в среднем на 70% выше, чем изотонического раствора натрия хлорида. Однако лучшая клиническая эффективность сбалансированных кристаллоидов делает их применение целесообразным (Laplante et al., 2017).
Местное применение
Раствора РингераЦель наложения повязок в терапии ран: защита раны от внешних неблагоприятных факторов, обеспечение быстрого ее заживления. Но еще, что очень важно, — необходимо уменьшить выраженность боли. Боль является серьезной проблемой для пациентов с ранами травматического характера, пролежнями, ожогами. Длительно существующий болевой синдром приводит с снижению физической активности пациента, потере аппетита, изменению настроения и развитию депрессии. Кроме того, в ходе нескольких исследований было установлено, что уменьшение выраженности боли в ране способствует ее лучшему заживлению. При этом боль может быть как постоянной, обусловленной наличием самой раны, так и сопряженной с медицинскими вмешательствами (смена повязки, удаление тканевого детрита, волос вокруг раны, обработка раны лекарственными средствами).
При этом боль может быть как постоянной, обусловленной наличием самой раны, так и сопряженной с медицинскими вмешательствами (смена повязки, удаление тканевого детрита, волос вокруг раны, обработка раны лекарственными средствами).
Задача повязки, пропитанной раствором Рингера, ― обеспечить уменьшение выраженности боли. Это, вероятно, достигается благодаря созданию влажной среды, благоприятной для заживления ран и обеспечивающей защитную барьерную функцию. Раствор Рингера при этом покрывает травмированные ткани (в том числе нервные окончания) и защищает их от повреждения трением.
Кроме того, за счет так называемого эффекта разбавления раствор Рингера изменяет рН экссудата, снижая его кислотность, и таким образом может инактивировать ферменты (например металлопротеазы) и гликопротеины (включая натриевые и кальциевые каналы), участвующие в болевом ответе. За счет разбавления экссудата в ране в нем снижается концентрация простагландинов, кининов и цитокинов, что способствует уменьшению выраженности воспаления в хронических ранах (например пролежнях, трофических язвах).
Был проведен обзор исследований, оценивающих целесообразность применения повязок, пропитанных раствором Рингера. В многоцентровом обсервационном исследовании у 403 пациентов с хроническими вялотекущими раневыми процессами применяли повязки, пропитанные раствором Рингера. Было зафиксировано значительное уменьшение выраженности болевого синдрома у участников исследования, как постоянного, так и во время замены повязки. При этом 89% пациентов оценивали эффект от применения повязки как «хороший» или «очень хороший». Другое многоцентровое обсервационное исследование включало 170 пациентов с хроническими вялотекущими раневыми процессами. За 8 дней применения повязок с раствором Рингера количество пациентов, оценивавших боль в ране в течение дня как «умеренную» и «выраженную», снизилось с 35 до 19%. Количество же пациентов, оценивавших боль при смене повязок как умеренную и «выраженную», уменьшилось с 28% в начале курса лечения до 11%.
Еще одно обсервационное исследование включало 221 пациента с различными хроническими раневыми процессами (пролежни, трофические язвы вследствие хронической венозной недостаточности). Через 1 мес применения повязок с раствором Рингера доля пациентов, указывающих на «средней выраженности» и «выраженную» боль в ране снизилась с 64 до 19% (Colegrave M. et al., 2016).
Через 1 мес применения повязок с раствором Рингера доля пациентов, указывающих на «средней выраженности» и «выраженную» боль в ране снизилась с 64 до 19% (Colegrave M. et al., 2016).
Инфузионная терапия направлена прежде всего на поддержание ОЦК и нормального состава электролитов в жидкостях организма.
Тяжелая гиповолемия проявляется не только снижением ОЦК, но и содержания жидкости в интерстициальном и в конечном итоге даже внутриклеточном пространстве. Восполнение же дефицита жидкости может быть достигнуто путем в/в инфузий. Гиповолемия приводит к снижению перфузии, гипоксии тканей и в дальнейшем к развитию гиповолемического шока. При этом потери электролитов всегда сопровождают потерей жидкости (например вследствие кровопотери или рвоты). И восполнение ОЦК должно происходить сочетанно с коррекцией электролитного баланса. Раствор Рингера является представителем сбалансированных растворов кристаллоидов. Несмотря на более чем столетнюю историю, его применение и сегодня является актуальным. Этот нормотонический раствор для в/в инфузий может применяться с целью восполнения дефицита жидкости при дегидратации вследствие рвоты и диареи, лихорадки, ожогов, шока, хирургической патологии органов брюшной полости и в периоперационный период. Также раствор Рингера может применяться с целью разведения концентрированных растворов электролитов.
Этот нормотонический раствор для в/в инфузий может применяться с целью восполнения дефицита жидкости при дегидратации вследствие рвоты и диареи, лихорадки, ожогов, шока, хирургической патологии органов брюшной полости и в периоперационный период. Также раствор Рингера может применяться с целью разведения концентрированных растворов электролитов.
Какой раствор для контактных линз лучше выбрать?
Зачем нужен раствор для контактных линз?
Во-первых, основное его назначение — поддержание линз в увлажнённом состоянии, ведь удобство их ношения зависит именно от того, насколько они эластичны.
Во-вторых, функция дезинфекции. В течение дня на поверхности скапливаются частицы пыли и других загрязнений, что ухудшает её свойства. Применение раствора для очистки контактных линз позволяет легко удалить посторонние объекты, независимо от их размера. Жидкость удобна тем, что её можно носить с собой, поэтому даже случайно выпавшую линзу можно быстро промыть и снова надеть.
Какие виды растворов для контактных линз существуют:
- Солевой
Самым первым раствор для контактных линз был на солевой основе. В настоящее время этот вид растворов почти не применим, поскольку солевой раствор способен лишь удерживать влагу в линзе, но не очищает и не дезинфицирует линзу должным образом.
- Пероксидный
Раствор такого вида является действеннейшим дезинфицирующим средством. Благодаря, имеющейся в растворе перекиси водорода с поверхности линзы удаляются все виды возможных загрязнений лучше. НО! Средство с такой характеристикой не подходит для длительного хранения линз (более 3-х дней) им нельзя промывать линзу или закапывать его в глаз, т.к. возможно травмирование слизистой перекисью водорода.
- Многофункциональный
Этот вид самый универсальный. Приближен к составу водно-солевому.
 Полностью выполняет все функции, необходимые современным линзам: увлажнение, хранение, очистка и дезинфекция.
Полностью выполняет все функции, необходимые современным линзам: увлажнение, хранение, очистка и дезинфекция.
Обзор самых популярных растворов Оптики Кронос:
1. Растворы для контактных линз ReNu.
Многие пользователи отметили, что раствор, разработанный американским брендом Bausch + Lomb, является лучшим для контактных линз. Характеристики ReNu MultiPlus весьма просты:
- Очистка оптических изделий, изготовленных на основе мягких веществ;
- Удаляет загрязнения, которые могут накапливаться на верхнем слое изделий во время эксплуатации;
Данный раствор может использоваться для ухода как за гидрогелевыми, так и за силикон-гидрогелевыми моделями, и может применяться ежедневно.
2. Растворы для контактных линз Biotrue
Biotrue также разработанный специалистами компании Bausch + Lomb. Биосовместимые свойства делают этот продукт абсолютно безопасным для глаз. Основной компонент — гиалоурановая кислота. Раствор прекрасно подходит для хранения контактных линз, а также способствует предотвращению возникновения симптомов сухости и раздражения при ношении оптических изделий. Представленное средство полностью соответствует уровню естественной слезы, за счет чего обеспечивает комфорт сразу же после надевания средств коррекции.
Биосовместимые свойства делают этот продукт абсолютно безопасным для глаз. Основной компонент — гиалоурановая кислота. Раствор прекрасно подходит для хранения контактных линз, а также способствует предотвращению возникновения симптомов сухости и раздражения при ношении оптических изделий. Представленное средство полностью соответствует уровню естественной слезы, за счет чего обеспечивает комфорт сразу же после надевания средств коррекции.
3. Растворы для контактных линз Опти-Фри PureMoist от компании Alcon.
Что делает его особенными:
- Высокий уровень комфорта в течение всего дня, благодаря запатентованной увлажняющей технологии.
- Слой влаги, встраиваемый в материал линзы — делает ее гладкой, позволяя удерживать влагу до 16 часов.
- В составе раствора лежат два компонента, первый из которых уничтожает бактерии, а уничтожает грибки и простейшие.

Многофункциональный раствор Опти-Фри «PureMoist» обеспечивает комфортное ношение линзы, четкое зрение и ощущение свежести в течение всего дня.
4. Растворы для контактных линз Hy-Care от компании CooperVision.
В этом растворе применяется компонент дезинфицирующего и антисептического средства, который эффективно уничтожает бактерии с поверхности линз.
Особенности:
- Содержит гиалуроновую кислоту — природный увлажнитель, входящий в состав слезы человека
- Мощная дезинфекция и одновременно щадящая глаз формула
- Повторяет рН слезы
- Антибактериальный контейнер с ионами серебра
- Подходит для силикон-гидрогелевых линз
Вы всегда можете записаться на проверку зрения в Оптику Кронос на сайте или по телефону горячей линии. Растворы есть в наличии в любом салоне и в интернет-магазине.
Записаться на прием ко врачу
Выбрать растворы
Рекомендуемые статьи
Контактные линзы Acuvue от Johnson & JohnsonКонтактные линзы Acuvue от Johnson & Johnson — уже много лет неизменные лидеры продаж. Важным фактором успеха является большое внимание компании Johnson & Johnson к инновационным технологиям, позволяющим с каждым годом только улучшать характеристики комфорта и безопасности своей продукции.
Чем нас лечат: зеленка, йод и фукорцин
Намного лучше переносится повидон-йод — комплекс из трийодид-анионов и водорастворимого полимера. Всемирная администрация здравоохранения даже внесла и его, и раствор Люголя в список важнейших препаратов, самых доступных и эффективных.
Зеленый свет для всех показаний?
Ни одной статьи в разделе клинических испытаний в базе данных PubMed не посвящено зеленке. Однако некоторые эксперименты там все же можно найти. Так, в одной статье сравнивается эффективность «тройного красителя» (в число трех анилиновых красителей входит и зеленка) с изопропиловым спиртом и без него в обработке пуповины новорожденных. От изопропилового спирта действие не меняется, однако это мало говорит нам о том, насколько оно сильно само по себе. Другая работа 1948 года показывает, что двухпроцентная зеленка помогает за 26 дней заживить хронические язвы, которые не проходили несколько месяцев до этого. Авторы заключают, что препарат убивает большинство бактериальных патогенов и легко может применяться на дому. Побочных эффектов они не нашли и добавили, что очистить здоровую кожу от случайного окрашивания можно обычным спиртом.
Другое исследование показало, что зеленка может уничтожать золотистый стафилококк, стрептококк и грибок Candida albicans при pH кожи и крови (и ее активность не меняется), хотя она проигрывает красителю генцианвиолету. Но от грамотрицательных бактерий она помогает плохо. Судя по всему, механизм действия зеленки как-то связан с разрушением клеточной стенки, характерной для грамположительных микроорганизмов.
Но от грамотрицательных бактерий она помогает плохо. Судя по всему, механизм действия зеленки как-то связан с разрушением клеточной стенки, характерной для грамположительных микроорганизмов.
Если антисептики нужны для обеззараживания раны, куда уже проникли микроорганизмы, то асептики предотвращают попадание туда инфекции. Грань между этими двумя методами иногда тонка, так как некоторыми дезинфицирующим средствами можно обрабатывать и рану, и, к примеру, хирургические инструменты. В этом смысле, смазывая зеленкой, фукорцином или раствором иода края раны, мы скорее используем их как асептики (хотя трудно сказать, есть ли там уже микроорганизмы в этот момент). Заливать ими рану внутри обычно не рекомендуется: раздражающее действие этих растворов на незащищенные ткани замедляет заживление. Поэтому для самой раны часто используют менее болезненные и более щадящие варианты, как раствор перекиси водорода.
Опыт применения зеленки в полевом лазарете с 1917 по 1956 годы раскрыт в письме в British Medical Journal. Автор называет антисептик эффективным в сравнении с другими и не вызывающим сильного раздражения. Также он заметил, что зеленка сильнее окрашивает мертвые ткани, предположив, что такая особенность может быть подсказать хирургу, что нужно удалить. Однако он сообщил и об ограничениях: так, раненые не оставались в лазарете долго, и их повреждения могли быть обработаны чем-то другим до прибытия.
Автор называет антисептик эффективным в сравнении с другими и не вызывающим сильного раздражения. Также он заметил, что зеленка сильнее окрашивает мертвые ткани, предположив, что такая особенность может быть подсказать хирургу, что нужно удалить. Однако он сообщил и об ограничениях: так, раненые не оставались в лазарете долго, и их повреждения могли быть обработаны чем-то другим до прибытия.
Автор другого исследования зеленки, опубликованного в 1931 году, отмечает, что антисептики бывают двух типов: сильные, но при этом раздражающие живые ткани, как раствор иода, или более безопасные для пациента, но и на бактерии не оказывающие значительного эффекта. Дело в том, что часто свойства антисептиков, губительные для микроорганизмов, бывают вредны и для клеток человека. Бриллиантовый зеленый подавляет (в пробирке) размножение стрептококков и пневмококков, даже когда разведен в 200 000 раз, при этом автор называет его не токсичен и не раздражающим ткани раны так сильно, как раствор иода. В статье говорится о 123 случаях дезинфицировании зеленкой уже пораженных участков ткани (при язвах, карбункулах, флегмонах, абсцессах и так далее), а также об успешном применении в хирургических операциях. Насколько эффективно она защищает от заражения, автору выяснить не удалось.
В статье говорится о 123 случаях дезинфицировании зеленкой уже пораженных участков ткани (при язвах, карбункулах, флегмонах, абсцессах и так далее), а также об успешном применении в хирургических операциях. Насколько эффективно она защищает от заражения, автору выяснить не удалось.
Некоторые ученые пошли по другому пути и создали бактерицидные перчатки, инкомпорировав в материал хлоргексидина и бриллиантового зеленого. В экспериментах такие перчатки предотвращали загрязнение даже устойчивыми к антибиотикам патогенами. Есть данные и о противовирусной активности зеленки — например, против вируса Нипах, вызывающего энцефалит.
А вот ветряная оспа от зеленки не вылечивается. Но и цель нанесения антисептика не в этом: мокнущие язвочки он подсушит и от занесения новой инфекции защитит. Зато зеленка поможет покрасить новые пузырьки сыпи, чтобы следить за течением болезни. За рубежом такой подход не используется во многом из эстетических соображений.
Скрытые опасности красителей-антисептиков
Собрат зеленки в багровых тонах, фукорцин оказался эффективнее генциан-виолета (другого анилинового красителя-антисептика, который редко используется из-за подозрений в канцерогенности) против грибка Candida albicans. Поскольку фукорцин, в который входит фенол, тоже считается потенциально канцерогенным, некоторые ученые предлагают сочетать фуксин с хлоргексидином, более безопасным антисепиком. Такая смесь, по имеющимся данным, может подходить для лечения оториноларингологических инфекций.
Поскольку фукорцин, в который входит фенол, тоже считается потенциально канцерогенным, некоторые ученые предлагают сочетать фуксин с хлоргексидином, более безопасным антисепиком. Такая смесь, по имеющимся данным, может подходить для лечения оториноларингологических инфекций.
Согласно уже упомянутому обзору красителей-антисептиков, фуксин активен против грамположительных бактерий и используется для лечение гнойничковых поражений кожи, дерматитов, экземы и даже ожогов. Фукорцин же вдобавок активен против грибков и работает как вяжущее вещество. С 1967 года официально признана опасность препарата для работающих на производстве, которым предписано проходить дополнительные обследования каждые шесть месяцев.
В исследовании на 61 пациенте фукорцин помог вылечить вызывающе зуд воспаление наружного уха, не затронув нейтральные бактерии, которые не приносили вреда. И все же в подавляющем большинстве клинических испытаний фукорцин сейчас применяется для окрашивания образцов клеток или тканей, а не как исследуемый антисептик. Причина как раз в потенциальной токсичности, которая, возможно, связана с механизмом окислительного стресса (общим для многих подобных красителей-антисептиков).
Причина как раз в потенциальной токсичности, которая, возможно, связана с механизмом окислительного стресса (общим для многих подобных красителей-антисептиков).
Немало вопросов у ученых возникает и по поводу опасности зеленки. Бриллиантовый зеленый — один из самых токсичных красителей-антисептиков при внутрибрюшинном введении. Эксперименты на эту тему проводились еще на морских свинках в 1918 году. Есть основания подозревать, что зеленка обладает канцерогенными свойствами, так как в определенной концентрации она разрушает ДНК клеток. Доказана вероятность перехода частиц красителя из зеленых бумажных полотенец на руки и еду: риск канцерогенного воздействия примерно равен тому, которому подвергают нас незаконно использующие зеленку рыбные хозяйства.
Точно известно, что к хорошему не приведут ее контакты со слизистыми оболочками, а из-за попадания зеленки в глаза может произойти помутнение роговицы. Также описаны случаи аллергических реакций на зеленку.
Йод: самый изученный, но исследования низкого качества
Антисептики с йодом — самые изученные среди тех, что мы рассматриваем в нашей статье. Им посвятили ряд Кохрейновских обзоров.
Им посвятили ряд Кохрейновских обзоров.
Раствор для кладки печей и каминов: замешиваем своими руками
Чтобы построить камин или печь, чаще всего используют классический красный кирпич, его главные преимущества – долговечность, надежность, достаточная плотность, высокая теплоемкость и пожаробезопасность. При выполнении монтажных работ применяется специальный раствор для кладки печей, в основе которого – особые компоненты. От того, насколько добросовестно и в какой пропорции они будут смешаны, зависят устойчивость и крепость всей конструкции. Чаще всего при возведении печей используются растворы на основе глины, цемента или извести. Последние два материала – более предпочтительный выбор, если мастер приступил к возведению постамента для дымохода: цемент и известь отличаются большей прочностью и устойчивостью к появлению трещин. Чтобы будущая конструкция была стабильной, растворы для печей готовят в выверенных пропорциях, гарантирующих нужную пластичность и оптимальную густоту.
Важные моменты
Строительство печи проходит в несколько этапов, для каждого из которых характерен свой рецепт раствора. Сначала делают фундамент, работа над ним требует надежного бетонного раствора, в основе которого – цемент. После этого начинается кладка самой печи, как правило, для нее берут огнеупорный кирпич, и здесь не обойтись без кладочного раствора. Работа над дымоходом имеет свои особенности: в приоритете уже устойчивость не к высоким температурам, а к атмосферным изменениям, ведь его монтаж ведется не только в помещении. Финальный этап – покрытие печи штукатурным раствором, по составу также отличающегося от используемых ранее смесей.
Из всех перечисленных стадий наибольшее внимание стоит уделить приготовлению раствора для печной кладки. Он должен отвечать следующим условиям:
- Высокая жаростойкость, выраженная в способности противостоять влиянию открытого пламени и сохранять ровность поверхности даже под действием высоких температур.

- Хорошо сцеплять между собой даже жаростойкие кирпичи, обеспечивая минимальную толщину шва.
Чаще всего применяют печные смеси на основе глины, которые используются печниками уже в течение нескольких столетий. Для других этапов возведения печи характерно применение растворов на основе извести, а также смешанных – с добавлением к извести цемента либо цементно-песчаных.
Тем, кто хочет приготовить раствор для печной кладки своими руками, не обойтись без таких приспособлений, как:
- строительный миксер;
- поддон или другая похожая по форме емкость;
- мерное ведро;
- лопата;
- сито;
- шпатель;
- мастерок;
- термометр;
- весы;
- кельма.
Глиняные смеси по типу и консистенции
Для ее приготовления нужно взять глину, красную или белую, соединить с песком и затем добавить воду. Очень важно использовать для смеси только компоненты высокого качества: например, песок подойдет только калиброванный. Чтобы очистить его от мелкого гравия и различных растительных примесей, используют сито. То же самое проделывают и с глиной, добиваясь ее однородности. Как правило, используются следующие пропорции: по 1 части песка и глины либо 2 части песка и 1 – глины. Вода в растворе должна составлять примерно ¼ часть от количества глины.
Чтобы очистить его от мелкого гравия и различных растительных примесей, используют сито. То же самое проделывают и с глиной, добиваясь ее однородности. Как правило, используются следующие пропорции: по 1 части песка и глины либо 2 части песка и 1 – глины. Вода в растворе должна составлять примерно ¼ часть от количества глины.
Основной критерий готового раствора – уровень его жирности, от которого зависит эластичность и вяжущие свойства смеси, а значит, и надежность будущей конструкции. Стоит также уделить внимание чистоте используемой воды: лучше, если минералов в ней будет меньше. В противном случае сквозь штукатурку в дальнейшем могут проступить пятна, причиной которых станет достаточная минерализация жидкости.
Готовый раствор для печи должен быть в меру жирным: излишне мягкий приведет к тому, что готовая кладка может пойти трещинами, тощий раствор не обеспечит конструкции достаточную надежность. Идеальный раствор для кладки печи из кирпича – достаточно эластичный, гарантирующий сооружению стабильность после высыхания.
Песок: выбрать и подготовить
Основные компоненты самой простой смеси для кладки печи – глина и горный песок. Дело в том, что его частицы, в отличие от того, который добывают в морях и реках, отличаются большей шероховатостью, что улучшит адгезию раствора.
Перед тем как заняться приготовлением раствора, песок просеивают через достаточно мелкое сито (размер ячеек должен составлять примерно 1,5 x 1,5 мм). Если после этой процедуры в песке еще остались заметные примеси, его нужно промыть водой. Для этого используют раму, на которую натягивают мешковину. Струей воды небольшое количество песка, помещенное на приспособление, промывается до чистоты. Определить это легко по цвету стекаемой воды.
Оптимальная жирность глины
Чтобы проверить уровень жирности этого основного компонента кладочного раствора, есть элементарный способ.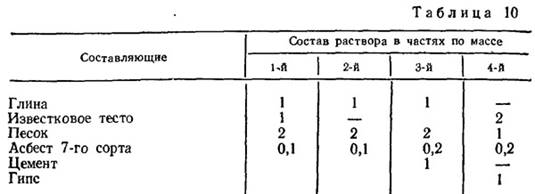 Нужно взять 0,5 л глины, смешивать с водой, чтобы по консистенции она стала похожа на крутое тесто. Затем полученную массу нужно тщательно размять и сформировать шарик диаметром 4–5 см. Когда он подсохнет, его нужно поместить между двумя дощечками и сжать их.
Нужно взять 0,5 л глины, смешивать с водой, чтобы по консистенции она стала похожа на крутое тесто. Затем полученную массу нужно тщательно размять и сформировать шарик диаметром 4–5 см. Когда он подсохнет, его нужно поместить между двумя дощечками и сжать их.
Если в результате шарик треснет, когда сожмут наполовину, его жирность велика, а, значит, смеси не хватает песка. Если почти сразу распадется – необходимо добавить глины. В том случае, если трещины пошли при сжатии шарика на треть, состав печной смеси подобран идеально.
Чтобы обеспечить надежность будущей печи, глиняный раствор для ее кладки должен быть приготовлен из тщательно очищенных компонентов и обладать нормальной или повышенной жирностью.
Очевидное достоинство раствора, ингредиенты которого тщательно подобраны и дозированы, состоит в том, что кладка будет иметь аккуратный внешний вид за счет тонкого шва. Кроме того, печная смесь нормальной жирности обеспечит конструкции достаточную надежность и долговечность. Правда, один недостаток у такого раствора все же есть: такой раствор не отличается устойчивостью к влажности окружающей среды.
Правда, один недостаток у такого раствора все же есть: такой раствор не отличается устойчивостью к влажности окружающей среды.
Глиняный раствор: технология замешивания
Начать нужно с того, что очищенную от примесей глину оставить в воде примерно на сутки. Затем к ней нужно понемногу еще добавлять жидкость, добиваясь однородности массы. По консистенции смесь для печей и каминов должна быть похожа на густую сметану. Процедив, в нее нужно добавить песок до тех пор, пока печная смесь не станет тягучей. Чтобы придать раствору прочность, не обойтись без цемента и соли. Расходное количество этих компонентов – 700–750 г и 200 г на ведро соответственно.
Раствор для печной кладки по всем правилам
Как уже отмечалось, его идеальная консистенция должна соответствовать густоте сметаны. Если для него берется жирная глина, то к 1 части нужно добавить 2 части песка, если нормальная – пропорция должна быть равной.
Перед тем как приступать к кладке печи, необходимо проверить качество полученной печной смеси. Для этого потребуется скрепить раствором 2 кирпича, выждать примерно 5 минут, а затем поднять верхний кирпич. Если конструкция не распадается за несколько подъемов, раствор для кладки печи из кирпича подобран идеально. Если этого не произошло и сцепление быстро распалось, скорее всего, для приготовления раствора была взята тощая (нежирная) глина.
Для этого потребуется скрепить раствором 2 кирпича, выждать примерно 5 минут, а затем поднять верхний кирпич. Если конструкция не распадается за несколько подъемов, раствор для кладки печи из кирпича подобран идеально. Если этого не произошло и сцепление быстро распалось, скорее всего, для приготовления раствора была взята тощая (нежирная) глина.
Опытные печники советуют также увеличить прочность раствора с помощью добавления
в него поваренной соли (на 10 кг глины достаточно 150 г). Сюда же можно добавить и цемент марки М400: 1 кг на тот же объем глины.
Когда начнется этап работы над дымоходом, глиняный раствор будет лучше заменить на известково-песчаный: он более устойчив к влаге. Для его приготовления нужно взять 3 части песка и 1 – известкового теста. Как вариант – 1 часть негашеной извести и 3 части воды.
Известковый раствор: виды
Как уже подчеркивалось ранее, глиняный раствор для дымохода (особенно – для той его части, которая находится над кровлей) крайне нежелателен. Его использование может привести к образованию трещин и последующему разрушению: глина плохо переносит конденсат.
Поэтому лучше не рисковать, а приготовить для возведения дымохода раствор на известковом тесте. Кстати, он подойдет и для строительства фундамента.
Для того чтобы приготовить такую смесь для печей и каминов, нужно взять 3 части песка и 1 – известкового теста. Чтобы получить последнее, нужно смешать 3 части воды и 1 – негашеной извести. Она напоминает размягченную жирную глину и по своему составу очень пластична. Если известковое тесто приготовлено правильно, его плотность составит 1400 кг/куб. м. Для возведения печных дымоходов, а также фундаментов, его можно приобрести уже готовым в любом строительном магазине.
м. Для возведения печных дымоходов, а также фундаментов, его можно приобрести уже готовым в любом строительном магазине.
Опасность собственноручного изготовления теста заключается в возможном риске получения ожогов кожи и верхних дыхательных путей. На заводах известь гасят в специально предназначенных для этого машинах. Если же купить известковое тесто нет возможности, при его приготовлении нужно соблюсти все меры безопасности: работать только в очках и маске, использовать перчатки, а также надеть пыленепроницаемую одежду.
Количество песка, которое нужно будет добавить, чтобы приготовить раствор, напрямую будет зависеть от того, насколько высока жирность известкового теста. Максимальный объем – 5 частей. До начала смешивания ингредиентов тесто рекомендуют пропустить через сито (размер ячеек – 1 на 1 см). Чтобы добиться нужной густоты, не обойтись без добавления жидкости.
Для того чтобы повысить надежность раствора, в него можно также добавить цемент. В этом случае пропорции будут такими: 1 часть цемента, 8-10 – песка, 2 – известкового теста. Полученный раствор, кроме уже указанного преимущества, будет также обладать повышенной устойчивостью к влажности среды.
Полученный раствор, кроме уже указанного преимущества, будет также обладать повышенной устойчивостью к влажности среды.
Готовят его в следующей очередности: сначала смешивают цемент и песок, затем в известковое тесто наливают воду, чтобы оно приобрело вязкость. После этого в него добавляют ранее приготовленную сухую смесь для кладки печей, а потом – снова воду, чтобы раствор был вязким.
Цемент как основа для раствора
Для строительства фундамента печи раствор нужно подобрать такой, чтобы обеспечить
конструкции надежность и устойчивость, и для этих целей лучше всего подойдет цемент. Такая смесь подойдет и для возведения той части дымохода, которая будет возвышаться над кровлей. Состав раствора – цемент, песок и вода. Чаще всего пропорции используют такие: 1 часть цемента марки М300 или М400 и 3 – песка. Компоненты нужно хорошо перемешать и разбавить водой до густоты сметаны. Получившаяся смесь для кладки печей должна быть подвижной, но не стекать со штыка лопаты, если она расположена под углом в 45 градусов.
Для фундамента и дна топочной камеры потребуется печная смесь с хорошей жаростойкостью. Вот ее состав: на 1 часть портланцемента М300 или М400 берут 0,3–0,5 частей шамотного песка и по 2 – мелко просеянного песка и щебня (подойдет и гравий).
Покупные сухие смеси
Тем, кто не хочет заниматься выбором качественных компонентов для смеси, можно использовать готовые жаростойкие растворы для печей и каминов. Хорошо зарекомендовала себя продукция отечественных производителей, гарантирующих оптимальное сочетание цены и качества: «ПЛИТОНИТ», «ТЕРРАКОТ», «Печной дом Макаровых», а также «ПечникЪ», «Сканэкс» и «СПО».
Чтобы приступить к работе, в готовую смесь для кладки печей нужно добавить только воду.
Заключение
Не стоит забывать, что правильно подобранный раствор для печи – это залог безопасности домашнего очага. Если отнестись к выбору ингредиентов или приготовлению раствора кое-как, нужная герметичность обеспечена не будет, из-за чего вполне возможна утечка угарного газа. Если собственное умение вызывает сомнения, не стоит рисковать – лучше доверить мастеру и приготовление раствора, и возведение печи.
Если собственное умение вызывает сомнения, не стоит рисковать – лучше доверить мастеру и приготовление раствора, и возведение печи.
Похожие статьи:
4.3: Состав растворов
Растворы представляют собой гомогенные смеси , содержащие одно или несколько растворенных веществ в растворителе . Растворитель, составляющий большую часть раствора, тогда как растворенное вещество — это вещество, растворенное внутри растворителя.
Единицы относительной концентрации
Концентрации часто выражаются в относительных единицах (например, в процентах) с обычно используемыми тремя различными типами процентных концентраций:
- Массовые проценты : Массовые проценты используются для выражения концентрации раствора, когда даны масса растворенного вещества и масса раствора: \[\text{Массовый процент}=\dfrac{\text{Масса растворенного вещества}}{\text{Масса раствора}} \times 100\% \label{1}\]
- Объемный процент : Объемный процент используется для выражения концентрации раствора, когда объем растворенного вещества и объем раствора заданы: \[\text{Объемный процент}= \dfrac{\text{Объем Раствор}}{\text{Объем раствора}} \times 100\% \label{2}\]
- Процент массы/объема: Другой вариант процентной концентрации — это процент массы/объема, который измеряет массу или вес растворенного вещества в граммах (например,г.
 , в граммах) по сравнению с объемом раствора (например, в мл). Примером может служить 0,9% (масса/объем) раствор \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса.Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
, в граммах) по сравнению с объемом раствора (например, в мл). Примером может служить 0,9% (масса/объем) раствор \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса.Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
\[\text{Масса/объем в процентах}= \dfrac{\text{Масса растворенного вещества (г)}}{\text{Объем раствора (мл)}} \times 100\% \label{3}\ ]
Рисунок использован с разрешения Википедии.
Пример \(\PageIndex{1}\): Алкоголь «пруф» как единица концентрации
Например, в Соединенных Штатах содержание алкоголя в спиртных напитках определяется как двойное процентное содержание алкоголя по объему (об./об.), называемое доказательством.Какова концентрация алкоголя в спиртных напитках Bacardi 151 , которые продаются с крепостью 151 (отсюда и название)?
Рисунок: практически пустая бутылка Bacardi 151. из Википедии.Раствор
Он будет иметь содержание спирта 75,5% (по весу) в соответствии с определением «пруф».
При расчете этих процентов единицы измерения растворенного вещества и раствора должны быть эквивалентными единицами (а весовые/объемные проценты (w/v %) определяются в граммах и миллилитрах).
| Вы НЕ МОЖЕТЕ подключить… | Вы НЕ МОЖЕТЕ подключить… |
|---|---|
| (2 г растворенного вещества) / (1 кг раствора) | (2 г растворенного вещества) / (1000 г раствора) |
| или (0,002 кг растворенного вещества) / (1 кг раствора) | |
| (5 мл растворенного вещества) / (1 л раствора) | (5 мл растворенного вещества) / (1000 мл раствора) |
или (0. 005 л раствор) / (1 л раствор) 005 л раствор) / (1 л раствор) | |
| (8 г растворенного вещества) / (1 л раствора) | (8 г растворенного вещества) / (1000 мл раствора) |
| или (0,008 кг растворенного вещества) / (1 л раствора) |
Единицы измерения разбавленных концентраций
Иногда, когда растворы слишком разбавлены, их процентная концентрация слишком мала. Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0.000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды.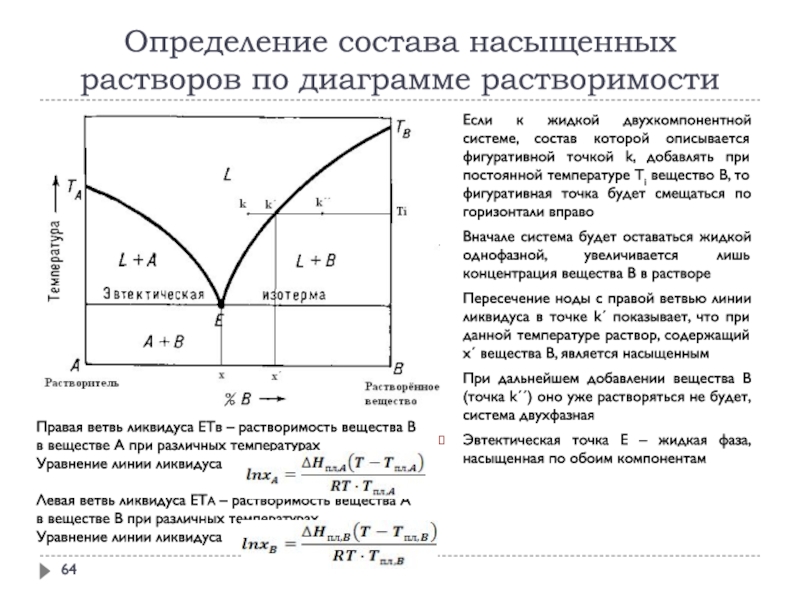 Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют частей на миллион , частей на миллиард или частей на триллион для описания разбавленных концентраций.
Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют частей на миллион , частей на миллиард или частей на триллион для описания разбавленных концентраций.
- Части на миллион : Концентрация раствора, содержащего 1 г растворенного вещества и 1000000 мл раствора (так же, как 1 мг растворенного вещества и 1 л раствора), создаст очень маленькую процентную концентрацию. Поскольку раствор, подобный этому, был бы очень разбавленным, плотность раствора хорошо аппроксимируется плотностью растворителя; для воды это 1 г/мл (но будет отличаться для разных растворителей). Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение).
 Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
- Части на миллиард : Частей на миллиард (ppb) почти как ppm, за исключением того, что 1 ppb в 1000 раз более разбавлен, чем 1 ppm. \[\text{1 ppb} = \dfrac{1\; \mu \text{g раствор}}{\text{1 л раствора}}\]
- Частей на триллион : Как и в случае с ppb, идея частей на триллион (ppt) аналогична концепции ppm.Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Пример \(\PageIndex{2}\): промилле в атмосфере
Вот таблица объемных процентов различных газов, содержащихся в воздухе. Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент массы отличается от состава по массе или состава по количеству молей.
Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент массы отличается от состава по массе или состава по количеству молей.
| Название элемента | Объемный процент (об./об.) | частей на миллион (об/об) |
|---|---|---|
| Азот | 78.084 | 780 840 |
| Кислород | 20,946 | 209 460 |
| Водяной пар | 4,0% | 40 000 |
| Аргон | 0. 934 934 | 9 340 |
| Углекислый газ | 0,0379 | 379* (но быстро растет) |
| Неон | 0,008 | 8,0 |
| Гелий | 0,000524 | 5,24 |
| Метан | 0,00017 | 1,7 |
| Криптон | 0. 000114 000114 | 1,14 |
| Озон | 0,000001 | 0,1 |
| Монооксид азота | 0,00003 | 0,305 |
Единицы концентрации на основе молей
- Мольная доля : Мольная доля вещества – это доля всех его молекул (или атомов) от общего числа молекул (или атомов).Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1.
 \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]
\[\chi_A + \chi_B + \chi_C \;+\; … \;=1\] - Мольные проценты : Мольные проценты (вещества A) выражены \(\chi_A\) в виде процентов. \[\text{Молярный процент (вещества A)}= \chi_A \times 100\%\]
- Молярность : Молярность (M) раствора используется для представления количества молей растворенного вещества на литр раствора.\[M= \dfrac{\text{Моли растворенного вещества}}{\text{Литры раствора}}\]
- Моляльность : Моляльность (m) раствора используется для представления количества молей растворенного вещества на килограмм растворителя. \[m= \dfrac{\text{Моли растворенного вещества}}{\text{Килограммы растворителя}}\]
Уравнения молярности и моляльности отличаются только своими знаменателями.Однако это огромная разница. Как вы помните, объем зависит от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Поэтому молярности растворов также различаются при разных температурах. Это создает преимущество использования моляльности над молярностью. Использование моляльностей, а не молярностей для лабораторных экспериментов лучше всего удерживает результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, моляльность не зависит от температуры.
Как вы помните, объем зависит от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Поэтому молярности растворов также различаются при разных температурах. Это создает преимущество использования моляльности над молярностью. Использование моляльностей, а не молярностей для лабораторных экспериментов лучше всего удерживает результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, моляльность не зависит от температуры.
Практические задачи
- В растворе содержится 111,0 мл (110,605 г) растворителя и 5,24 мл (6,0508 г) растворенного вещества. Найдите массовый процент, объемный процент и массовый/объемный процент растворенного вещества.
- Используя раствор, показанный на рисунке ниже, найдите молярный процент вещества С.
- Раствор объемом 1,5 л состоит из 0,25 г NaCl, растворенного в воде. Найдите его молярность.

- 0,88 г NaCl растворяют в 2.0л воды. Найдите его моляльность.
Решения
1:
Массовый процент
=(Масса растворенного вещества) / (Масса раствора) x 100%|
= (6,0508 г) / (110,605 г + 6,0508 г) x 100%
= (0,0518688312) х 100%
= 5,186883121%
Массовый процент = 5,186%
Объемный процент
= (Объем растворенного вещества) / (Объем раствора) x 100%
= (5,24 мл) / (111,0 мл + 5,24 мл) x 100%
=(0.0450791466) х 100%
=4,507914659%
Объемный процент = 4,51%
Процент массы/объема
= (масса растворенного вещества) / (объем раствора) x 100%
= (6,0508 г) / (111,0 мл + 5,24 мл) x 100%
= (0,0520) х 100%
= 5,205%
Процент массы/объема = 5,2054%
2. Моль C = (5 молекул C) x (1 моль C / 6,022×10 23 молекул C) = 8,30288941×10 -24 моль C
Всего молей = (24 молекулы) x (1моль/6. 022×10 23 молекул)= 3,98538691×10 -23 моль всего
022×10 23 молекул)= 3,98538691×10 -23 моль всего
X C = (8,30288941×10 -24 моль C) / (3,98538691×10 -23 моль) = 0,2083333333
Молярный процент C
= Х С х 100%
= (о.2083333333) х 100%
= 20,83333333
Моль Процент C = 20%
3. Моль NaCl = (0,25 г) / (22,99 г + 35,45 г) = 0,004277 моль NaCl
Молярность
= (моль растворенного вещества) / (литры раствора)
=(0.004277 моль NaCl) / (1,5 л)
= 0,002851 М
Молярность = 0,0029M
4. Моль NaCl = (0,88 г) / (22,99 г + 35,45 г) = 0,01506 моль NaCl
Масса воды = (2,0 л) x (1000 мл / 1 л) x (1 г / 1 мл) x (1 кг / 1000 г) = 2,0 кг воды
Моляльность
= (моль растворенного вещества) / (кг растворителя)
= (0,01506 моль NaCl) / (2,0 кг)
= 0,00752 м
Моляльность = 0,0075 м
Ссылки
- Петруччи, Харвуд, Херринг.
 Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531 .
Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531 .
Авторы и авторство
- Кристиан Рэй Фигероа (UCD)
Научные занятия г-жи Дж. Ким — Состав раствора: Молярность
II. ПРИМЕЧАНИЯ ПО МОЛЯРНОСТИ
Молярность описывает количество растворенного вещества в молях и объем раствора в литрах. Молярность – это количество молей растворенного вещества на объем раствора в литрах.
M = молярность = моли растворенного вещества = моль
литров раствора L
III. УПРАЖНЕНИЯ НА МОЛЯРНОСТЬ
1. Рассчитайте молярность раствора, полученного путем растворения 11,5 г твердого NaOH в количестве воды, достаточном для получения
1,50 л раствора.
2. Рассчитайте молярность раствора, полученного путем растворения 1,56 г газообразного HCl в количестве воды, достаточном для того, чтобы
составило 26. 8 мл раствора.
8 мл раствора.
3. Рассчитайте молярность раствора, приготовленного путем растворения 1,00 г этанола C2H5OH в количестве воды, достаточном для получения
конечного объема 101 мл.
4. Укажите концентрации всех ионов в каждом из следующих растворов:
а) 0,50 М Co(NO 3 ) 2 б) 1 М FeCl 3
5. Укажите концентрации ионы в каждом из следующих растворов:
а) 0,10 М Na 2 СО 3 б) 0.010 М Al 2 (SO 4 ) 3
6. Сколько молей ионов Ag + содержится в 25 мл 0,75 М раствора AgNO 3 ?
7. Рассчитайте число молей ионов Cl — в 1,75 л 1,0 x 10 -3 M AlCl 3
8. Для анализа содержания алкоголя в определенном вине химику требуется 1,00 л водного раствора 0,200 МК 2 Cr 2 O 7 . Сколько твердого K 2 Cr 2 O 7 (молярная масса = 294.2 г) необходимо взвесить, чтобы приготовить этот раствор?
Сколько твердого K 2 Cr 2 O 7 (молярная масса = 294.2 г) необходимо взвесить, чтобы приготовить этот раствор?
9. Формалин представляет собой водный раствор формальдегида, HCHO, используемый в качестве консерванта для биологических образцов.
Сколько граммов формальдегида необходимо использовать для приготовления 2,5 л 12,3 М формалина?
Щелкните здесь, чтобы получить ответы
Произошла ошибка при настройке файла cookie пользователя
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Состав раствора | Загрузить таблицу
Представлена и подтверждена двухфазная корреляция относительной проницаемости для смешанно-влажных пород. Он включает в себя условия ограничения процессов дренажа и впитывания и сканирования петель гистерезиса и выводится из корреляции капиллярного давления.
Хорошо известные относительные проницаемости Кори-Бердина были получены для водонасыщенных пород на основе степенной корреляции капиллярного давления Брукса-Кори и модели сети пучков труб. Мы распространили эту корреляцию на породу со смешанной гидрофильностью и теперь предлагаем следующую корреляцию относительной проницаемости для коллекторов со смешанной гидрофильностью. Функциональная форма симметрична по отношению к свойствам, зависящим от жидкости, потому что ни одна из жидкостей не имеет приоритета в смешанно-влажной среде.Он возвращается к стандартной корреляции Кори-Бердина для случаев полной смачиваемости водой или нефтью и демонстрирует следующие характеристики в соответствии с опубликованными экспериментами: во-первых, смачиваемость водой при низкой водонасыщенности и смачиваемость нефтью при низкой насыщенности нефтью. ; во-вторых, перевернутая S-образная кривая относительной проницаемости по нефти с точкой перегиба; и, в-третьих, замкнутые петли сканирования с гистерезисом.
Он включает в себя условия ограничения процессов дренажа и впитывания и сканирования петель гистерезиса и выводится из корреляции капиллярного давления.
Хорошо известные относительные проницаемости Кори-Бердина были получены для водонасыщенных пород на основе степенной корреляции капиллярного давления Брукса-Кори и модели сети пучков труб. Мы распространили эту корреляцию на породу со смешанной гидрофильностью и теперь предлагаем следующую корреляцию относительной проницаемости для коллекторов со смешанной гидрофильностью. Функциональная форма симметрична по отношению к свойствам, зависящим от жидкости, потому что ни одна из жидкостей не имеет приоритета в смешанно-влажной среде.Он возвращается к стандартной корреляции Кори-Бердина для случаев полной смачиваемости водой или нефтью и демонстрирует следующие характеристики в соответствии с опубликованными экспериментами: во-первых, смачиваемость водой при низкой водонасыщенности и смачиваемость нефтью при низкой насыщенности нефтью. ; во-вторых, перевернутая S-образная кривая относительной проницаемости по нефти с точкой перегиба; и, в-третьих, замкнутые петли сканирования с гистерезисом. Введение
Ранее1 мы представили корреляцию капиллярного давления для коллекторов со смешанной гидрофильностью и предложили расширить зависимость относительной проницаемости Кори-Бердина2,3 от гидрофильных до смешанно-гидрофильных условий.Теперь мы развиваем эту идею дальше и включаем гистерезисную логику. Основные конструктивные ограничения: Функциональная форма симметрична по отношению к нефти и воде. То есть функциональная форма инвариантна к замене нижнего индекса o на нижний индекс w. Петли гистерезиса замкнуты. 4 Петли гистерезиса капиллярного давления и относительных проницаемостей образуют согласованный набор. перевернутая буква «S».7–13 Достоверность корреляции относительной проницаемости и схемы гистерезиса проверяется на опубликованных измерениях относительной проницаемости4 и одновременно измеренных кривых гистерезисной относительной проницаемости и капиллярного давления.5 Схема гистерезиса легко программируется и может заменить схему Киллоу24 в численных симуляторах коллекторов.
Введение
Ранее1 мы представили корреляцию капиллярного давления для коллекторов со смешанной гидрофильностью и предложили расширить зависимость относительной проницаемости Кори-Бердина2,3 от гидрофильных до смешанно-гидрофильных условий.Теперь мы развиваем эту идею дальше и включаем гистерезисную логику. Основные конструктивные ограничения: Функциональная форма симметрична по отношению к нефти и воде. То есть функциональная форма инвариантна к замене нижнего индекса o на нижний индекс w. Петли гистерезиса замкнуты. 4 Петли гистерезиса капиллярного давления и относительных проницаемостей образуют согласованный набор. перевернутая буква «S».7–13 Достоверность корреляции относительной проницаемости и схемы гистерезиса проверяется на опубликованных измерениях относительной проницаемости4 и одновременно измеренных кривых гистерезисной относительной проницаемости и капиллярного давления.5 Схема гистерезиса легко программируется и может заменить схему Киллоу24 в численных симуляторах коллекторов. Широко распространено мнение, что большинство коллекторов смешанно-обводненные, и сетевые модели15 учитывают этот факт. Тем не менее, для включения свойств смешанных обводненных пород в численный симулятор потока в коллекторе необходимы проверенные корреляции.16–18 Обзор корреляции капиллярного давления
Корреляция относительной проницаемости выводится из корреляции капиллярного давления,1 и обзор дан здесь.Эскиз корреляции кривой капиллярного давления для смешанно-смоченной породы показан на рис. 1. Это расширение корреляции Брукса и Кори19,20 для первичного дренирования полностью водонасыщенного коллектора, которое может быть записано как уравнение 1.
где cwd = входное давление, 1/awd = индекс распределения пор по размерам,2 и SwR = остаточная (или неснижаемая) водонасыщенность.
Для первичного впитывания полностью гидрофильной породы (т. е. процесса снижения нефтенасыщенности от So = 1) капиллярное давление также может быть представлено уравнением1, с заменой нижнего индекса w на o. Для промежуточных случаев корреляция капиллярного давления представляет собой сумму двух крайних значений.
Широко распространено мнение, что большинство коллекторов смешанно-обводненные, и сетевые модели15 учитывают этот факт. Тем не менее, для включения свойств смешанных обводненных пород в численный симулятор потока в коллекторе необходимы проверенные корреляции.16–18 Обзор корреляции капиллярного давления
Корреляция относительной проницаемости выводится из корреляции капиллярного давления,1 и обзор дан здесь.Эскиз корреляции кривой капиллярного давления для смешанно-смоченной породы показан на рис. 1. Это расширение корреляции Брукса и Кори19,20 для первичного дренирования полностью водонасыщенного коллектора, которое может быть записано как уравнение 1.
где cwd = входное давление, 1/awd = индекс распределения пор по размерам,2 и SwR = остаточная (или неснижаемая) водонасыщенность.
Для первичного впитывания полностью гидрофильной породы (т. е. процесса снижения нефтенасыщенности от So = 1) капиллярное давление также может быть представлено уравнением1, с заменой нижнего индекса w на o. Для промежуточных случаев корреляция капиллярного давления представляет собой сумму двух крайних значений. Уравнение 2
где aw, ao и cw — положительные константы, а со — отрицательная константа. Существует один набор констант для впитывания и другой для дренажа. Мы используем термин «дренаж», если Sw уменьшается, и «впитывание», если Sw увеличивается, независимо от предпочтительной смачиваемости. Логика петли гистерезиса
Ограничения проектирования следуют из экспериментальных данных 21–26: изменение направления насыщения на первичной кривой дренажа до достижения остаточной водонасыщенности SwR (рис.2), создает кривую сканирования впитывания, нацеленную на остаточную нефтенасыщенность, определяемую соотношением захвата Лэнда. Отклонение от первичной кривой дренирования в точке SwR запускает кривую сканирования впитывания вниз до SoR. Эта кривая обозначена (b) на рис. 1 и является граничной кривой впитывания. Вторичная кривая дренирования, обозначенная (c) на рис. 1, определяется обращением от граничной кривой впитывания при SoR. Вместе кривые ограничивающего впитывания и вторичного (граничного) дренажа составляют замкнутую ограничивающую петлю гистерезиса.
Уравнение 2
где aw, ao и cw — положительные константы, а со — отрицательная константа. Существует один набор констант для впитывания и другой для дренажа. Мы используем термин «дренаж», если Sw уменьшается, и «впитывание», если Sw увеличивается, независимо от предпочтительной смачиваемости. Логика петли гистерезиса
Ограничения проектирования следуют из экспериментальных данных 21–26: изменение направления насыщения на первичной кривой дренажа до достижения остаточной водонасыщенности SwR (рис.2), создает кривую сканирования впитывания, нацеленную на остаточную нефтенасыщенность, определяемую соотношением захвата Лэнда. Отклонение от первичной кривой дренирования в точке SwR запускает кривую сканирования впитывания вниз до SoR. Эта кривая обозначена (b) на рис. 1 и является граничной кривой впитывания. Вторичная кривая дренирования, обозначенная (c) на рис. 1, определяется обращением от граничной кривой впитывания при SoR. Вместе кривые ограничивающего впитывания и вторичного (граничного) дренажа составляют замкнутую ограничивающую петлю гистерезиса. Все кривые сканирования дренажа, которые выходят из граничной кривой впитывания, сканируются обратно к SwR (рис. 3), а все развороты от ограничивающей кривой дренажа сканируются к SoR (рис. 4). Кривая сканирования, начинающаяся из Sw[j], j Насыщение реверсирования ‘th будет прослеживаться обратно к Sw[j-1] и формировать замкнутый цикл сканирования, если не произойдет новый реверс. (т. е. образует замкнутый цикл сканирования), процесс переходит на путь [j-2]-реверса, как если бы [j-1]-реверса не было, рис.5. Форма сканирующей петли аналогична ограничивающей петле, потому что параметры a и c являются константами для данной системы порода-флюид.
Все свойства j-й кривой сканирования помечены [j]. Капиллярное давление обозначается как pca[j], где a обозначает тип процесса и либо i для впитывания, либо d для дренажа. По соглашению j является нечетным числом для впитывания и четным числом для дренажа, 0 обозначает первичный процесс дренажа. Асимптоты кривых сканирования обозначены SwR[j] и SoR[j], а водонасыщенность обозначена Sw[j].
Все кривые сканирования дренажа, которые выходят из граничной кривой впитывания, сканируются обратно к SwR (рис. 3), а все развороты от ограничивающей кривой дренажа сканируются к SoR (рис. 4). Кривая сканирования, начинающаяся из Sw[j], j Насыщение реверсирования ‘th будет прослеживаться обратно к Sw[j-1] и формировать замкнутый цикл сканирования, если не произойдет новый реверс. (т. е. образует замкнутый цикл сканирования), процесс переходит на путь [j-2]-реверса, как если бы [j-1]-реверса не было, рис.5. Форма сканирующей петли аналогична ограничивающей петле, потому что параметры a и c являются константами для данной системы порода-флюид.
Все свойства j-й кривой сканирования помечены [j]. Капиллярное давление обозначается как pca[j], где a обозначает тип процесса и либо i для впитывания, либо d для дренажа. По соглашению j является нечетным числом для впитывания и четным числом для дренажа, 0 обозначает первичный процесс дренажа. Асимптоты кривых сканирования обозначены SwR[j] и SoR[j], а водонасыщенность обозначена Sw[j]. Наименьшие «глобальные» остаточные насыщения наибольшей ограничивающей петли гистерезиса обозначаются SwR и SoR.
Все кривые сканирования моделируются теми же константами a и c, что и ограничивающие кривые. В качестве примера обозначения первичное дренажное капиллярное давление обозначается как pcd[0], а его значение при первом реверсировании, Sw[1], дается как pcd[0](Sw[1]).
Наименьшие «глобальные» остаточные насыщения наибольшей ограничивающей петли гистерезиса обозначаются SwR и SoR.
Все кривые сканирования моделируются теми же константами a и c, что и ограничивающие кривые. В качестве примера обозначения первичное дренажное капиллярное давление обозначается как pcd[0], а его значение при первом реверсировании, Sw[1], дается как pcd[0](Sw[1]).
Комплексное решение проблемы композиции: знание, с чего начать
Разговоры на ужине в честь Дня благодарения могут быть неудобными…
Но проблем с композицией решений быть не должно.Напомним, что раствор – это гомогенная смесь двух или более веществ. Химики придумали множество способов описания состава раствора. Некоторые способы более подходят, чем другие, в зависимости от ситуации.
Вот те, с которыми вам будет очень уютно:
Всего несколько уравнений, которые можно запомнить и подставить в них числа. Звучит легко. Но это не всегда так. Особенно, когда вам не дают то, что вам нужно напрямую.Вместо этого вам дается куча других вещей в расчете на то, что вы сможете расшифровать, что с этим делать. В этом случае невероятно важен системный подход к проблеме, иначе вы наверняка застрянете.
Звучит легко. Но это не всегда так. Особенно, когда вам не дают то, что вам нужно напрямую.Вместо этого вам дается куча других вещей в расчете на то, что вы сможете расшифровать, что с этим делать. В этом случае невероятно важен системный подход к проблеме, иначе вы наверняка застрянете.
Вот что нужно помнить при решении сложной задачи о композиции решения:
- ВСЕ ПРЕДОСТАВЛЕННОЕ АКТУАЛЬНО И СВЯЗАННО.
- ВЫ СДЕЛАЛИ ЧТО-ТО НЕ ТАК, ЕСЛИ ВЫ НЕ ИСПОЛЬЗОВАЛИ ВСЕ ПРЕДОСТАВЛЕННОЕ.
- ВЫЯСНИТЕ, КАК КАЖДАЯ ПРЕДОСТАВЛЕННАЯ ВЕЩЬ ОТНОСИТСЯ К ТОМУ, ЧТО ВАС ПРОСЯТ НАЙТИ.
- Определите, что вопрос просит вас рассчитать.
- Разделите это на составляющие. Вы будете рассчитывать их как отдельные сущности.
- Например, представьте, что вас просят рассчитать молярность раствора. Нарисуйте линию, чтобы разделить рабочую область пополам. Назовите одну половину «моль растворенного вещества», а другую половину назовите «литры раствора».

- Например, представьте, что вас просят рассчитать молярность раствора. Нарисуйте линию, чтобы разделить рабочую область пополам. Назовите одну половину «моль растворенного вещества», а другую половину назовите «литры раствора».
- Поместите данную информацию под тем заголовком, к которому она больше всего относится
- Это потребует от вас очень внимательного изучения данной информации и запоминания некоторых связующих принципов
- Будьте внимательны. Правильная маркировка имеет ключевое значение. Знание того, что измеряется, так же важно, как и единица измерения. Подсказка: существует огромная разница между словами «растворенный», «растворитель» и «раствор».
- Используя предоставленную информацию, которая относится к ним, рассчитайте компоненты.
- Соберите компоненты вместе, чтобы получить окончательный ответ.
Электролит в автомобильных свинцовых аккумуляторных батареях представляет собой 3,75 М раствор серной кислоты плотностью 1,230 г/мл. Рассчитайте массовую долю и моляльность серной кислоты.
Нас просят найти две разные вещи, поэтому мы будем выполнять шаги дважды.
Начнем с массовых процентов:
1.Массовые проценты
2.
3. 4.
5.
Теперь найдем моляльность:
1. Моляльность
2.
3.
4.
5.
Практика действительно ведет к совершенству, но организованность и уверенность в том, что все, что указано в задаче, используется, может помочь взяться за дело.
Проблемы с химией? Работайте с таким наставником, как Виемма, чтобы исправить свой курс!
Хотите узнать больше о химии от Viemma?
Композиция функций — определение, домен, составная функция
Композиция функций – это процесс объединения двух или более функций в одну функцию.Функция представляет некоторую работу. Возьмем приготовление хлеба. Пусть x — мука, кухонный комбайн выполняет функцию приготовления теста с использованием муки (и пусть эта функция равна g(x)) и пусть печь выполняет функцию приготовления хлеба (и пусть эта функция равна f (Икс)).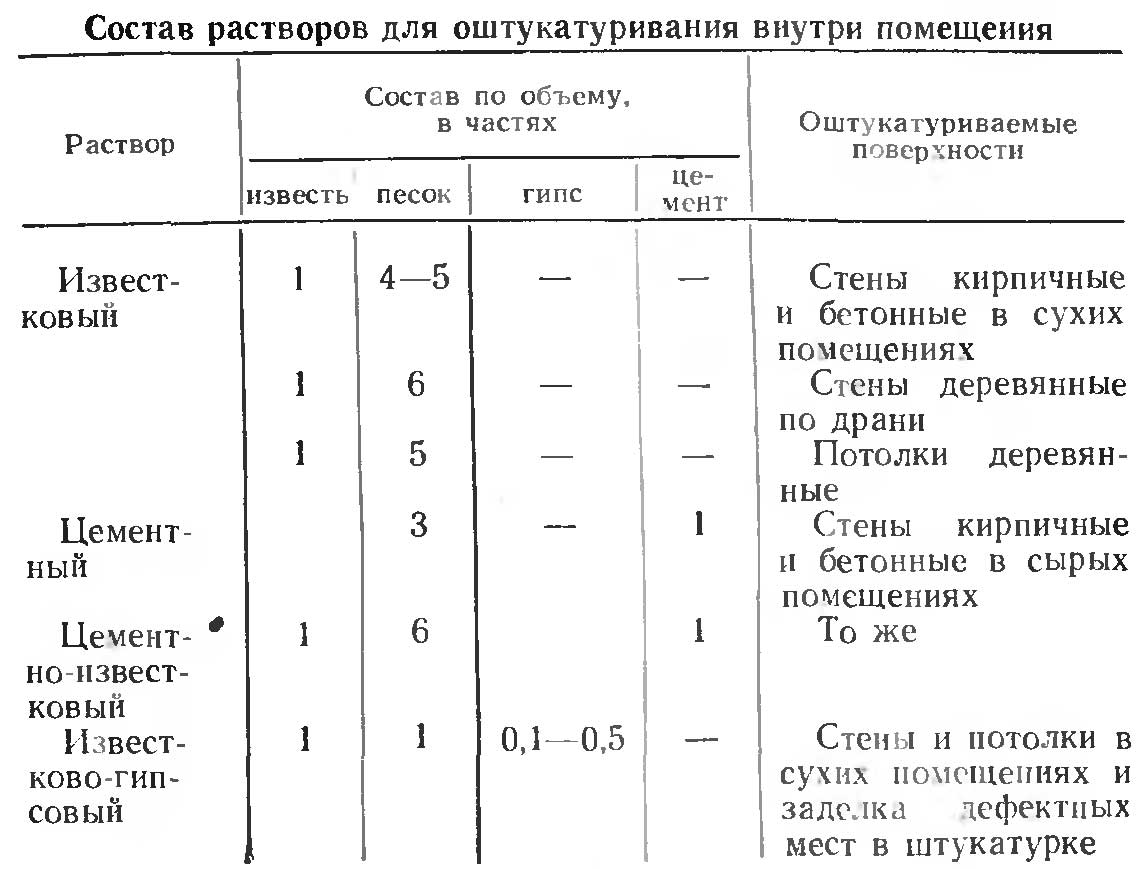 Для приготовления хлеба выход g(x) нужно поместить в функцию f(x) (т. е. приготовленное тесто нужно поставить в печь). Результат обозначается f(g(x)) и представляет собой композицию функций f(x) и g(x).
Для приготовления хлеба выход g(x) нужно поместить в функцию f(x) (т. е. приготовленное тесто нужно поставить в печь). Результат обозначается f(g(x)) и представляет собой композицию функций f(x) и g(x).
Давайте посмотрим, что такое композиция функций в математике вместе с ее вычислением. Давайте также посмотрим, как найти его домен и диапазон.
Какова композиция функций?
Композиция функций f(x) и g(x), где g(x) действует первой, представлена как f(g(x)) или (f ∘ g)(x). Он объединяет две или более функций, чтобы получить другую функцию. В составе функций выход одной функции, находящейся внутри скобок, становится входом внешней функции.то есть
- В f(g(x)), g(x) является входом f(x).
- В g(f(x)), f(x) является входом g(x).
Мы можем понять это, используя следующую цифру:
, т. е. чтобы найти f(g(x)) (которое читается как «f от g от x»), мы должны сначала найти g(x), а затем подставить результат в f(x).
Символ композиции функций
Символ композиции функций ∘. Его также можно показать без использования этого символа, но с помощью скобок.то есть
- (f ∘ g)(x) = f(g(x)) и читается как «f of g of x». Здесь g — внутренняя функция, а f — внешняя функция.
- (g ∘ f)(x) = g(f(x)) и читается как «g of f of x». Здесь f — внутренняя функция, а g — внешняя функция.
Как решать составные функции?
Используя BODMAS, мы всегда сначала упрощаем то, что находится в скобках. Таким образом, чтобы найти f (g (x)), сначала необходимо вычислить g (x) и подставить его в f (x).Точно так же, чтобы найти g (f (x)), сначала нужно вычислить f (x) и подставить его в g (x). т. е. при нахождении составных функций порядок имеет значение. Это означает, что f(g(x)) НЕ может быть равно g(f(x)). Для любых двух функций f(x) и g(x) мы находим составную функцию f(g(a)), используя следующие шаги:
- Найдите g(a), подставив x = a в g(x).

- Найдите f(g(a)) подстановкой x = g(a) в f(x).
Мы можем понять эти шаги, используя пример ниже.Здесь мы находим f(g(-1)) при f(x) = x 2 — 2x и g(x) = x — 5.
Мы можем обобщить этот процесс с помощью простых математических вычислений, как показано ниже:
е (г (-1)) = е (-1-5)
= f(-6)
= (-6) 2 — 2 (-6)
= 36 + 12
= 48
Нахождение составной функции по графику
Чтобы найти составную функцию двух функций (которые не определены алгебраически), показанную графически, мы должны вспомнить, что если (x, y) является точкой на функции f(x), то f(x) = y.Используя это, найти f(g(a)) (т.е. f(g(x)) при x = a):
- Сначала найдите g(a) (т. е. координату y на графике g(x), соответствующую x = a)
- Найти f(g(a)) (т.е. координату y на графике f(x), соответствующую g(a))
Пример: Найдите f(g(5)) по следующему графику.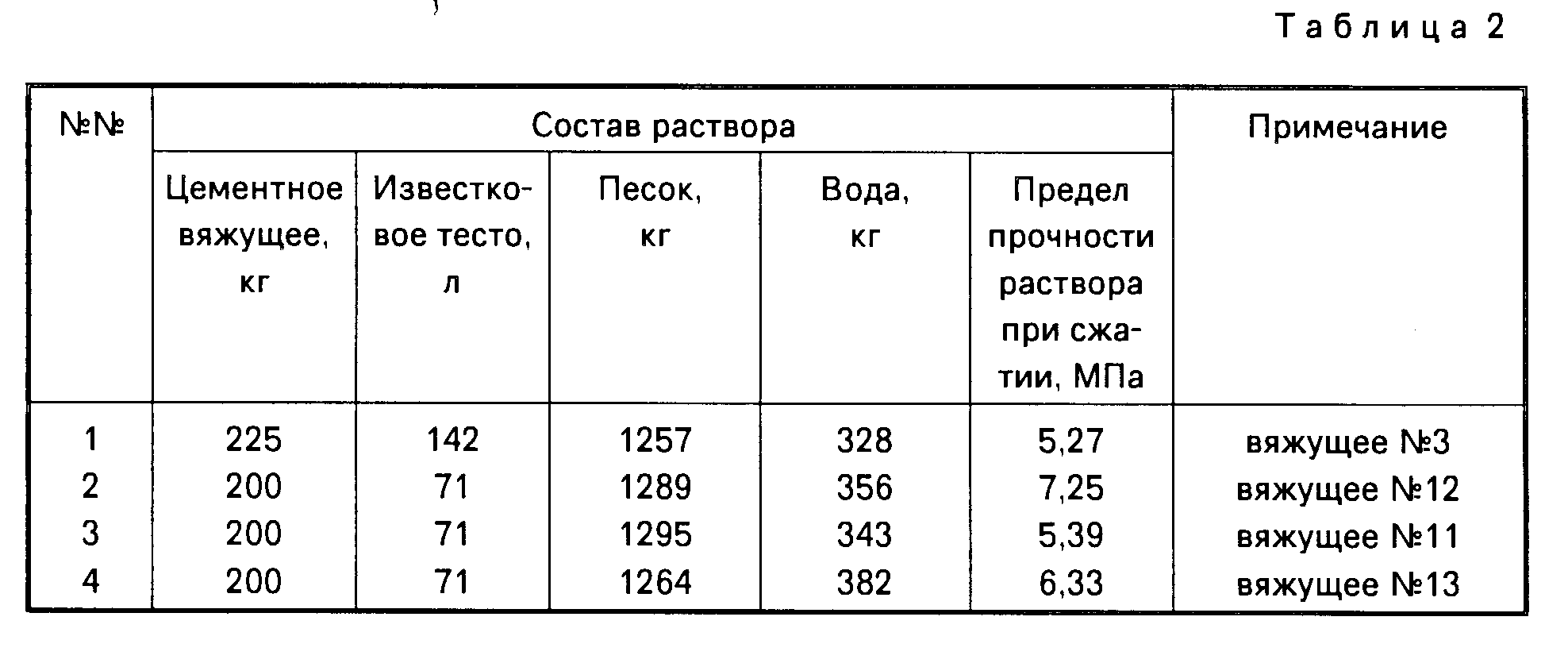
Решение:
f(g(5)) = f(3) (Поскольку g(5) = 3, так как (5, 3) принадлежит g(x))
= 2 (Поскольку f(3) = 2, так как (3, 2) принадлежит f(x))
Следовательно, f(g(5)) = 2.
Поиск составной функции из таблицы
Мы уже видели, как найти составную функцию, если задан график функций. Иногда точки на графике функций изображают таблицами. Таким образом, мы применяем ту же процедуру, что описана в предыдущем разделе.
Пример: Найдите g(f(-3)) с помощью следующих таблиц.
| х | ф(х) |
|---|---|
| -1 | -4 |
| -2 | -3 |
| -3 | -2 |
| -4 | -1 |
| х | г(х) |
|---|---|
| -4 | 1 |
| -3 | 0 |
| -2 | -1 |
| -1 | -2 |
Решение:
Из таблицы f(x), f(-3) = -2.
Итак, g(f(-3))=g(-2).
Из таблицы g(x), g(-2) = -1.
Таким образом, g(f(-3)) = -1.
Домен составных функций
В общем случае, если g : X → Y и f : Y → Z, то f ∘ g : X → Z. Т. е. областью определения f ∘ g является X, а область значений — Z. Но когда функции определены алгебраически, здесь — шаги по нахождению области определения составной функции f(g(x)).
- Найти область определения внутренней функции g(x) (пусть это будет A)
- Найдите область определения функции, полученной путем нахождения f(g(x)) (пусть это будет B)
- Найдите пересечение A и B и A ∩ B дает область определения f(g(x))
Пример: Найдите область определения f(g(x)) при f(x) = 1/(x+2) и g(x) = 1/(x+3).
Решение:
В f(g(x)) внутренней функцией является g(x), а ее областью определения является A = {x | х ≠ -3}.
Теперь вычислим f(g(x)).
\(\ начало {выровнено}
f(g(x)) &=f\left(\frac{1}{x+3}\right) \\
&=\frac{1}{\frac{1}{x+3}+2} \\
&=\frac{1}{\frac{1+2 x+6}{x+3}} \\
&=\фракция{х+3}{2х+7}
\конец{выровнено}\)
Его домен B = {x : x ≠ -7/2}
Таким образом, область определения f(g(x)) равна A ∩ B = {x : x ≠ -3 и x ≠ -7/2}.
В интервальной записи это (-∞, -7/2) U (-7/2, -3) U (-3, ∞).
Диапазон составных функций
Диапазон составной функции вычисляется так же, как диапазон любой другой функции. Это не зависит от внутренних или внешних функций. Вычислим диапазон f(g(x)), показанный в последнем примере. Мы получили f(g(x)) = \(\frac{x+3}{2 x+7}\). Предположим, что y = \(\frac{x+3}{2 x+7}\). Это рациональная функция. Следовательно, мы решаем это для x и устанавливаем знаменатель не равным нулю, чтобы найти диапазон.
(2x + 7) у = х + 3
2ху + 7у = х + 3
2xy — x = 3 — 7y
х (2г — 1) = 3 — 7г
х = (3 — 7 лет) / (2 года — 1)
Для диапазона 2y — 1 ≠ 0, что дает y ≠ 1/2.
Следовательно, диапазон = {y : y ≠ 1/2}.
☛ Похожие темы:
Часто задаваемые вопросы о составе функций
Что такое определение составной функции?
Составная функция из двух функций объединяет данные две функции в заданном порядке. т. е. для любых заданных двух функций f(x) и g(x) может быть 4 составные функции:
т. е. для любых заданных двух функций f(x) и g(x) может быть 4 составные функции:
- f(g(x)), который заменяет g(x) на f(x)
- g(f(x)) который заменяет f(x) на g(x)
- f(f(x)), которая заменяет f(x) на себя
- g(g(x)), который заменяет g(x) на себя
Как найти состав функций?
Чтобы вычислить составную функцию f(g(x)) при некотором x = a, сначала вычислите g(a), подставив x = a в функцию g(x).Затем подставьте g(a) в функцию f(x), подставив x = g(a). Точно так же мы можем вычислить и g(f(a)).
Важен ли порядок в составных функциях?
Да, в составных функциях порядок действительно важен. т. е. f (g (x)) ≠ g (f (x)) (т. е. они могут не быть равными все время). Но иногда они могут быть равны.
Как найти область определения составной функции?
Чтобы найти область определения составной функции, найдите область определения внутренней функции и область определения результирующей функции. Возьмите пересечение обоих доменов.
Возьмите пересечение обоих доменов.
Как найти диапазон составной функции?
Диапазон составной функции не зависит от внутренних или внешних функций. Его диапазон вычисляется так же, как мы вычисляем диапазон любой другой функции.
Как найти состав функций из графиков?
Если даны графики двух функций f(x) и g(x), то найти g(f(a)):
- Найти f(a) (используя точку (a, f(a)) на f(x))
- Найти g(f(a)) (используя точку (f(a), g(f(a)) ) на графике g(x))
Как разбить состав функций?
Мы можем разбить составную функцию на две с помощью некоторого наблюдения.Не забудьте перепроверить свой ответ после взлома. Если f(g(x)) = sin(x + 1), то можно сказать, что g(x) = x + 1 и f(x) = sin x. Давайте перепроверим ответ.
f(g(x)) = f (x + 1) = sin (x + 1) и, следовательно, наш ответ правильный.
Препарат плазмиды Qiagen — Буферная композиция
Препарат плазмиды Qiagen — состав буфера и подготовка Примечание : Буферный состав указан на литр раствора. Не автоклавируйте буфер, содержащий изопропанол, а стерилизуйте фильтрованием.Расчеты буфера основаны на трис-основании, доведенном до pH с помощью HCl (Tris-Cl). При использовании реагента Tris-HCl необходимо пересчитать используемые качества.
Не автоклавируйте буфер, содержащий изопропанол, а стерилизуйте фильтрованием.Расчеты буфера основаны на трис-основании, доведенном до pH с помощью HCl (Tris-Cl). При использовании реагента Tris-HCl необходимо пересчитать используемые качества.
Буфер P1 — Буфер для ресуспендирования
50 мМ Tris-Cl, pH 8,0, 10 мМ ЭДТА, 100 мкг/мл РНКазы А
Условия хранения — 4 o C после добавления РНКазы А
Prep — Растворить 6,06 г трис-основы, 3,72 г ЭДТА-2H 2 0 в 800 мл dh30. Отрегулируйте pH до 8,0 с помощью HCl. Отрегулируйте объем до 1 литра с помощью dH 2 O.Добавьте 100 мг РНКазы А на литр P1.
Буфер P2 — Буфер для лизиса
200 мМ NaOH, 1% SDS
Условия хранения — КТ
Растворите 8,09 г гранул NaOH в 950 мл dH 2 O, 50 мл 20% раствора SDS. Конечный объем должен быть 1 литр.
Буфер P3 — Буфер нейтрализации для наборов Qiatips, Midiprep, Maxiprep и Gigaprep.
3,0М ацетат калия, pH 5,5
Условия хранения — 4 o C или RT
Растворите 294,5 г ацетата калия в 500 мл dH 2 O.Доведите pH до 5,5 с помощью ледяной уксусной кислоты (около 110 мл). Отрегулируйте объем до 1 литра с помощью dH 2 O.
Буфер N3 — Буфер нейтрализации для спин-колонок.
Состав неизвестен
Условия хранения — КТ
Буфер PE — Буфер для промывки
Состав неизвестен
Условия хранения — КТ
Буфер QBT — равновесный буфер
750 мМ NaCl, 50 мМ MOPS, pH 7,0, 15 % изопропанола, 0,15 % Triton X-100
Условия хранения — КТ
Растворение 43.83 г NaCl, 10,46 г MOPS (свободная кислота) в 800 мл dH 2 O. Доведите pH до 7,0. Добавьте 150 мл чистого изопропанола и 15 мл 10% раствора Triton X-100. Отрегулируйте объем до 1 литра с помощью dH 2 O.
Буфер контроля качества — промывочный буфер
1,0 М NaCl, 50 мМ MOPS, pH 7,0, 15 % изопропанола
Условия хранения — КТ
Растворите 58,44 г NaCl и 10,46 г MOPS (свободная кислота) в 800 мл dH 2 O. Доведите pH до 7,0. Добавьте 150 мл чистого изопропанола. Отрегулируйте объем до 1 литра с помощью dH 2 O.
Доведите pH до 7,0. Добавьте 150 мл чистого изопропанола. Отрегулируйте объем до 1 литра с помощью dH 2 O.
Буфер QF — Буфер для элюции
1,25 М NaCl, 50 мМ Трис-Cl, pH 8,5, 15 % изопропанола
Условия хранения — КТ
Растворите 73,05 г NaCl и 6,06 г трис-основания в 800 мл dH 2 O и доведите pH до 8,5 с помощью HCl. Добавьте 150 мл чистого изопропанола. Отрегулируйте объем до 1 литра с помощью dH 2 O.
Буфер TE
10 мМ трис-Cl, pH 8,0, 1 мМ ЭДТА
Условия хранения — КТ
Буфер STE
100 мМ NaCl, 10 мМ Трис-Cl, pH 8.0, 1М ЭДТА
Условия хранения — КТ
Растворите 5,84 г NaCl, 1,21 г трис-основания и 0,37 г ЭДТА-2H 2 O в 800 мл dH 2 O и доведите pH до 8,0 с помощью HCl. Добавьте объем к 1 литру с dH 2 O.
Буфер EB — Буфер для элюции
10 мМ Трис-Cl, рН 8,5
Условия хранения — КТ
QG Buffer — Буфер для солюбилизации для набора для экстракции геля
Состав неизвестен (собственность)
Условия хранения — КТ
Буфер PB — буфер привязки
Состав неизвестен (собственность)
Условия хранения — КТ
Вернуться к экспериментальным процедурам и рецептам растворов
Вернуться домой
.