Слова «раствор» морфологический и фонетический разбор
Объяснение правил деление (разбивки) слова «раствор» на слоги для переноса.
Онлайн словарь Soosle.ru поможет: фонетический и морфологический разобрать слово «раствор» по составу, правильно делить на слоги по провилам русского языка, выделить части слова, поставить ударение, укажет значение, синонимы, антонимы и сочетаемость к слову «раствор».
Содержимое:
- 1 Слоги в слове «раствор»
- 2 Как перенести слово «раствор»
- 3 Морфемный разбор слова «раствор» по составу
- 4 Сходные по морфемному строению слова «раствор»
- 5 Синонимы слова «раствор»
- 6 Ударение в слове «раствор»
- 7 Фонетическая транскрипция слова «раствор»
- 8 Фонетический разбор слова «раствор» на буквы и звуки (Звуко-буквенный)
- 9 Предложения со словом «раствор»
- 10 Сочетаемость слова «раствор»
- 11 Значение слова «раствор»
- 12 Склонение слова «раствор» по подежам
- 13 Как правильно пишется слово «раствор»
Слоги в слове «раствор»
Количество слогов: 2
По слогам: ра-створ
По правилам школьной программы слово «раствор» можно поделить на слоги разными способами. Допускается вариативность, то есть все варианты правильные. Например, такой:
Допускается вариативность, то есть все варианты правильные. Например, такой:
рас-твор
По программе института слоги выделяются на основе восходящей звучности:
ра-створ
Ниже перечислены виды слогов и объяснено деление с учётом программы института и школ с углублённым изучением русского языка.
с примыкает к этому слогу, а не к предыдущему, так как не является сонорной (непарной звонкой согласной)
Как перенести слово «раствор»
ра—створ
рас—твор
раст—вор
Морфемный разбор слова «раствор» по составу
| раствор | корень |
| ø | нулевое окончание |
раствор
Сходные по морфемному строению слова «раствор»
Сходные по морфемному строению слова
Синонимы слова «раствор»
1. формалин
формалин
2. вираж
3. золь
4. рапа
5. фиксаж
6. фиксатив
7. лизоформ
8. гидрораствор
9. рассол
10. сироп
11. уксус
12. эссенция
13. зольник
14. коллодий
15. угол
16. отверстие
17. жидкость
18. смесь
19. мертель
20. эмульсоид
21. подлив
22. физиораствор
23. состав
24. алкозоль
25. болтушка
26. замесь
Ударение в слове «раствор»
раство́р — ударение падает на 2-й слог
Фонетическая транскрипция слова «раствор»
[раств`ор]
Фонетический разбор слова «раствор» на буквы и звуки (Звуко-буквенный)
| Буква | Звук | Характеристики звука | Цвет |
|---|---|---|---|
| р | [р] | согласный, звонкий непарный (сонорный), твёрдый | р |
| а | [а] | гласный, безударный | а |
| с | [с] | согласный, глухой парный, твёрдый, шумный | с |
| т | [т] | согласный, глухой парный, твёрдый, шумный | т |
| в | [в] | согласный, звонкий парный, твёрдый, шумный | в |
| о | [`о] | гласный, ударный | о |
| р | [р] | согласный, звонкий непарный (сонорный), твёрдый | р |
Число букв и звуков:
На основе сделанного разбора делаем вывод, что в слове 7 букв и 7 звуков.
Буквы: 2 гласных буквы, 5 согласных букв.
Предложения со словом «раствор»
При низкой кислотности желудка мёд в виде холодного водного раствора (1 ст.
Источник: Иван Дубровин, Все об обычном меде.
Поливы, подкормки слабыми растворами удобрений, лук многоярусный подкармливают жидкими органическими удобрениями: на 10 л воды разводят по 1 ст.
Источник: О. А. Ганичкина, Все о саде и огороде. Полная современная энциклопедия, 2014.
При намерении поставить более надёжный бордюр канаву изначально можно выкопать немного глубже, чтобы заложить под бордюрные кирпичи цементный раствор.
Источник: М. С. Жмакин, Дорожки и площадки, бордюры, каменные горки, стенки, ступени из камня, плитки, гравия, гальки на вашем участке, 2012.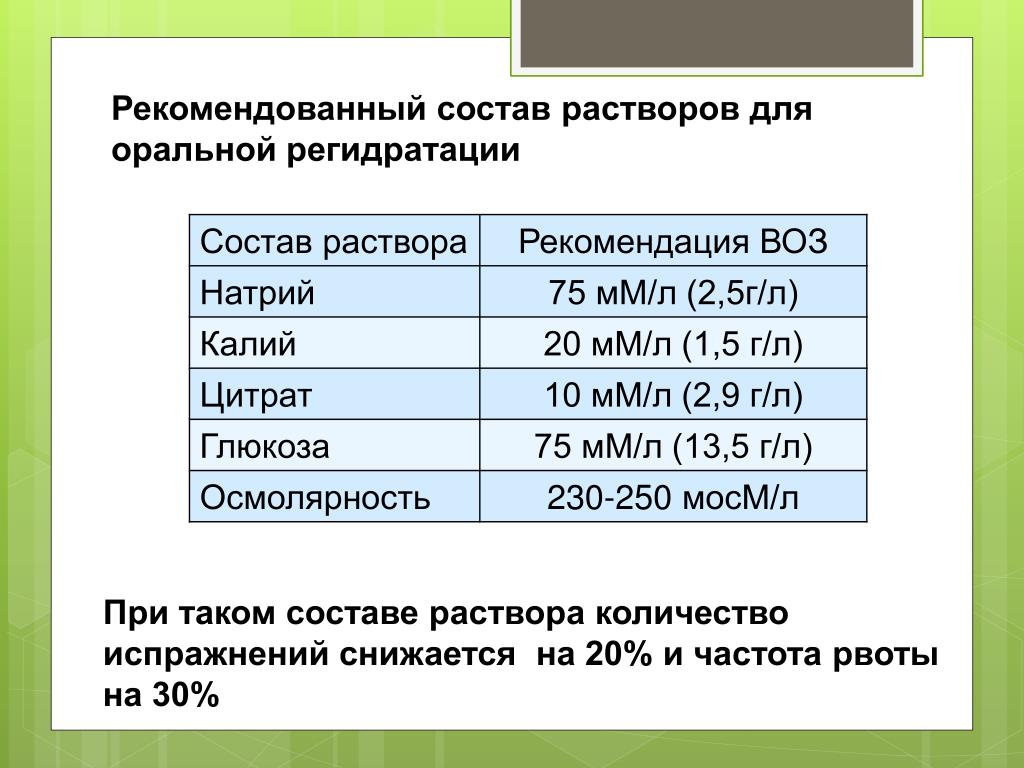
Сочетаемость слова «раствор»
1. цементный раствор
2. известковый раствор
3. питательный раствор
4. раствор соли
5. раствор марганцовки
6. раствор глюкозы
7. для приготовления раствора
8. слой раствора
9. состав раствора
10. раствор схватился
11. раствор остынет
12. раствор высохнет
13. залить раствором
14. приготовить раствор
15. использовать раствор
16. (полная таблица сочетаемости)
Значение слова «раствор»
РАСТВО́Р1 , -а, м. 1. Угол, образуемый раздвинутыми ножками циркуля, лезвиями ножниц и т. п. Раствор циркуля.
РАСТВО́Р2 , -а, м. Однородная жидкость, полученная растворением твердого или жидкого вещества в воде или в другой жидкости. Раствор марганца. (Малый академический словарь, МАС)
Склонение слова «раствор» по подежам
| Падеж | Вопрос | Единственное числоЕд.ч. | Множественное числоМн.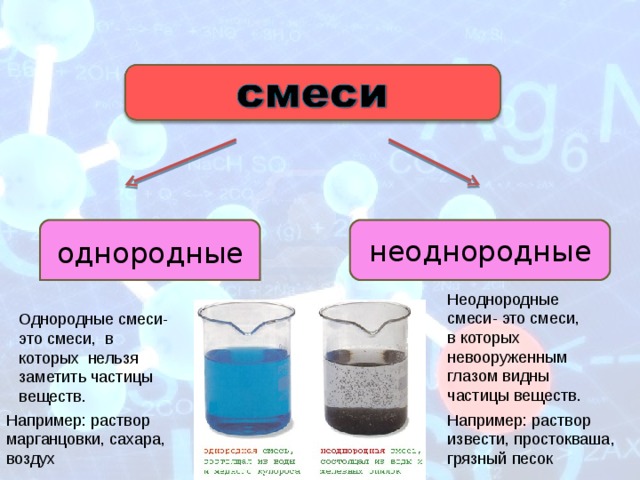 ч. ч. |
|---|---|---|---|
| ИменительныйИм. | что? | раствор | растворы |
| РодительныйРод. | чего? | раствора | растворов |
| ДательныйДат. | чему? | раствору | растворам |
| ВинительныйВин. | что? | раствор | растворы |
| ТворительныйТв. | чем? | раствором | растворами |
| ПредложныйПред. | о чём? | растворе | растворах |
Как правильно пишется слово «раствор»
Орфография слова «раствор»Правильно слово пишется: раство́р
Нумерация букв в слове
Номера букв в слове «раствор» в прямом и обратном порядке:
- 7
р
1 - 6
а
2 - 5
с
3 - 4
т
4 - 3
в
5 - 2
о
6 - 1
р
7
Растворы
Авторы: Гаммель И. В., Кононова С. В., Раскаткина Л. В.
В., Раскаткина Л. В.
I.РАСТВОРЫ. ОСНОВНЫЕ ПОНЯТИЯ.
Раствор – это твердая, жидкая или газообразная однородная система, состоящая из двух или более компонентов.
Раствор – это жидкая лекарственная форма, полученная путем растворения одного или нескольких лекарственных веществ и предназначенная для внутреннего, наружного или парентерального применения.
1.1. Классификация растворов.
1.1.1. По составу:
а) Простые растворы
б) Сложные растворы
4.1.2. По способу применения:
а) Для внутреннего применения (микстуры, капли)
б) Для наружного применения (капли, примочки, полоскания)
4. 1.3. По физико-химической природе:
1.3. По физико-химической природе:
а) Гомогенные системы
— Истинные растворы
— Растворы высокомолекулярных соединений
б) Гетерогенные системы
— Коллоидные растворы
— Суспензии
— Эмульсии
1.1.4. В зависимости от применяемых растворителей:
а) Водные растворы
б) Спиртовые растворы
в) Масляные растворы
г) Глицериновые растворы
д) Растворы на синтетических растворителях
Преимущества растворов:
1) Высокая биодоступность
2) Широкий спектр назначения
3) Простота приготовления
4) Удобство применения
5) Возможность корригировать вкус, цвет, запах лекарственных веществ.
Недостатки растворов:
1) Неудобство транспортировки (некомпактность упаковки)
2) Возможность микробного загрязнения
3) Вероятность гидролиза лекарственных веществ
1. 2.Растворители
2.Растворители
Растворители для жидких лекарственных форм – это индивидуальные химические соединения или их смеси, способные растворять различные вещества и образовывать с ними однородные смеси – растворы, состоящие из одного или нескольких компонентов.
Классификация растворителей:
1) Неорганические (вода очищенная)
2) Органические
— Летучие
1. Этиловый спирт
2. Эфир медицинский
3. Хлороформ
— Нелетучие
1. Глицерин
2. Масла растительные
3. Масло вазелиновое
4. Диметилсульфоксид (димексид)
Требования к растворителям:
1. Достаточная растворяющая способность
2. Химическая и фармакологическая индифферентность
3. Безопасность в пожарном отношении
4. Рациональность с точки зрения биофармации
5. Должны быть экономически выгодны и доступны.
Должны быть экономически выгодны и доступны.
1.3. Истинные растворы.
Истинные растворы – это однородные системы, молекулярной или ионной степени дисперсности, то есть лекарственные вещества в ней диспергированы до ионно-молекулярного состояния.
В молекулярно-дисперсных системах размер частиц порядка 0,1 нм. К ним относят: растворы неэлектролитов (сахар, спирт). Растворенное вещество распадается на отдельные кинетические самостоятельные молекулы.
В ионно-дисперсных системах размер частиц порядка 0,1 нм. К ним относят растворы электролитов (натрия хлорид, магния сульфат). Растворенное вещество находится в виде отдельных гидратированных ионов и молекул в некоторых равновесных количествах. Истинные растворы являются однофазными системами, они гомогенны даже при рассматривании в электронный микроскоп и их компоненты не могут быть разделены фильтрованием или каким-либо другим способом.-800x600.jpg)
Лекарственные вещества обладают разной способностью к растворению в воде и других растворителях. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость увеличивается с повышением температуры. Некоторые лекарственные вещества растворяются медленно, с целью ускорения растворения прибегают к нагреванию, предварительному измельчению лекарственного вещества и перемешиванию смеси.
1.4. Концентрация.
Концентрация – это количество вещества, растворенного в определенном количестве растворителя.
В зависимости от метода изготовления раствора содержание лекарственных веществ в жидких лекарственных формах выражают различными способами в соответствии с приказом МЗ РФ № 308 от 21.10.1997.
1) Массо-объемная концентрация – это количество лекарственного вещества (в граммах) в общем объеме лекарственной формы (в мл),
2) Концентрация по массе – это количество лекарственного вещества (в граммах) в общей массе лекарственной формы (в граммах),
3) Объемная концентрация – это количество жидкого лекарственного вещества (в мл) в общем объеме лекарственной формы (в мл).
Способы обозначения концентрации.
В прописях рецептов концентрация может быть обозначена:
1) В процентах (%).
2) Раздельным перечислением лекарственного вещества и дисперсионной среды (растворителя).
3) С указанием растворителя до заданного объема или массы (ad).
4) С указанием соотношения массы или объема растворяемого лекарственного вещества и объема или массы раствора.
1.5. Растворимость.
Растворимостью называют свойство вещества растворяться в воде или других растворителях. В фармацевтической практике растворимость обозначается в виде отношения количества растворенного вещества к количеству насыщенного раствора, которое нужно из него приготовить. В фармацевтической практике используются таблицы растворимости в виде отношения одной массовой части вещества к необходимому количеству растворителя. Сведения о растворимости лекарственных веществ находятся в частных статьях ГФ.
Сведения о растворимости лекарственных веществ находятся в частных статьях ГФ.
Насыщенный раствор – это раствор, в котором скорость растворения лекарственного вещества и скорость оседания частиц равны.
Факторы, влияющие на растворимость:
1. Природа лекарственного вещества и растворителя
2. Сила связи между молекулами или ионами растворяемого вещества
3. Сила диффузии
4. Сила взаимодействия между веществом и растворителем
5. Температура
6. Степень дисперсности.
Чтобы читать дальше, купите книгу.
Стоимость:
4.3: Состав растворов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15057
Растворы представляют собой гомогенные смеси , содержащие один или более растворяет в растворителе .
Единицы относительной концентрации
Концентрации часто выражаются в относительных единицах (например, в процентах) с обычно используемыми тремя различными типами процентных концентраций:
- Массовые проценты когда дана масса растворенного вещества и масса раствора: \[\text{Процент массы}=\dfrac{\text{Масса растворенного вещества}}{\text{Масса раствора}} \times 100\% \ ярлык{1}\]
- Объемный процент : Объемный процент используется для выражения концентрации раствора, когда объем растворенного вещества и объем раствора заданы: \[\text{Объемный процент}= \dfrac{\text{Объем Раствор}}{\text{Объем раствора}} \times 100\% \label{2}\]
- Процент массы/объема: Другой вариант процентной концентрации — это процент массы/объема, который измеряет массу или вес растворенного вещества в граммах (например, в граммах) по сравнению с объемом раствора (например, в мл).

\[\text{Масса/объем в процентах}= \dfrac{\text{Масса растворенного вещества (г)}}{\text{Объем раствора (мл)}} \times 100\% \label{3}\ ]
Рисунок использован с разрешения Википедии.
Пример \(\PageIndex{1}\): «Крепость» алкоголя как единица концентрации
Например, в Соединенных Штатах содержание алкоголя в спиртных напитках определяется как двойное процентное содержание алкоголя по объему (об./об.). называется доказательством. Какова концентрация алкоголя в спиртных напитках Bacardi 151 , которые продаются с крепостью 151 (отсюда и название)?
Рисунок: Почти пустая бутылка Bacardi 151. из Википедии.Раствор
Он будет иметь содержание спирта 75,5% (вес/вес) в соответствии с определением «пруф».
При расчете этих процентов единицы измерения растворенного вещества и раствора должны быть эквивалентными единицами (а весовые/объемные проценты (масс./об.%) определяются в граммах и миллилитрах).
| Вы НЕ МОЖЕТЕ подключить… | Вы НЕ МОЖЕТЕ подключить… |
|---|---|
| (2 г растворенного вещества) / (1 кг раствора) | (2 г растворенного вещества) / (1000 г раствора) |
| или (0,002 кг растворенного вещества) / (1 кг раствора) | |
| (5 мл растворенного вещества) / (1 л раствора) | (5 мл растворенного вещества) / (1000 мл раствора) |
| или (0,005 л растворенного вещества) / (1 л раствора) | |
| (8 г растворенного вещества) / (1 л раствора) | (8 г растворенного вещества) / (1000 мл раствора) |
| или (0,008 кг растворенного вещества) / (1 л раствора) |
Единицы концентрации разведения
Иногда, когда растворы слишком разбавлены, их процентная концентрация слишком мала. Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0,000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют
Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0,000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют
- Части на миллион : Концентрация раствора, содержащего 1 г растворенного вещества и 1000000 мл раствора (так же, как 1 мг растворенного вещества и 1 л раствора), создаст очень маленькую процентную концентрацию. Поскольку раствор, подобный этому, был бы очень разбавленным, плотность раствора хорошо аппроксимируется плотностью растворителя; для воды это 1 г/мл (но будет отличаться для разных растворителей).
 Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
- Частей на миллиард : Частей на миллиард (ppb) почти как ppm, за исключением того, что 1 ppb в 1000 раз более разбавлен, чем 1 ppm. \[\text{1 ppb} = \dfrac{1\; \mu \text{g раствор}}{\text{1 л раствора}}\]
- Части на триллион : Как и в случае с ppb, идея частей на триллион (ppt) аналогична концепции частей на миллион.
 Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Пример \(\PageIndex{2}\): частей на миллион в атмосфере
Вот таблица с объемными процентами различных газов, содержащихся в воздухе. Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент массы отличается от состава по массе или состава по количеству молей.
| Название элемента | Объемный процент (об./об.) | частей на миллион (об/об) |
|---|---|---|
| Азот | 78. 084 084 | 780 840 |
| Кислород | 20,946 | 209 460 |
| Водяной пар | 4,0% | 40 000 |
| Аргон | 0,934 | 9 340 |
| Углекислый газ | 379* (но быстро растет) | |
| Неон | 0,008 | 8,0 |
| Гелий | 0,000524 | 5,24 |
| Метан | 0,00017 | 1,7 |
| Криптон | 0,000114 | 1,14 |
| Озон | 0,000001 | 0,1 |
| Моноксид азота | 0,00003 | 0,305 |
Единицы концентрации, основанные на молях
- Мольная доля : Мольная доля вещества – это доля всех его молекул (или атомов) от общего числа молекул (или атомов).
 Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]
Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\] - Мольные проценты : Мольные проценты (вещества A) выражены \(\chi_A\) в виде процентов. \[\text{Молярный процент (вещества A)}= \chi_A \times 100\%\]
- Молярность : Молярность (M) раствора используется для представления количества молей растворенного вещества на литр раствора. \[M= \dfrac{\text{Моли растворенного вещества}}{\text{Литры раствора}}\]
- Моляльность : Моляльность (m) раствора используется для представления количества молей растворенного вещества на килограмм растворителя. \[m= \dfrac{\text{Моли растворенного вещества}}{\text{Килограммы растворителя}}\]
 50 мл дистиллированной воды (0 М), раствор гидроксида натрия 0,1 М и раствор соляной кислоты 0,1 М из group4swimmingpool.
50 мл дистиллированной воды (0 М), раствор гидроксида натрия 0,1 М и раствор соляной кислоты 0,1 М из group4swimmingpool.Уравнения молярности и моляльности отличаются только своими знаменателями. Однако это огромная разница. Как вы помните, объем зависит от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Поэтому молярности растворов также различаются при разных температурах. Это создает преимущество использования моляльности над молярностью. Использование моляльностей, а не молярностей для лабораторных экспериментов лучше всего удерживает результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, моляльность не зависит от температуры.
Пример \(\PageIndex{1}\)
В растворе содержится 111,0 мл (110,605 г) растворителя и 5,24 мл (6,0508 г) растворенного вещества. Найдите массовый процент, объемный процент и массовый/объемный процент растворенного вещества.
Раствор
Процент по массе
= (Масса растворенного вещества) / (Масса раствора) x 100%|
=(6,0508г) / (110,605г + 6,0508г) x 100%
=(0,0518688312) x 100%0025
Объемный процент
= (Объем растворенного вещества) / (Объем раствора) x 100 %
= (5,24 мл) / (111,0 мл + 5,24 мл) x 100 %
= (0,0450791402 %)
=4,507914659%
Объемный процент = 4,51%
Масса/объемный процент
= (масса растворенного вещества) / (объем раствора) x 100% ) x 100 %
= (0,0520) x 100 %
= 5,205 %
Процент массы/объема = 5,2054 %
Пример \(\PageIndex{2}\)
Используя раствор, показанный на рисунке ниже, найдите молярный процент вещества C. (1mol C / 6.022×10 23 C molecules) = 8.30288941×10 — 24 mol C
Total Moles= (24 molecules) x (1mol / 6.022×10 23 molecules)= 3.98538691×10 — 23 моль всего
X C = (8,30288941×10 — 24 моль C) / (3,98538691×10 — 23 моль) = . 2083333333
2083333333
Процентный процент C
= X7 C43434343438888888888888). 100%
= 20,83333333
Моль Процент C = 20%
Пример \(\PageIndex{3}\)
1,5 л воды состоит из 0,25 г NaCl. Найдите его молярность.
Раствор
Моль NaCl = (0,25 г) / (22,99 г + 35,45 г) = 0,004277 моль NaCl
Молярность
= (моль растворенного вещества) / (литры раствора)
= (0,004277MOL NaCl) / (1,5 л)
= 0,002851 М
Molarity = 0,0029M
. PageIndex{4}\) 0,88 г NaCl растворяют в 2,0 л воды. Найдите его моляльность. Моль NaCl= (0,88 г) / (22,99 г + 35,45 г) = 0,01506 моль NaCl Масса воды = (2,0 л) x (1000 мл / 1 л) x (1 г / 1 мл) x (1 кг) / 1000 г) = 2,0 кг воды Моляльность = (Моли растворенного вещества) / (кг растворителя) = (0,01506 моль NaCl) / (2,0 кг) = 0,0075290897 м Моляльность = 90 4.3: Композиция Решений распространяется по незаявленной лицензии и была создана, изменена и/или курирована LibreTexts. Раствор представляет собой гомогенную смесь. Растворы также могут быть получены путем смешивания многих различных фаз.
иметь значение. Например, воздух
решение. Растворенные газы выделяют кислород, углекислый газ, аргон, озон и
другие растворяются в
растворитель газообразный азот. Другой пример можно найти в «золотых» украшениях. Большинство
золотые украшения проданы
в мире не 24-каратное (т.е. 100% чистое золото), а скорее
раствор других металлов,
обычно серебро и медь в золотом растворителе. Такой раствор металла (ов)
в другом металле называется
амальгама. Пожалуй, самым важным свойством раствора является его концентрация.
Разбавленная уксусная кислота
раствор, также называемый уксусом, используется в кулинарии, в то время как концентрированный
раствор уксусной кислоты
убьет тебя, если проглотит. Единственная разница между такими решениями состоит в том,
концентрация
растворенный. Молярность, количество молей растворенного вещества на литр раствора, имеет
единицы моль / л, которые
сокращенно M. Эта единица является наиболее часто используемой мерой
концентрация. Это полезно
когда вы хотите знать количество молей растворенного вещества, когда вы знаете
как молярность, так и
объем раствора. Например, легко вычислить объем
раствора 1,5 М HCl, необходимой для полной реакции с 0,32 моль NaOH: Нормальность, количество молярных эквивалентов растворенного вещества на литр
решение, имеет единицы
эквивалентов / л, которые сокращенно N. Для иллюстрации
разница между молярностью и
нормальности предположим, что мы использовали 1,5 M раствор серной
кислота,
H 2 SO 4 вместо 1,5 М раствора
соляная кислота, HCl в
приведенный выше пример. Так как серная кислота может отдать два протона
NaOH, как указано в
, потребуется только вдвое меньше серной
кислота как соляная кислота
для нейтрализации гидроксида натрия. Раствор
Ссылки
 Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531
Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531 На этой странице нет тегов.
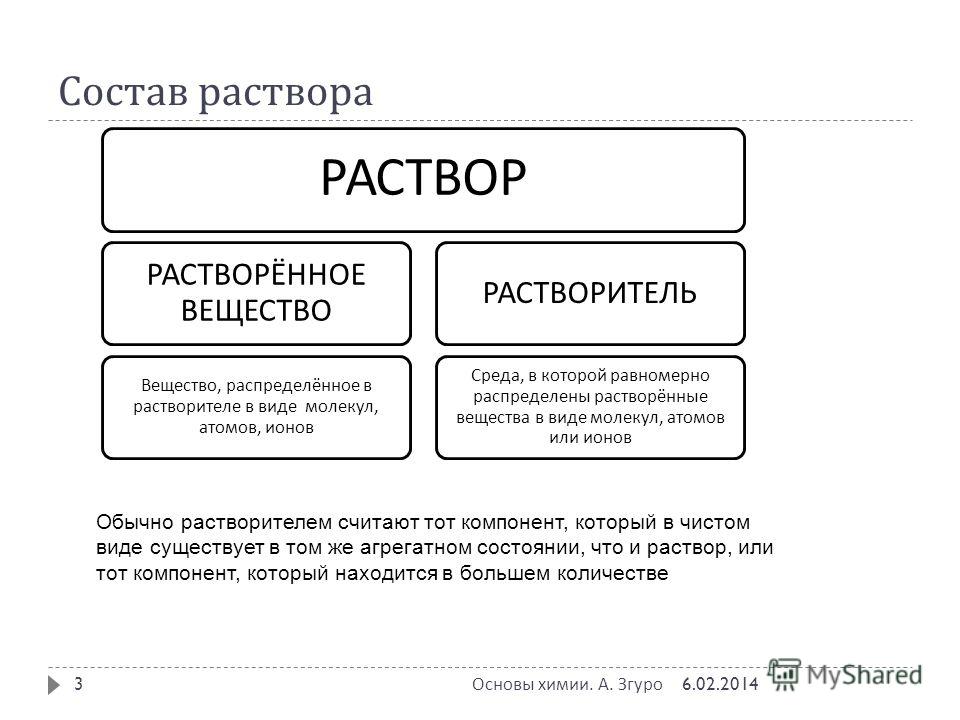
Состав растворов: Состав раствора
Введение в решения
 Это означает, что компоненты
решение настолько равномерно
распределены по всей смеси, что нет заметных различий в
сочинение. Решения могут
образуется при смешивании двух веществ, таких как сахар и вода. Если
ты насыпаешь пачку сахара
в стакан воды, изначально у вас взвесь в виде сахара
кристаллы плавают в стекле.
Когда вы будете перемешивать сахар и воду достаточно долго, вы
в итоге получить прозрачную бесцветную
смесь. Некоторых людей, особенно маленьких детей, можно обмануть таким
демонстрация в
думая, что сахар «исчез». Однако, как химики, мы знаем
лучше. Закон
Закон сохранения материи утверждает, что сахар не может просто так исчезнуть, он
должно быть, ушел куда-то еще.
Это где-то еще находится в решении. Сахар стал равномерным
рассеянный. На самом деле сахар
молекулы настолько хорошо распределены, что мы больше не можем видеть ни одного сахара
кристаллы. Однако, если вы
попробовав воду, вы обнаружите, что она сладкая, что подтверждает присутствие
сахар в воде.
второстепенный компонент раствора называется растворенным веществом.
Это означает, что компоненты
решение настолько равномерно
распределены по всей смеси, что нет заметных различий в
сочинение. Решения могут
образуется при смешивании двух веществ, таких как сахар и вода. Если
ты насыпаешь пачку сахара
в стакан воды, изначально у вас взвесь в виде сахара
кристаллы плавают в стекле.
Когда вы будете перемешивать сахар и воду достаточно долго, вы
в итоге получить прозрачную бесцветную
смесь. Некоторых людей, особенно маленьких детей, можно обмануть таким
демонстрация в
думая, что сахар «исчез». Однако, как химики, мы знаем
лучше. Закон
Закон сохранения материи утверждает, что сахар не может просто так исчезнуть, он
должно быть, ушел куда-то еще.
Это где-то еще находится в решении. Сахар стал равномерным
рассеянный. На самом деле сахар
молекулы настолько хорошо распределены, что мы больше не можем видеть ни одного сахара
кристаллы. Однако, если вы
попробовав воду, вы обнаружите, что она сладкая, что подтверждает присутствие
сахар в воде.
второстепенный компонент раствора называется растворенным веществом. В настоящее время
например, сахар является растворенным веществом.
Основной компонент раствора называется растворителем. В этом
случае вода является растворителем.
В настоящее время
например, сахар является растворенным веществом.
Основной компонент раствора называется растворителем. В этом
случае вода является растворителем. Состав растворов
 Для количественного определения концентрации растворов химики
придумали много разных
единицы концентрации, каждая из которых полезна для разных целей.
Для количественного определения концентрации растворов химики
придумали много разных
единицы концентрации, каждая из которых полезна для разных целей.