Как приготовить раствор для штукатурки стен
Содержание
- Штукатурка – не дань традиции
- Какие составы штукатурки используют
- Самые популярные составы раствора для штукатурных работ
- Как работают со штукатурными растворами
- Подготовка стены к нанесению штукатурки своими руками
- Составы для штукатурки
- Штукатурная «шуба»
- Применение песчано-глиняного или известкового составов
- Проблемы глиняной штукатурки
- Заключение
Любое помещение, даже нежилое или используемое во вспомогательных или технологических целях, требует определенного рода штукатурки для внутренних и наружных поверхностей стен. Прежде всего, это единственный способ приготовить стену под покраску и одновременно исправить строительные дефекты стен, скрыть трещины или сделать поверхность более- менее ровной и приятной глазу. Можно даже своими руками.
Штукатурка – не дань традиции
При принятии решения о необходимости делать или не делать штукатурку стен примите во внимание, что при нынешнем изобилии разнообразных и красивых отделочных материалов народ продолжает штукатурить стены, и вовсе не из-за приверженности традициям:
- Штукатурка внутренних помещений — это микроклимат и комфортность пребывания в четырех стенах.
 Еще – здоровье легких и кожи. Стены, блоки, стяжки – все, что имеет в своем составе цемент, немилосердно «пылит», взвесь въедается в легкие и кожу, одежду, ткани и раздражает до аллергической реакции;
Еще – здоровье легких и кожи. Стены, блоки, стяжки – все, что имеет в своем составе цемент, немилосердно «пылит», взвесь въедается в легкие и кожу, одежду, ткани и раздражает до аллергической реакции; - Правильно приготовить штукатурку несложно, ее использование может сделать незаметными любые крены, пузыри и волны на вертикальной поверхности стены. С помощью гипсокартона можно добиться идеального выравнивания, но делать это ценой потери десятка сантиметров «живой» площади желающих находится немного;
- У штукатурки есть отменное качество – делать в помещении атмосферу постоянной влажности, лишний конденсат поглощается порами и при необходимости выдается обратно.
Совет! Сравните то, как легко дышится в оштукатуренной комнате при любой температуре, и состояние в помещении со стенами, покрытыми лаком или декоративным раствором.
Понятно, что все сказанное касается, прежде всего, классических составов штукатурки на основе песка, извести, глины и цементного раствора. Для наружных работ нужно приготовить составы штукатурки с диаметрально противоположными свойствами.
Для наружных работ нужно приготовить составы штукатурки с диаметрально противоположными свойствами.
Наружную штукатурку необходимо делать для защиты строительных блоков кладки и утепления стен здания. Зачастую внешний вид здания с правильно выполненными штукатурными работами выглядит не менее привлекательно, чем кладка из облицовочного кирпича. Сделать отделку раствором можно даже своими руками, а цена материала значительно дешевле облицовки.
Какие составы штукатурки используют
Универсального состава или раствора для штукатурки еще не придумали, и уже, наверное, не придумают. Слишком разные задачи преследуются при оштукатуривании стен. Чаще всего на все случаи жизни используется стандартный состав на основе цементного раствора, который мы можем приготовить своими руками. Не всегда такой раствор одинаково подходит для разных стен, но в условиях стройки и отделочных работ времени учиться и искать составы нет. Да и желания сделать по-другому и рисковать результатами тяжелой работы — тоже.
Но все-таки, стоит разобраться, как правильно подобрать состав штукатурки и приготовить штукатурный раствор своими руками.
Самые популярные составы раствора для штукатурных работ
Чаще всего используют три основных разновидности:- Цементно-песчаный раствор с добавками извести или глины;
- Песчано-глиняный состав с добавками полимерных компонентов;
- Известково-гипсовые ремонтные и отделочные штукатурки;
- Готовые промышленные смеси для всех случаев жизни.
Лучше купить качественный цемент 400-й или 500-й марки, мытый песок и пару добавок. По мере необходимости раствор можно делать своими руками, индивидуально подбирая необходимые пропорции штукатурного раствора.
Как работают со штукатурными растворами
Чем больше объем штукатурных работ, тем тщательнее необходимо готовить цементный раствор, тем сильнее он может отличаться по свойствам и способам применения в зависимости от использования тех или иных компонентов.
Подготовка стены к нанесению штукатурки своими руками
Стену под штукатурку, прежде всего, необходимо предварительно приготовить под нанесение раствора, вымыть в буквальном смысле слова, чем больше пыли, тем хуже сцепление.
Чистую и сухую бетонную или кирпичную стену рекомендуют приготовить с помощью набивки строительным молотком или перфоратором хаотичной сетки из рисок и черточек на поверхности, глубиной в 5-7 мм. Чем шершавее стена, тем лучше «цепляется» свежая масса штукатурки.
Большие трещины или сколы следует заделать заранее, не менее чем за сутки до начала основных работ. Моют щеткой и водным раствором клея, например, ПВА или Бустилата, уже перед самым началом оштукатуривания.
Составы для штукатурки
Штукатурную массу необходимо приготовить двух разных составов. Первый слой – это грунт, для наружных работ придется искать хорошие полимерные добавки, увеличивающие пластичность и прочность раствора, для внутренних работ часть песка можно заменить пушенкой — гашеной и перебитой в пастообразное состояние известью.
Набрасываемый на влажную, но не мокрую стену слой раствора должен свободно оставаться на поверхности при толщине 10-15 мм. Основная проблема – угадать с вязкостью раствора, нельзя сильно переувлажнять смесь, но и чересчур густой раствор схватится и потеряет пластичность быстрее, чем будет выровнен.
Для заполнения «провалов» в самых проблемных местах стены следует заранее подсчитать и приготовить необходимое количество раствора. Если толщина штукатурного слоя превышает 15-20 мм, на поверхности «кривого» участка натягивают сетку для вывешивания и армирования штукатурного слоя. Приготовить и натянуть армирующий материал необходимо заранее, после набивки массы сделать этого уже не удастся.
Совет! Для второго слоя необходимо приготовить раствор более жидкий и с большим содержанием песка.
Иногда раствор для второго слоя заменяют готовой финишной массой. Его состав позволяет получить идеально гладкую поверхность и приготовить сразу под обои или покраску.
Но при больших объемах штукатурных работ чаще поступают по-другому.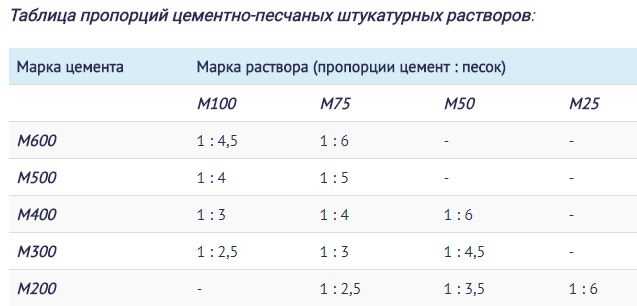 Готовый сухой песок для раствора рассеивают на сите с мелкой ячейкой, самую мелкую фракцию используют, чтобы приготовить раствор для отделки второго слоя штукатурки. Содержание песка выше, механическая прочность состава падает, при скольжении по слою выглаживающего инструмента могут появляться задиры и риски.
Готовый сухой песок для раствора рассеивают на сите с мелкой ячейкой, самую мелкую фракцию используют, чтобы приготовить раствор для отделки второго слоя штукатурки. Содержание песка выше, механическая прочность состава падает, при скольжении по слою выглаживающего инструмента могут появляться задиры и риски.
Для повышения вязкости и пластичности штукатурной массы можно приготовить клеевой раствор, и в ходе выглаживания поверхности штукатурки периодически обрабатывать им инструмент.
Штукатурная «шуба»
Зачастую фасады зданий, особенно в нижней части стен, требуют особой разновидности штукатурки, именуемой в народе, как «шуба». Причиной могут быть различные факторы, но чаще всего это близость к проезжей части улицы, как следствие, брызги и потоки грязной воды превращают прифундаментную часть здания в заляпанную и некрасивую часть постройки. На «шубе» этого ничего не видно. Иногда заказывают приготовить «шубу» на поверхности стен под укладку матов из минеральной или полиуретановой теплоизоляции.
Чтобы получить «шубу», необходимо приготовить вязкий и быстротвердеющий песчано-цементный состав. В классическом варианте основу под «шубу» могут приготовить из обычного грунта и набрызгать на него капли жидкого быстротвердеющего раствора. Скорость затвердевания увеличивают с помощью специальных минеральных добавок — ускорителей схватывания штукатурки. Для увеличения прочности могут добавлять рубленное асбестовое или короткое стекловолокно.
Применение песчано-глиняного или известкового составов
Глиняная или известковая штукатурка используется чаще всего в деревянных постройках. На даче или в летней кухне загородного дома это позволит избавиться от сырости и порчи деревянного каркаса здания. Глиняная штукатурка очень хорошо сохраняет микроклимат, обладает низкой теплопроводностью. Летом в таком помещении всегда прохладно.
Проблемы глиняной штукатурки
Приготовить глиняную массу несложно, намного сложнее выполнить ею облицовку стен. Из-за низкой прочности глины и длительного высыхания с усадочными процессами глиняную штукатурку стараются приготовить и использовать в максимально сжатые сроки.
При приготовлении для штукатурки выбирают жирную глину, мягкую воду, известь и песок, тщательно перемалывают и перебивают до получения однородного теста. Если взять комок в руку, правильно приготовленный раствор не будет стекать с ладони. Перед нанесением глины необходимо приготовить стену, практически всегда для глиняной штукатурки используют армирующую сетку или деревянную решетку.
Глиняная штукатурка не любит влажной атмосферы и перепадов температуры. Если в доме с такой штукатуркой не проживают более полугода, поверхностный слой может набухать от влаги и крошиться.
В старину глиняные стены и штукатурки стояли по нескольку десятков лет. Сегодня правильно приготовить штукатурку из глины помогают целлюлозные резанные полимерные волокна, добавки цемента и коагулянтов.
Совет! Если вы решились нанести на штукатурку из глины жидкие обои, для сушки и сохранения рисунка потребуется приготовить заранее и использовать с максимальной нагрузкой парочку специальных тепловых пропановых пушек.
Заключение
В штукатурных работах есть немало нюансов, позволяющих правильно приготовить и использовать раствор для штукатурки. Одно из правил гласит, какой раствор необходимо приготовить — в достаточном количестве для штукатурки одной поверхности в один слой. Попытки использовать старый или свежеприготовленный раствор неизбежно приведут к трещинам и отслоениям.
- Шумоизоляция стен своими руками
- Как облицевать стены своими руками
- Варианты обоев для кухни с фото
- Затирка швов керамической плитки
Как приготовить раствор для штукатурки
Время чтения 13 минут
Просмотры
443
Опубликовано
12. 09.2022
09.2022
Обновлено
06.04.2023
В этой статье:
- Виды растворов для штукатурки
- Состав растворов для штукатурки
- Приготовление цементного раствора для штукатурки
- Приготовление известкового раствора для штукатурки
- Состав растворов для штукатурки
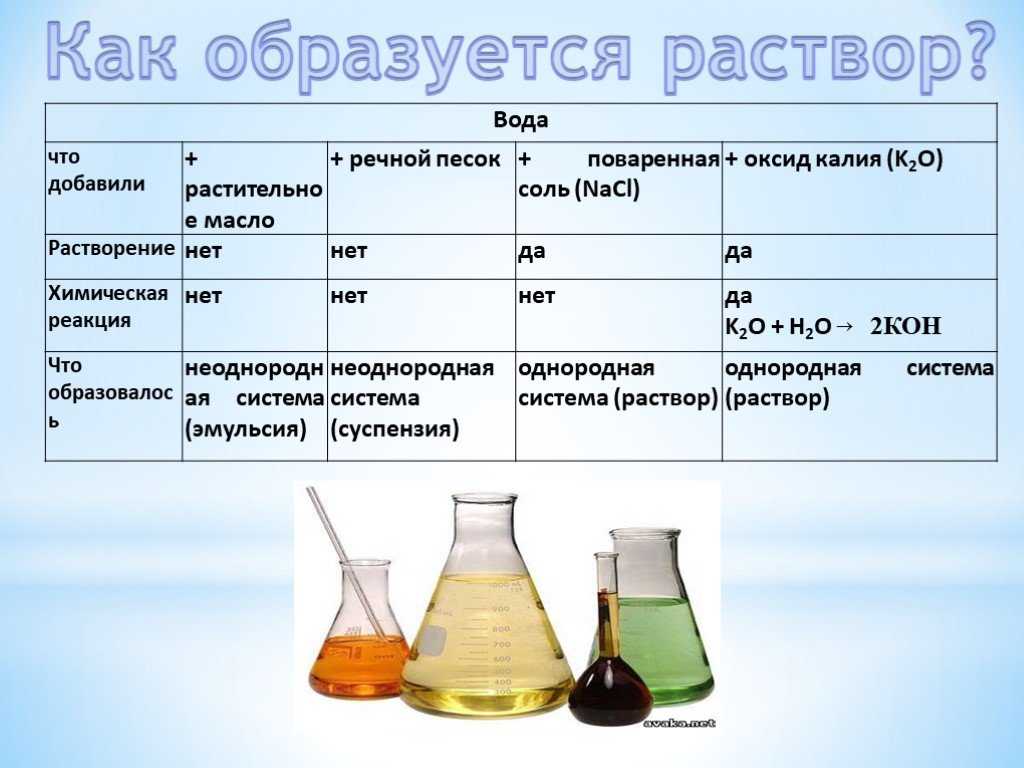
Отделка зданий и строений методом оштукатуривания остается востребованной, несмотря на множество альтернативных технологий, заменяющих этот классический подход. Штукатурка создает на поверхности стен или потолков здания отделочный слой, при помощи которого происходит окончательное выравнивание поверхности и может создаваться непосредственно декоративный штукатурный покров.
Существует несколько разновидностей смесей для создания подготовительных и отделочных слоев. В зависимости от климатических условий и мест использования, выбирают определенную технологию создания нужного раствора, который будет нанесен на внутренние или наружные элементы здания.
Виды растворов для штукатурки
Для каждой конкретной задачи требуется использовать необходимый раствор. Любая штукатурная смесь состоит из трех главных компонентов:
- связывающее вещество, которое обладает скрепляющими свойствами и хорошей адгезией к поверхности;
- наполнительные вещества, позволяющие увеличивать объем раствора и снимать внутренние напряжения между атомами связующего компонента;
- вода, при ее помощи происходит замачивание и смешивание компонентов.
В строительстве и отделочных работах применяют несколько видов растворов, в зависимости от требований. Основные виды штукатурных растворов:
- известковый раствор для штукатурки;
- цементный раствор для штукатурки;
- известково-цементный раствор для штукатурки;
- известково-гипсовая смесь для штукатурки;
- глинистые растворы для штукатурки с различными добавочными веществами.
Перед тем как начать приготовление раствора, требуется убедиться в том, что именно эта смесь подходит для выполнения работ. Для этого необходимо учитывать физико-химические свойства каждой смеси и будущие места ее использования, так как неверный выбор компонентного состава может повлечь за собой потерю качества выполненных отделочных работ.
Для этого необходимо учитывать физико-химические свойства каждой смеси и будущие места ее использования, так как неверный выбор компонентного состава может повлечь за собой потерю качества выполненных отделочных работ.
Состав растворов для штукатурки
Каждый штукатурный раствор имеет в своем составе компоненты, которые смешивается в различных объемных долях.
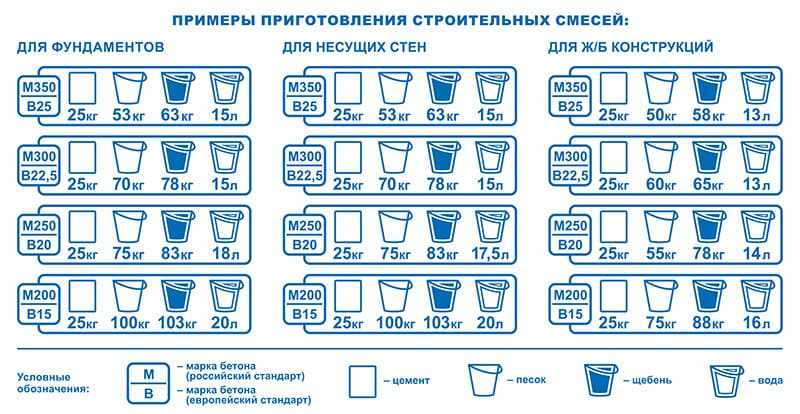
Известковый раствор для штукатурки: состав и пропорции. Состав известкового штукатурного раствора состоит из смеси гашеной извести, песка, которая замачивается в воде. Соотношение объемных долей у этой смеси составляет 1: 2(5). Является наиболее популярной смесью для внутренних работ.
Цементный раствор для штукатурки: состав и пропорции.
Цементно-известковая смесь для штукатурки. Состав цементно-известкового раствора для штукатурки состоит из цемента и песка, смешанных в соотношении 1: 3(4) и добавленной известковой суспензии. Суспензия подразумевает собой гашеную известь, которая разбавлена водой до консистенции молока.
Суспензия подразумевает собой гашеную известь, которая разбавлена водой до консистенции молока.
Известково-гипсовая смесь для штукатурки состоит из обычного раствора извести с песком и добавленного гипса. Объемные доли готовой известковой смеси и гипса составляют 1: 0.3.
Читайте также!
Утепление стен изнутри минватой плюс гипсокартон
Глинистые растворы для штукатурки могут быть с добавками песка, цемента, извести или гипса, в зависимости от будущего применения. Примерные соотношения компонентов в глинистых смесях представлены здесь:
- смесь глины и песка — 1:2(5), в зависимости вязкости глины;
- смесь глины, извести и песка — 1:0.4:4 соответственно;
- смесь глины, цемента и песка — 1:0.3:4.
Для получения раствора, компоненты смешивают в воде, ее объем зависит от требуемой вязкости.
Приготовление цементного раствора для штукатурки
Цементный раствор для оштукатуривания поверхностей, предусматривает использование в наружных условиях и помещениях с повышенной влажностью. Тем не менее, он может применяться и при внутренних отделочных работах. Цементные штукатурные смеси дороже известковых, для этого целесообразно их применение в тех местах, где это оправдано физическими свойствами такой штукатурки.
Тем не менее, он может применяться и при внутренних отделочных работах. Цементные штукатурные смеси дороже известковых, для этого целесообразно их применение в тех местах, где это оправдано физическими свойствами такой штукатурки.
Для приготовления качественного раствора смешивают цемент и песок в нужной пропорции, обычно 1: 3(4). Важно при этом учитывать марку цемента. Для высоких марок, объем песка можно увеличить, но при этом нужно учитывать адгезию к поверхности и будущие прочностные характеристики. Адгезия цементной штукатурки имеет высокие показатели к кирпичным и шлакоблочным поверхностям, при нанесении раствора на гладкие железобетонные покрытия — сцепляющие свойства уменьшаются, в этих случаях объем песка не должен превышать трех объемных долей.
Песок и цемент смешивают в корыте или бетономешалке, до образования однородности. Затем добавляется небольшими порциями вода. Консистенцию доводят до нужно значения эмпирическим путем. На расположенный плашмя кирпич наносят готовый раствор и переворачивают его на торец (тычок). Если в течение 3–4 минут не произойдет сползание затворенной смеси, то объемные доли в штукатурном растворе выдержаны. При этом нужно учитывать, что скорость сдвига раствора зависит от объемной доли воды и от объемной доли цемента.
Если в течение 3–4 минут не произойдет сползание затворенной смеси, то объемные доли в штукатурном растворе выдержаны. При этом нужно учитывать, что скорость сдвига раствора зависит от объемной доли воды и от объемной доли цемента.
Процесс смешивания можно производить при помощи дрели и миксерной насадки, это повышает качество смешивания и сокращает время приготовления штукатурки.
Приготовление известкового раствора для штукатурки
Как приготовить известковый раствор? Для получения качественной штукатурной смеси на основе извести важно использовать качественный исходный материал. Если используется кусковая негашеная известь, то ее следует погасить, соблюдая технологию и выдержать известковое тесто не менее 24 часов.
Гашеную известь разводят до нужной консистенции водой, объемная доля песка выбирается согласно вязкости известкового теста. После размешивания проверяется вязкость и адгезия, аналогично проверке цементной штукатурки.
Количество песка определяется и толщиной будущего слоя. Для создания больших выравнивающих толщин, количество песка увеличивают, но не превышают максимальную объемную долю. Для тонких слоев целесообразно применять обедненный песком пластичный известковый раствор.
Размешивание смеси проводится и вручную и при помощи миксера. Отсутствие в исходном сырье непогашенных частиц CaO и MgO определяет качество и пластичность готового раствора, так как оставшиеся частицы негашеной извести впоследствии вступят в реакцию с водяными парами, содержащимися в воздухе, что приведет к порче штукатурного покрытия. Песок для смеси должен быть мелкофракционный и просеянный.
Если требуется приготовить немного раствора для выполнения ремонтных работ, то можно использовать известково-гипсовый раствор, который имеет короткий срок затвердевания. Объемная доля гипса выбирается исходя из нужной быстроты затвердевания, и обычно составляет 1:4, где 4 это доля песка, добавленная в известковое тесто.
Растворы для штукатурки откосов, потолка, печей и стен
Исходя из особенностей помещения, климатических условий и места будущего нанесения смеси отдают предпочтение какому-либо раствору.
Читайте также!
Кожухотрубчатый теплообменник: чертеж, расчет
Для оштукатуривания внутренних помещений (стен и потолков) отдается предпочтение известковым растворам или известково-гипсовым (уменьшается теплопроводность). Стены имеют возможность регулировать микроклимат в комнате, путем поглощения или выделения влаги в узких пределах.
Цементно-песчаные растворы больше подходят для наружных стен или слишком влажных помещений. В случае ветхости стен, цементная штукатурка позволяет их скрепить. Подобные штукатурки применяют для отделки гаражей, каменных заборов.
Оконные откосы желательно штукатурить известковым составом, это позволит дополнительно их утеплить, так как теплопроводность смеси на основе извести с песком имеют коэффициент теплопроводности 0. 86–0.87, а цементно-песчаная смесь — 1.3.
86–0.87, а цементно-песчаная смесь — 1.3.
Для отделки печей, каминов, груб используют глинистые растворы и смеси. Так, пространство около печи штукатурят смесью глины и песка, а тепловые поверхности грубы можно штукатурить глинисто-известковым раствором.
В заключении можно выделить следующие особенности:
- при штукатурке стен известковым раствором, они теплее и меньше подвержены грибковым разрастаниям;
- штукатурка цементным раствором более прочная и не боится влаги;
- добавление гипса в известковый состав увеличивает экологическо-физические показатели, но сокращает время использования раствора, что приводит к трудоемкости нанесения покрытия;
- глинистые составы имеют низкую прочность, но обладают отменной жаростойкостью.
На основании изложенных аспектов, при планировании отделки стен, потолков, откосов или других поверхностей, учитывают приоритетные свойства каждых штукатурных растворов для создания качественного и долговременного покрытия.
Хотите качественный гараж, который будет служить вам долгие годы?
- Мы уже более 10 лет занимаемся строительством гаражей, и за это время смогли завоевать доверие многих клиентов. Мы гарантируем сроки строительства по договору, поэтому вы можете быть уверены, что ваш гараж будет готов вовремя.
- У нас работают опытные мастера со средним стажем 5 лет, которые знают все тонкости строительства гаражей. Мы также предоставляем бесплатный выезд инженера, который поможет вам определиться с выбором материалов и конструкции.
- Мы строим здания, учитывая ваши пожелания. Мы готовы предложить вам различные варианты дизайна и конструкции гаража, чтобы он соответствовал вашим требованиям и пожеланиям.
Если вы хотите заказать гараж, переходите по ссылкеили звоните нам: +7 (800) 511-04-38. Мы с удовольствием ответим на все ваши вопросы и поможем вам выбрать оптимальный вариант.
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.

В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 5 2 2 900 разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде.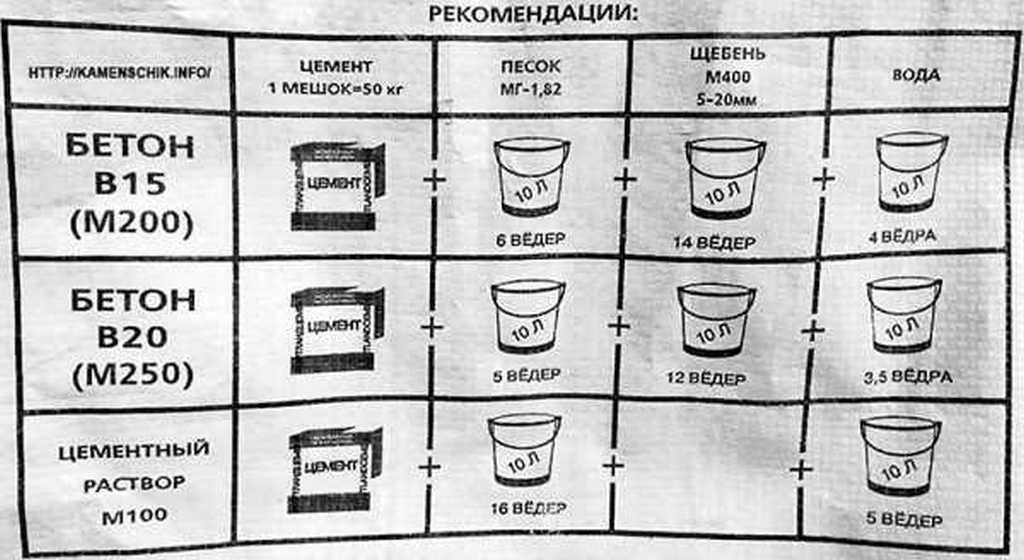 Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора0053 s ) измеряется в маточном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в нем. умножение объема раствора на его молярность.
умножение объема раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 дает раствор, содержащий 1 05 O 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
полученные из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора. 9- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. — (водн.) \)
— (водн.) \)
B One formula unit of In(NO 3 ) 3 produces one In 3 + ion and three NO 3 − ions, so a 0.032 M In(NO 3 ) 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 — — это, [в 3 + ] = 0,0323 M.0323. − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН — ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М Уравнение 12.
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств указаны инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.is?
- да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги

 1.2:
1.2:Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Глава 12. 1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
Приготовление химических растворов
Лабораторные эксперименты и исследования часто требуют приготовления химических растворов. Мы рассмотрим приготовление этих химических растворов по весу (масса/объем) и по объему (объем/объем). В приведенном ниже глоссарии приводятся определения, чтобы знать, когда ваша работа требует их создания, а также наиболее точные молярные растворы.
К этому мы добавляем информацию, предназначенную для понимания того, как использовать шкалу рН при измерении кислотности или щелочности раствора.
Глоссарий, основные термины для понимания…
Растворенное вещество — Вещество, которое растворяется в растворе
Растворитель — Вещество, которое растворяет другое с образованием раствора. Например, в растворе сахара и воды вода является растворителем; сахар является растворенным веществом.
Раствор — Смесь двух или более чистых веществ. В растворе одно чистое вещество растворено в другом чистом веществе гомогенно. Например, в растворе сахара и воды раствор имеет одинаковую концентрацию повсюду, т.е. оно однородно.
В растворе одно чистое вещество растворено в другом чистом веществе гомогенно. Например, в растворе сахара и воды раствор имеет одинаковую концентрацию повсюду, т.е. оно однородно.
Моль — Фундаментальная единица массы (например, «дюжина» для пекаря), используемая химиками. Этим термином обозначают большое количество элементарных частиц (атомов, молекул, ионов, электронов и т. д.) любого вещества. 1 моль равен 6,02 х 10 23 молекул этого вещества. (номер Авогадро).М
Введение в приготовление растворов.
Многие эксперименты с химическими веществами требуют их использования в виде растворов. То есть два или более вещества смешиваются вместе в известных количествах. Это может включать взвешивание точного количества сухого материала или измерение точного количества жидкости. Точная подготовка растворов повысит безопасность эксперимента и шансы на успех.
Решение 1: использование весовых процентов (вес/объем)
Формула
Формула весовых процентов (вес/объем): [масса растворенного вещества (г) / объем раствора (мл)] x 100
Пример
10% раствор NaCl содержит десять граммов хлорида натрия, растворенных в 100 мл раствора.
Процедура
Взвесить 10 г хлорида натрия. Перелейте его в мерный цилиндр или мерную колбу, содержащую примерно 80 мл воды. После полного растворения хлорида натрия (при необходимости осторожно встряхните колбу) добавьте воды, чтобы довести объем до окончательных 100 мл. Внимание: не просто измеряйте 100 мл воды и добавить 10 г хлорида натрия. Это приведет к ошибке, потому что добавление твердого вещества изменит конечный объем раствора и отбросит окончательный процент.
Решение 2: Использование объемных процентов (об./об.)
Когда растворенное вещество является жидкостью, иногда удобно выражать концентрацию раствора в объемных процентах.
Формула
Формула для объемных процентов (об./об.): [Объем растворенного вещества (мл) / Объем раствора (мл)] x 100
Пример
Приготовьте 1000 мл 5% по объему раствора этиленгликоля в воде.
Процедура
Сначала выразите процент растворенного вещества в виде десятичной дроби: 5% = 0,05
Умножьте эту десятичную дробь на общий объем: 0,05 x 1000 мл = 50 мл (необходим этиленгликоль).
Вычтите объем растворенного вещества (этиленгликоль) из общего объема раствора:
1000 мл (общий объем раствора) — 50 мл (объем этиленгликоля) = 950 мл (необходимая вода)
Растворите 50 мл этиленгликоля в чуть меньшем количестве 950 мл воды. Теперь доведите окончательный объем раствора до 1000 мл , добавив еще воды. (Это исключает любую ошибку, поскольку конечный объем раствора может не совпадать с рассчитанной суммой отдельных компонентов).
Итак, 50 мл этиленгликоля / 1000 мл раствора x100 = 5% (об./об.) раствора этиленгликоля.
Раствор 3: Молярные растворы
Молярные растворы наиболее полезны при расчетах химических реакций, поскольку они напрямую связывают количество молей растворенного вещества с объемом раствора.
Формула
Формула молярности (М): количество молей растворенного вещества на 1 л раствора или грамм-молекулярная масса растворенного вещества на 1 л раствора.
 Еще – здоровье легких и кожи. Стены, блоки, стяжки – все, что имеет в своем составе цемент, немилосердно «пылит», взвесь въедается в легкие и кожу, одежду, ткани и раздражает до аллергической реакции;
Еще – здоровье легких и кожи. Стены, блоки, стяжки – все, что имеет в своем составе цемент, немилосердно «пылит», взвесь въедается в легкие и кожу, одежду, ткани и раздражает до аллергической реакции;