Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли.
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г.
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание.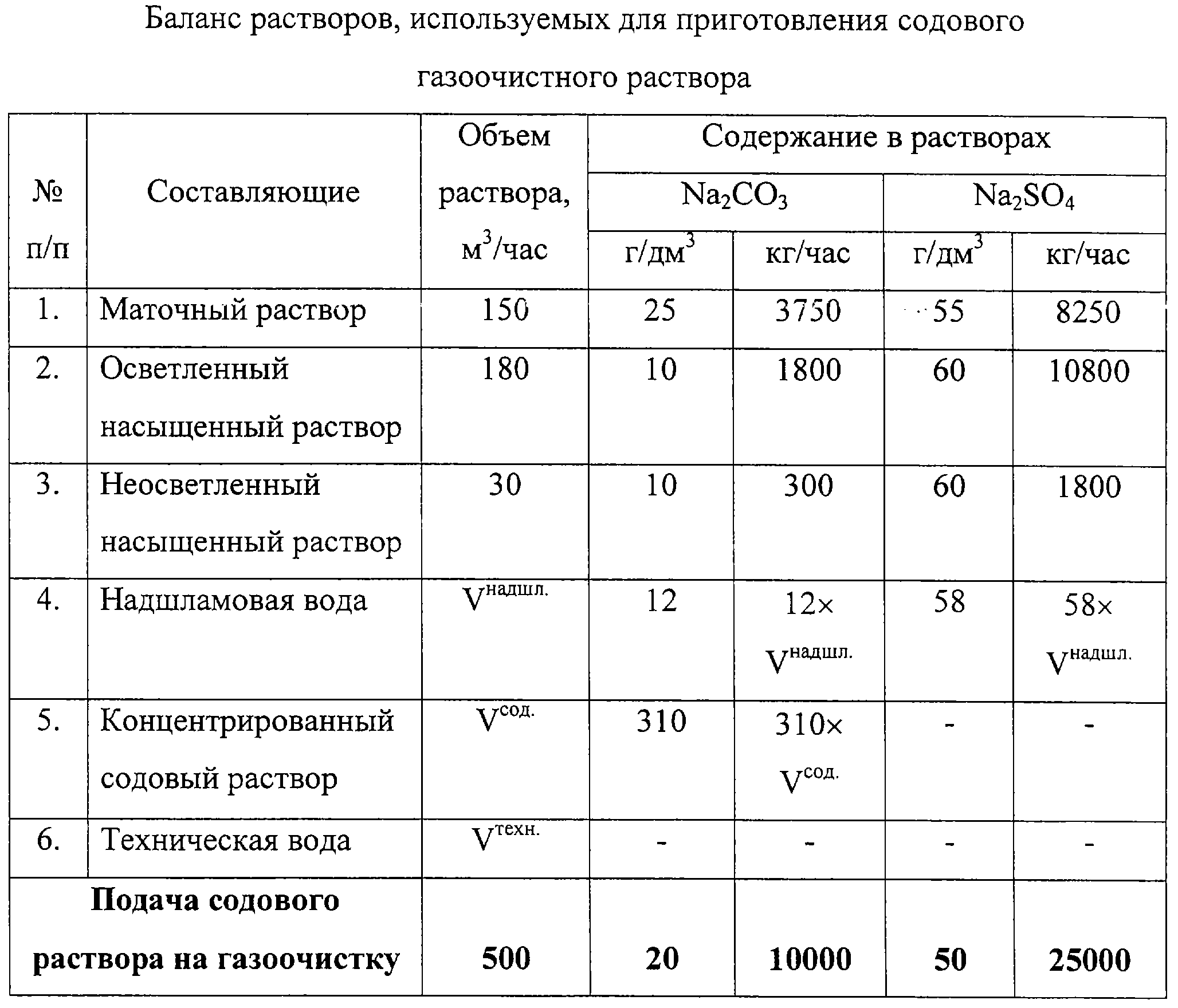
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы.

Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 • 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5h3O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:
На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
К оглавлению
см. также
также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
«Как приготовить 20 процентный раствор?» — Яндекс Кью
ПопулярноеСообществаХимияУчеба
Анонимный вопрос ·157,7 KОтветитьУточнитьМария СтепановаТуризм
1,1 KУвлекаюсь всем на свете: от моды до путешествий. Работаю помощником главного редактора… · 29 мар 2019 · dzen.ru/baba_mana
Работаю помощником главного редактора… · 29 мар 2019 · dzen.ru/baba_mana
Двадцати процентный раствор готовится в соотношении 20/80.
Обычно, в качестве растворителя используется вода. Таким образом, получается, что на 20% исходного вещества нужно взять 80% воды. Рассмотрим на примере уксуса.
20% раствор получим взяв 20 мл уксуса и разбавим 80 мл воды.
65,4 KАлексей Лукин
2 апреля 2019Не совсем удачный пример, т.к. уксус — это уже водный раствор уксусной кислоты (обычно 3 — 15%), т.е. уже… Читать дальше
Комментировать ответ…Комментировать…Интернет-магазин полезных продуктов Halefoods.ru731Только умное системное полезное питание | Продукты для долгой полноценной здоровой… · 21 нояб 2020 · halefoods.ru
ОтвечаетСергей Валериевич СавинковПроцентная концентрация показывает, сколько граммов растворенного вещества содержится в 100 граммах раствора.
То есть, если нужен, например, 5%-ный раствор хлорида натрия, то это значит, что в 100 г раствора должно содержаться 5 граммов хлорида натрия и соответственно 95 граммов воды. Вам нужно — 20 г вашего вещества и 80 г воды (или 80 мл воды, т.к. её плотность равна 1)
Вам нужно — 20 г вашего вещества и 80 г воды (или 80 мл воды, т.к. её плотность равна 1)
Программист, АйТишник со стажем. · 2 апр 2019
Если нужно приготовить 20% раствор твердого вещества, например соли: Из курса химии: Процентная концентрация вещества – это отношение массы растворенного вещества к общей массе раствора. Поэтому, правильнее все взвешивать, т.к. чтобы узнать массу какого-то объема жидкости, нужно знать плотность этой жидкости при данной температуре. Приравнять объем к массе можно только… Читать далее
33,7 KКомментировать ответ…Комментировать…Кибика247Привет! Я КИБИКА — сайт обо всём самом-самом на планете Земля. Например самая маленькая… · 6 авг 2020 · kibika.com
ОтвечаетАлександр ЛазаковичДобавить четыре весовые части разбавителя. Исходное вещество при этом будет составлять пятую часть в растворе, что и составляет двадцать процентов.
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос13.7: Разбавление раствора — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47557
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Цели обучения
- Объяснить, как можно изменить концентрацию в лаборатории.
- Понимать, как в лаборатории используются стандартные растворы.
Нас часто интересует, сколько растворенного вещества растворено в заданном количестве раствора. Мы начнем обсуждение концентрации раствора с двух родственных и относительных терминов: разбавленный и концентрированный .
Мы начнем обсуждение концентрации раствора с двух родственных и относительных терминов: разбавленный и концентрированный .
- Разбавленный раствор — это раствор, в котором растворено относительно небольшое количество растворенного вещества.
- Концентрированный раствор содержит относительно большое количество растворенного вещества.
Эти два термина не предоставляют никакой количественной информации (фактических чисел), но они часто полезны для сравнения решений в более общем смысле. Эти термины также не говорят нам, является ли раствор насыщенным или ненасыщенным, является ли раствор «сильным» или «слабым». Эти два последних термина будут иметь особое значение, когда мы будем обсуждать кислоты и основания, поэтому будьте осторожны, чтобы не перепутать их.
Стандартные растворы
Часто необходимо иметь раствор с очень точно известной концентрацией. Растворы, содержащие точную массу растворенного вещества в точном объеме раствора, называются маточными (или стандартными) растворами . Для приготовления стандартного раствора следует использовать такое лабораторное оборудование, как мерная колба. Эти колбы имеют объем от 10 мл до 2000 мл и тщательно откалиброваны до единого объема. На узком стержне имеется калибровочная метка 9.0041 . Точную массу растворенного вещества растворяют в небольшом количестве растворителя и добавляют в колбу. Затем в колбу добавляют достаточное количество растворителя, пока уровень не достигнет калибровочной отметки.
Для приготовления стандартного раствора следует использовать такое лабораторное оборудование, как мерная колба. Эти колбы имеют объем от 10 мл до 2000 мл и тщательно откалиброваны до единого объема. На узком стержне имеется калибровочная метка 9.0041 . Точную массу растворенного вещества растворяют в небольшом количестве растворителя и добавляют в колбу. Затем в колбу добавляют достаточное количество растворителя, пока уровень не достигнет калибровочной отметки.
Часто бывает удобно приготовить серию растворов известных концентраций, сначала приготовив один исходный раствор , как описано в предыдущем разделе. Аликвоты (тщательно измеренные объемы) исходного раствора можно затем разбавить до любого желаемого объема. В других случаях может быть неудобно достаточно точно взвешивать небольшую массу образца для приготовления небольшого объема разбавленного раствора. Каждая из этих ситуаций требует разбавления раствора для получения желаемой концентрации.
Разведения стандартных (или стандартных) растворов
Представьте, что у нас есть раствор соленой воды определенной концентрации. Это означает, что у нас есть определенное количество соли (определенная масса или определенное количество молей), растворенное в определенном объеме раствора. Далее мы разбавим этот раствор. Для этого нужно добавить больше воды, а не соли:
\(\rightarrow\)
Перед разбавлением и после разбавления
Молярность раствора 1 равна
\[ M_1 = \dfrac{\text{моли}_1}{\text{литр}_1} \nonumber \]
, а молярность раствора 2 равна
\[ M_2 = \dfrac{\text{моли}_2 }{\text{литр}_2} \nonumber \]
переставьте уравнения, чтобы найти родинки:
\[ \text{moles}_1 = M_1 \text{liter}_1 \nonumber \]
и
\ [ \text{моль}_2 = M_2 \text{литр}_2 \nonumber \]
Что осталось прежним, а что изменилось между двумя решениями? Добавляя больше воды, мы изменяли объем раствора. Это также изменило его концентрацию. Однако количество молей растворенного вещества не изменилось. Итак,
Однако количество молей растворенного вещества не изменилось. Итак,
\[moles_1 = moles_2 \nonnumber \]
Следовательно
\[ \boxed{M_1V_1= M_2V_2 } \label{diluteEq} \]
где
- 90 003 \(M_1\) и \(M_2 \) — концентрации исходного и разбавленного растворов
- \(V_1\) и \(V_2\) — объемы двух растворов
Приготовление разбавлений — обычное дело в химической лаборатории и в других местах. Как только вы поймете приведенную выше взаимосвязь, расчеты станут простыми.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \dfrac{M_1 \times V_1}{V_2} = \dfrac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl} \nonumber \]
Раствор разбавлен на одну пятую, так как новый объем в пять раз превышает исходный. оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения.
оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения.
Еще одна распространенная проблема с разбавлением заключается в расчете количества высококонцентрированного раствора, необходимого для получения желаемого количества раствора меньшей концентрации. Высококонцентрированный раствор обычно называют исходным раствором.
Пример \(\PageIndex{1}\): Разбавление азотной кислоты
Азотная кислота \(\left( \ce{HNO_3} \right)\) является сильной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение
| Действия по устранению неполадок | |
|---|---|
Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: M 1 , Запас \(\ce{HNO_3} = 16 \: \text{M}\) \(V_2 = 8.00 \: \text{L}\) \(М_2 = 0,50 \: \текст{М}\) Найти: Объем запаса \(\ce{HNO_3} \left( V_1 \right) = ? \: \text{L}\) |
| Перечислите другие известные количества. | нет |
| Спланируйте задачу. | Сначала перестройте уравнение алгебраически, чтобы найти \(V_1\). \[V_1 = \dfrac{M_2 \times V_2}{M_1} \номер\] |
| Расчет и отмена единиц измерения. | Теперь подставьте известные величины в уравнение и решите. \[V_1 = \dfrac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M}} = 0,25 \: \text{L}\] |
Подумайте о своем результате. | \( 0,25 \: \text{L} \: (250 \: \text{мл})\) исходного раствора \(\ce{HNO_3}\) необходимо разбавить водой до конечного объема \( 8.00 \: \text{L}\). Разведение производится в 32 раза, чтобы перейти от \(16 \: \text{M}\) до \(0,5 \: \text{M}\). |
Упражнение \(\PageIndex{1}\)
К 0,885 М раствору KBr с начальным объемом 76,5 мл добавляют воду до тех пор, пока его концентрация не станет 0,500 М. Каков новый объем раствора?
Ответ
135,4 мл
Обратите внимание, что расчетный объем будет иметь те же размеры, что и входной объем, и анализ размерностей говорит нам, что в этом случае нам не нужно преобразовывать в литры, так как L сокращается при делении М (моль/л) на М (моль/л).
Растворы для разбавления и смешивания
| Как развести раствор от CarolinaBiological |
|---|
Эта страница под названием 13. 7: Solution Dilution распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
7: Solution Dilution распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Стиль цитирования
- Гарвард
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- разбавление
2.5: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 127138
- Дэвид Харви
- Университет ДеПау
Приготовление раствора известной концентрации, пожалуй, самое распространенное занятие в любой аналитической лаборатории. Метод измерения растворенного вещества и растворителя зависит от желаемой концентрации и от того, насколько точно необходимо знать концентрацию раствора. Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированные цилиндры, мензурки и/или бутыли с реагентами достаточны, когда концентрация должна быть только приблизительной. В этом разделе описаны два метода приготовления растворов.
Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированные цилиндры, мензурки и/или бутыли с реагентами достаточны, когда концентрация должна быть только приблизительной. В этом разделе описаны два метода приготовления растворов.
Приготовление исходных растворов
Исходный раствор готовят путем взвешивания соответствующей порции чистого твердого вещества или путем отмеривания соответствующего объема чистой жидкости, помещения его в подходящую колбу и разбавления до известного объема. . То, как именно измеряется реагент, зависит от желаемой единицы концентрации. Например, для приготовления раствора с известной молярностью отвешивают соответствующую массу реагента, растворяют его в порции растворителя и доводят до нужного объема. Чтобы приготовить раствор, в котором концентрация растворенного вещества является объемным процентом, вы отмеряете соответствующий объем растворенного вещества и добавляете достаточное количество растворителя, чтобы получить желаемый общий объем.
Пример 2.5.1
Опишите, как приготовить следующие три раствора: (a) 500 мл примерно 0,20 М NaOH с использованием твердого NaOH; (b) 1 л 150,0 ppm Cu 2 + с использованием металлической меди; и (c) 2 л 4% по объему уксусной кислоты с использованием концентрированной ледяной уксусной кислоты (99,8% по весу уксусной кислоты).
Раствор
(a) Поскольку желаемая концентрация известна с точностью до двух значащих цифр, нам не нужно точно измерять массу NaOH или объем раствора. Желаемая масса NaOH равна
\[\frac {0,20 \text{ моль NaOH}} {\text{L}} \times \frac {40,0 \text{г NaOH}} {\text{моль NaOH}} \times 0,50 \text{L} = 4,0 \text{ г NaOH} \номер\]
Для приготовления раствора поместите 4,0 грамма NaOH, взвешенных с точностью до десятых долей грамма, в бутыль или химический стакан и добавьте примерно 500 мл воды.
(b) Поскольку искомая концентрация Cu 2 + задается четырьмя значащими цифрами, мы должны точно измерить массу металлической Cu и объем конечного раствора. Желаемая масса металлической меди
Желаемая масса металлической меди
\[\frac {150,0 \text{мг Cu}} {\text{L}} \times 1,000 \text{ M } \times \frac {1 \text{г}} {1000 \text{мг}} = 0,1500 \text{г Cu} \номер\]
Для приготовления раствора отмерьте точно 0,1500 г меди в небольшой химический стакан и растворите его, используя небольшую порцию концентрированной HNO 3 . Для обеспечения полного переноса Cu 2 + из стакана в мерную колбу — то, что мы называем количественным переносом — несколько раз промыть химический стакан небольшими порциями воды, добавляя при каждой промывке мерную колбу. . Наконец, добавьте еще воды до калибровочной отметки на мерной колбе.
(c) Концентрация этого раствора является приблизительной, поэтому нет необходимости точно измерять объемы, а также нет необходимости учитывать тот факт, что ледяная уксусная кислота представляет собой чуть менее 100% уксусной кислоты по весу (это приблизительно 99,8% вес./вес.). Необходимый объем ледяной уксусной кислоты
Необходимый объем ледяной уксусной кислоты
\[\frac {4 \text{ мл } \ce{Ch4COOH}} {100 \text{ мл}} \times 2000 \text{ мл} = 80 \text{ мл } \ce{Ch4COOH} \nonumber\]
Чтобы приготовить раствор, используйте градуированный цилиндр, чтобы перенести 80 мл ледяной уксусной кислоты в контейнер, вмещающий приблизительно 2 л, и добавить достаточное количество воды, чтобы довести раствор до желаемого объема.
Упражнение 2.5.1
Предоставьте инструкции по приготовлению 500 мл 0,1250 М KBrO 3 .
- Ответить
Приготовление 500 мл 0,1250 М KBrO 3 требуется
\[0,5000 \text{ L} \times \frac {0,1250 \text{ моль } \ce{KBrO3}} {\text{L}} \times \frac {167,00 \text{ г } \ce{KBrO3}} {\text{моль} \ce{KBrO3}} = 10,44 \text{г} \ce{KBrO3} \номер\]
Поскольку концентрация имеет четыре значащих цифры, мы должны приготовить раствор, используя мерную посуду. Поместите 10,44 г образца KBrO 3 в мерную колбу вместимостью 500 мл и частично заполнить водой.
 Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Приготовление растворов путем разбавления
Растворы часто готовят путем разбавления более концентрированного маточного раствора. Известный объем маточного раствора переносят в новую емкость и доводят до нового объема. Поскольку общее количество растворенного вещества до и после разбавления одинаково, мы знаем, что
\[C_o \times V_o = C_d \times V_d \label{2.1}\]
где \(C_o\) — концентрация исходного раствора, \(V_o\) — объем разбавляемого исходного раствора, \( C_d\) — концентрация разбавленного раствора, а \(V_d\) — объем разбавленного раствора. Опять же, тип стеклянной посуды, используемой для измерения \(V_o\) и \(V_d\), зависит от того, насколько точно нам нужно знать концентрацию раствора.
Обратите внимание, что уравнение \ref{2.1} применяется только к тем единицам концентрации, которые выражены в терминах объема раствора, включая молярность, формальность, нормальность, объемные проценты и весовые проценты по объему. Это также относится к массовым процентам, частям на миллион и частям на миллиард, если плотность раствора составляет 1,00 г/мл. Мы не можем использовать уравнение \ref{2.1}, если мы выражаем концентрацию с точки зрения моляльности, так как это основано на массе растворителя, а не на объеме раствора. См. Родрикес-Лопес, М.; Карраскильо, А. J. Chem. Образовательный 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Это также относится к массовым процентам, частям на миллион и частям на миллиард, если плотность раствора составляет 1,00 г/мл. Мы не можем использовать уравнение \ref{2.1}, если мы выражаем концентрацию с точки зрения моляльности, так как это основано на массе растворителя, а не на объеме раствора. См. Родрикес-Лопес, М.; Карраскильо, А. J. Chem. Образовательный 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Пример 2.5.2
Лабораторная процедура требует 250 мл примерно 0,10 М раствора NH 3 . Опишите, как вы приготовите этот раствор, используя исходный раствор концентрированного NH 3 (14,8 М).
Раствор
Подстановка известных объемов в уравнение \ref{2.1}
\[14,8 \text{ M} \times V_o = 0,10 \text{ M} \times 250 \text{ мл} \nonumber\]
и решение для \(V_o\) дает 1,7 мл. Поскольку мы готовим раствор с концентрацией приблизительно 0,10 М NH 3 , мы можем использовать градуированный цилиндр для измерения 1,7 мл концентрированного NH 3 , перенести NH 3 в химический стакан и добавить достаточное количество воды, чтобы получить общий объем около 250 мл.
Хотя обычно мы выражаем молярность как моль/л, мы можем выразить объемы в мл, если сделаем это как для \(V_o\) , так и для \(V_d\).
Упражнение 2.5.2
Для приготовления стандартного раствора Zn 2 + образец цинковой проволоки массой 1,004 г растворяют в минимальном количестве HCl и доводят до нужного объема в мерной колбе вместимостью 500 мл. Если вы разбавите 2000 мл этого исходного раствора до 250,0 мл, какова будет концентрация Zn 2 + в мкг/мл в вашем стандартном растворе?
- Ответить
Первый раствор представляет собой маточный раствор, который мы затем разбавляем для приготовления стандартного раствора. Концентрация Zn 9{2+}}} {\text{мл}} \times 2,000 \text{мл} = C_d \times 250,0 \text{мл} \nonumber\]
, где C d — концентрация стандартного раствора. Решение дает концентрацию 16,06 мкг Zn 2 + /мл.

Как показано в следующем примере, мы можем использовать уравнение \ref{2.1} для расчета исходной концентрации раствора, используя его известную концентрацию после разбавления.
Пример 2.5.3
Образец руды анализировали на Cu 2 + следующим образом. Навеску руды массой 1,25 г растворяли в кислоте и доводили до нужного объема в мерной колбе вместимостью 250 мл. 20 мл полученного раствора пипеткой переносили в мерную колбу вместимостью 50 мл и доводили до метки. Анализ этого раствора дает концентрацию Cu 2 + 4,62 мкг/мл. Какова массовая доля меди в исходной руде?
Решение 9{2+}} \номер\]
Эта страница под названием 2.5: Preparing Solutions распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором этой страницы является Дэвид Харви.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Дэвид Харви
- Тип страницы
- Аналитическая химия
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
