Поташ — это… Формула и применение поташа
Поташ — это… Формула и применение поташа
Калий — неофициальное название вещества, которое химики называют карбонатом калия. Эта соль была известна людям с древних времен, поскольку она содержится в золе. Раньше этим словом называли именно сухой остаток после испарения раствора продуктов сгорания растений. Итак, что сейчас известно о калии?
Содержание
- 1 Формула
- 2 История открытия и изучения
- 3 Химические и физические свойства
- 4 Разновидности и формы
- 5 Добыча
- 6 Обработка
- 7 Использование
- 8 Другие особенности
Формула
Другое название этого вещества — карбонат калия. И его химическая формула записывается так: K2CO3. Это средняя соль калия и угольной кислоты. Это означает, что раствор калия не является кислым или основным, он нейтрален. Его долгое время путали с бикарбонатом натрия — NaHCO3.
Это средняя соль калия и угольной кислоты. Это означает, что раствор калия не является кислым или основным, он нейтрален. Его долгое время путали с бикарбонатом натрия — NaHCO3.
История открытия и изучения
Конечно, мы не знаем наверняка, кто первым получил калий, потому что он был известен еще в Древней Греции и Риме. Затем его отделили от золы и использовали для промывки. Любопытно, что его долгое время путали с другим веществом — бикарбонатом калия. Есть знакомые бикарбонат натрия, калий — вместе их называли просто щелочными или щелочными солями. Они начали выделяться в 18-19 веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, а поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Первые известия о производстве калия относятся к XIV веку. Самое крупное из предприятий располагалось в Германии и Скандинавских странах. Карбонат калия использовался на мыловаренных заводах, в текстильной промышленности, в химчистках.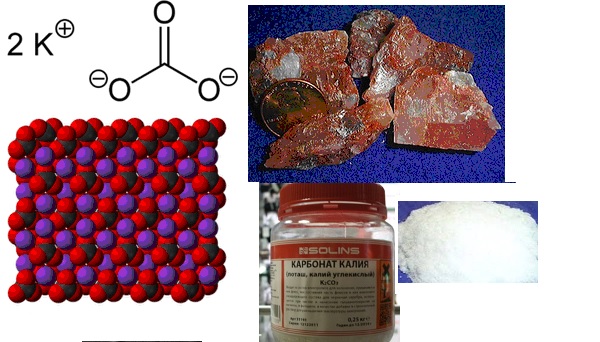 В 15 веке к конкурсу присоединилась и Россия. До этого не умели отделить калий от золы, а просто вывозили продукты горения вместе, например, с мехами. Стекольная промышленность как внутри России, так и за рубежом тоже нуждалась в этом веществе. Спрос вырос, как и предложение.
В 15 веке к конкурсу присоединилась и Россия. До этого не умели отделить калий от золы, а просто вывозили продукты горения вместе, например, с мехами. Стекольная промышленность как внутри России, так и за рубежом тоже нуждалась в этом веществе. Спрос вырос, как и предложение.
Кстати, само название «поташ» буквально является ключом к разгадке того, как его получали в древности. Дело в том, что на латыни это звучит как поташ, который, в свою очередь, представляет собой сплав слов «ясень» и «горшок».
Химические и физические свойства
В ходе экспериментов с этим веществом ученые получили информацию о некоторых присущих ему качествах. Сегодня известно, что в нормальных условиях чистый калий представляет собой твердое вещество в виде бесцветных кристаллов или белого порошка. Его плотность 2,43 г / см3. Температура плавления карбоната калия составляет 891 градус Цельсия. Высокая гигроскопичность.
Это вещество не взрывоопасно и не воспламеняется. Вызывает раздражение при контакте с кожей или влажными слизистыми оболочками. Поэтому его относят к третьему классу опасности.
Поэтому его относят к третьему классу опасности.
Разновидности и формы
Есть два типа калия: кальцинированный и полуторный водяной. В отличие от второй, первая форма не содержит воды — в процессе прокаливания она испаряется и удаляется органическое вещество, в результате чего раствор карбоната калия этого типа становится полностью бесцветным.
Кроме того, калий тоже различают разновидностями, их всего три. Качество конечного продукта зависит от содержания примесей, таких как железо, алюминий, хлориды, соли и сульфаты натрия. Кроме того, при присвоении марки учитывается массовая доля осадка, выпавшего в растворе, и потери при прокаливании.
Добыча
Хотя использование калия не происходит в таких масштабах, как в случае с содой, люди по-прежнему активно его используют. Но прежде всего его нужно получить. В небольших количествах это можно делать и в домашних условиях.
В первую очередь нужно сделать доступной вам золу растения. Затем нужно растворить его в определенном количестве горячей воды, хорошо перемешать и немного подождать. Далее нужно приступить к выпариванию раствора калия со смесью органических веществ, в результате чего выпадут кристаллы. Конечно, выделенный таким образом карбонат калия не будет высокого качества, и затраченные усилия будут слишком велики по отношению к количеству. Очевидно, что в промышленных масштабах все иначе.
Далее нужно приступить к выпариванию раствора калия со смесью органических веществ, в результате чего выпадут кристаллы. Конечно, выделенный таким образом карбонат калия не будет высокого качества, и затраченные усилия будут слишком велики по отношению к количеству. Очевидно, что в промышленных масштабах все иначе.
Следовательно, водный раствор карбоната калия взаимодействует с CO2, что приводит к образованию KHCO3. В свою очередь, он нагревается, и выделяются вода и углекислый газ, а остальное — оригинальный калий.
Есть много других способов получить это вещество, но самые простые и эффективные из них описаны выше.
Обработка
Как уже было сказано, существует два вида калия: кальцинированный и полуторный водный. Как карбонат калия обрабатывается для получения определенного сорта?
Во-первых, различаются и их формулы. Полувода выглядит так: K2CO3 + 1.5h3O, то есть изначально содержит воду. Однако он даже более гигроскопичен, чем обычно. Из этой формы можно получить и безводную форму — достаточно нагреть порошок до 130-160 градусов Цельсия.
Кальцинированная форма получается при переработке карбоната калия, полученного выпариванием зольного раствора в деревянных чанах. Такого вещества нет он отличается чистотой, поэтому его необходимо прокаливать или прокаливать. После выполнения одной из этих процедур порошок карбоната калия оказывается белого цвета, а его раствор совершенно бесцветным. В этом случае вещество не содержит воды.
Использование
На сегодняшний день калий в различных формах используется в огромном количестве отраслей и для самых разных целей. Например, его превосходная очищающая способность до сих пор используется при производстве жидкого мыла и другой бытовой химии.
Кроме того, калий является антифризной добавкой для строительных растворов. Таким образом, это позволяет смеси быть более устойчивыми к холоду, что позволяет продолжать строительство даже при довольно низких температурах. Его существенное преимущество перед аналогами в том, что он не вызывает коррозии конструкций, а также образования высолов, которые могли сказываются на прочности конструкции.
Карбонат калия по-прежнему используется в высококачественном хрустальном и оптическом стекле. В этом вопросе ему нет замены. Аналогов этому веществу нет, например, при производстве тугоплавкого стекла.
Калий часто входит в состав красок, а в химической промышленности он также используется для поглощения сероводорода из газовых смесей — он справляется с этим намного лучше, чем сода. Этому есть место в фармацевтике: карбонат калия участвует в некоторых реакциях, а местами проявляется как побочное действие. Еще одна область применения — пожаротушение. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Удивительно, но калий также является пищевой добавкой. Его код E501, поэтому он относится к классу E. Некоторое время его использовали в кондитерских изделиях, например, при производстве имбирных пряников. В легкой промышленности это вещество также участвует в процессе одевания кожи.
Наконец, есть большие перспективы использования калия в производстве безхлорных калийных удобрений. Зола использовалась в этом качестве долгое время, но в последние десятилетия ее вытеснили промышленные корма. Вероятно, в ближайшем будущем широко известный метод получит широкое распространение и будет наименее вредным по сравнению с используемыми сейчас минеральными удобрениями.
Зола использовалась в этом качестве долгое время, но в последние десятилетия ее вытеснили промышленные корма. Вероятно, в ближайшем будущем широко известный метод получит широкое распространение и будет наименее вредным по сравнению с используемыми сейчас минеральными удобрениями.
Другие особенности
Поскольку калий является чрезвычайно гигроскопичным веществом, его упаковка, хранение и транспортировка проходят в особых условиях. Обычно для упаковки карбоната калия используются пятислойные пакеты. Это единственный способ избежать нежелательного попадания воды в это вещество.
Также неожиданно, несмотря на отличную реакцию с h3O, карбонат калия полностью нерастворим в ацетоне и этаноле.
Поделиться:
- Предыдущая записьВал — это что такое? Значение, происхождение, синонимы
- Следующая записьСажень — это сколько? Сколько саженей в метре и версте
×
Рекомендуем посмотреть
Adblock
detector
это.
 .. Формула и применение поташа
.. Формула и применение поташаПоташ — это неофициальное название вещества, которое химики называют карбонатом калия. Эта соль известна людям с древнейших времен, поскольку она содержится в золе. Раньше этим словом называли именно сухой остаток после выпаривание раствора продуктов сгорания растений. Итак, что же сейчас известно про поташ?
Формула
Еще одно название этого вещества — углекислый калий. И его химическая формула записывается так — K2CO3. Он представляет собой среднюю соль калия и угольной кислоты. Это значит, что раствор поташа не является кислотным или основным, он нейтральный. Долгое время его путали с пищевой содой — NaHCO3.
История открытия и изучения
Разумеется, доподлинно мы не знаем, кто первым получил поташ, ведь он был известен еще в Древней Греции и Риме. Тогда его выделяли из золы и использовали для стирки. Любопытно, что долгое время его путали с другим веществом — гидрокарбонатом калия. Знакомая нам пищевая сода, поташ — вместе их именовали просто алкалическими или щелочными солями. Различать их начали в XVIII-XIX веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, в то время как поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Различать их начали в XVIII-XIX веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, в то время как поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Первые упоминания о производстве поташа относятся к XIV веку. Наиболее крупные из предприятий находились в Германии и скандинавских странах. Карбонат калия использовался в мыловарнях, суконной промышленности, красильных предприятиях. В XV веке в конкуренцию включилась и Россия. До этого выделять поташ из золы не умели, а просто экспортировали продукты горения наряду с, например, мехами. Стекольная промышленность как внутри России, так и за границей тоже нуждалась в этом веществе. Спрос рос, а с ним росло и предложение.
Кстати, само название «поташ» — это буквально подсказка способа его получения в древности. Дело в том, что в латыни оно звучит как potassa, что в свою очередь является слиянием слов «зола» и «горшок».
Химические и физические свойства
В ходе проведения экспериментов с этим веществом ученые получали информацию о тех или иных качествах, присущих ему. На сегодняшний день известно, что при нормальных условиях чистый поташ — это твердое вещество в виде бесцветных кристаллов или белого порошка. Его плотность — 2,43 г/см3. Температура плавления карбоната калия — 891 градус Цельсия. Обладает высокой гигроскопичностью.
Это вещество не является взрыво- или пожароопасным. При попадании на влажную кожу или слизистую вызывает раздражение. Таким образом, его относят к третьему классу опасности.
Разновидности и формы
Различают два вида поташа: кальцинированный и полутораводный. В отличие от второго, первая форма не содержит воду — в процессе кальцинирования она
испаряется, а также удаляются органические вещества, в результате раствор карбоната калия такого вида становится совершенно бесцветным.
Кроме того, различают поташ и по сортам, выделяют всего три. Качество конечного продукта зависит от содержания таких примесей, как железо, алюминий, хлориды, натрий и сернокислые соли. Также при присвоении сорта учитывается массовая доля выпавшего в растворе осадка и потери при прокаливании.
Добыча
Хотя применение поташа происходит не в таких огромных масштабах, как в случае с содой, он до сих пор активно используется людьми. Но прежде всего его нужно получить. В небольших количествах сделать это можно даже дома.
Прежде всего необходимо получить в свое распоряжение золу растительного происхождения. Затем нужно растворить ее в некотором количестве горячей воды, хорошенько размешав и подождав некоторое время. Далее нужно начать выпаривать раствор поташа со смесью органических веществ, что вызовет выпадение кристаллов. Разумеется, карбонат калия, выделенный подобным способом, не будет отличаться высоким качеством, да и потраченные усилия слишком велики в сравнении с количеством. Так что, разумеется, в промышленным масштабах все происходит иначе.
Так что, разумеется, в промышленным масштабах все происходит иначе.
Итак, водный раствор карбоната калия взаимодействует с CO2, что приводит к образованию KHCO3. Его, в свою очередь, нагревают, и происходит выделение воды и диоксида углерода, в остатке же — изначальный поташ.
Существует еще несколько способов получения этого вещества, однако самыми простыми и эффективными являются те, что описаны ранее.
Обработка
Как уже было упомянуто, различают два вида поташа — кальцинированный и полутораводный. Каким же образом происходит обработка карбоната калия для получения той или иной разновидности?
Прежде всего, различаются даже их формулы. Полутораводный выглядит так: K2CO3+1,5H2O, то есть он содержит воду изначально. Тем не менее, он даже более гигроскопичен, чем обычный. Из этой формы можно получить и безводную форму — достаточно нагреть порошок до 130-160 градусов по Цельсию.
Кальцинированная форма получается при обработке карбоната калия, полученного с помощью выпаривания раствора золы в деревянных чанах. Такое вещество не
Такое вещество не
отличается чистотой, так что его приходится либо прокаливать, либо кальцинировать. После проведения одной из этих процедур порошок карбоната калия получается белым, а его раствор — совершенно бесцветным. В этом случае вещество не содержит воды.
Использование
С давних пор и по сей день карбонат калия в разных видах применяется в огромном количестве отраслей и с самыми разными целями. Например, его прекрасная способность к очищению до сих пор используется при изготовлении жидкого мыла и другой бытовой химии.
Кроме того, поташ — противоморозная добавка к строительным растворам. В этом качестве он позволяет смесям быть более устойчивыми к холоду, что дает возможность продолжать строительство даже при довольно низких температурах. Его значительное преимущество перед аналогами состоит в том, что он не вызывает коррозии конструкций, а также образования высолов, которые могли бы
повлиять на прочность сооружения.
Все еще используется карбонат калия при изготовлении хрусталя и стекла для высококачественной оптики. Замены ему в этом деле нет. Не существует и никаких аналогов этого вещества, например, при изготовлении тугоплавкого стекла.
Часто поташ — это компонент красок, также в химической промышленности он используется для поглощения сероводорода из газовых смесей — с этим он справляется гораздо лучше соды. Есть ему место и в фармацевтике: карбонат калия участвует в некоторых реакциях, а кое-где появляется в качестве побочного результата. Еще одна область применения — пожарное дело. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Как ни удивительно, но поташ — это еще и пищевая добавка. Его код — Е501, так что он относится к классу Е. Какое-то время он использовался в кондитерском деле, например, при изготовлении пряников. В легкой промышленности это вещество также участвует в процессе выделки кож.
Наконец, высоки перспективы применения поташа в изготовлении бесхлорных калийных удобрений. Зола в этом качестве применялась издавна, но в последние десятилетия ее вытеснили подкормки промышленного изготовления. Вероятно, в ближайшее время в широких масштабах будет применяться способ, известный давно и являющийся наименее вредным в сравнении с минеральными удобрениями, применяемыми сейчас.
Зола в этом качестве применялась издавна, но в последние десятилетия ее вытеснили подкормки промышленного изготовления. Вероятно, в ближайшее время в широких масштабах будет применяться способ, известный давно и являющийся наименее вредным в сравнении с минеральными удобрениями, применяемыми сейчас.
Другие особенности
Поскольку поташ — крайне гигроскопичное вещество, его упаковка, хранение и транспортировка проходят в специальных условиях. Как правило, для фасовки карбоната калия используются пятислойные мешки. Только так можно избежать нежелательного попадания воды в это вещество.
Кроме того, как ни удивительно, несмотря на прекрасную реакцию с H2O, карбонат калия совершенно не растворяется ацетоном и этанолом.
Поташ — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Дворец Потала)
Следующий (Калий)
Поташ
Термин1 означает больше, чем один4.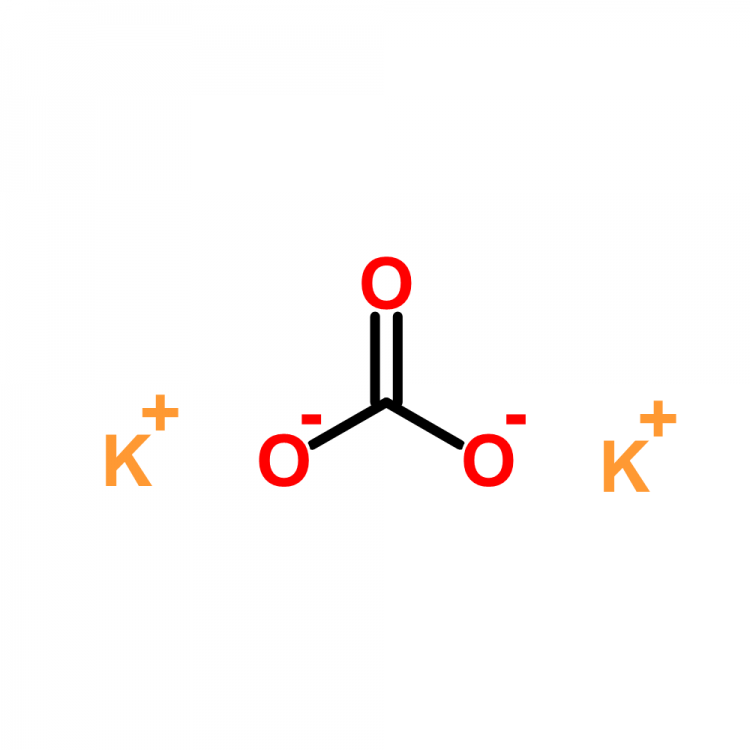 В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1]
В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1]
Содержание
- 1 Этимология
- 2 Различные значения
- 3 Историческая продукция
- 4 Текущее производство
- 5 См. также
- 6 Примечания
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Поташ использовался с древних времен в производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название получено путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.
Различные значения
Термин стал несколько двусмысленным из-за замены в удобрениях более дешевых солей калия, таких как хлорид калия (KCl) или оксид калия (K 2 O), которым теперь иногда присваивается одно и то же общее название также применяется. Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Различные химические соединения, содержащие калий, имеют слово поташ в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий кали или калийный щелок | гидроксид калия | КОН |
| карбонат калия, соли винного камня или жемчужная зола | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века поташ был одним из самых важных химических веществ на промышленно развитом Западе.
В конце восемнадцатого и начале девятнадцатого века производство калия давало североамериканским поселенцам способ получить крайне необходимые деньги и кредит, когда они расчищали свои лесные угодья под посевы. Чтобы в полной мере использовать свою землю, необходимо было утилизировать лишнюю древесину, включая пни. Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Зола лиственных пород использовалась для производства щелочи (гидроксида калия), которая, в свою очередь, использовалась для изготовления мыла или вываривалась для производства поташа.
Твердая древесина может образовывать пепел в количестве от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³/км²)). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Рафинированный калий пользовался растущим спросом в Европе для использования в производстве стеклянных и керамических изделий. Говорят, что американская лиственная древесина, помимо того, что она более распространена, дает более высокий выход качественного калия, чем европейская древесина. В некоторых местах калийные квитанции стали обычной формой валюты. Некоторые поселенцы считали производство калия весьма прибыльным делом. К сожалению, такой подход к получению быстрых денег увеличил темпы вырубки лесов, что отрицательно сказалось на дикой природе и экосистемах этих районов.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калия путем добычи и производства. Основные поставки осуществляются из Саскачевана, Канады, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также признана одной из самых богатых запасов калия в мире и потенциально может стать крупным экспортером этого минерала. Однако добыча полезных ископаемых в этом районе была отложена из-за сопротивления общественности. Многие сельские жители, живущие прямо над предполагаемым рудником, выразили обеспокоенность по поводу неблагоприятных последствий, таких как оседание земли и засоление грунтовых вод и почвы. Эти последствия поставят под угрозу экономическую стабильность местных сообществ, выживание которых в основном зависит от выращивания риса.
См. также
- Керамика
- Карбонат
- Стекло
- Калий
Примечания
- ↑ Калий Информация о полезных ископаемых Геологической службы США . Проверено 9 октября 2007 г.

Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Гарретт, Дональд Э. 1995. Калий: месторождения, переработка, свойства и использование . Лондон: Чепмен и Холл. ISBN 0412990717
- Хайли, Дэвид и др. 2006. Калий Британская геологическая служба . Проверено 9 октября 2007 г. .
- Кислер, М. Пол. 2002. Вторжение янки: они сожгли лес и продали пепел Ирокез: открытие долины кристаллов . Проверено 9 октября 2007 г.
Внешние ссылки
Все ссылки получены 13 июня 2019 г.
- Производство калия в Северной Швеции: история и экологические последствия доиндустриальной эксплуатации лесов
- Первый патент Изобретения и технологии, осень 1990 г. .
Авторы
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3. 0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен быть указан в соответствии с условиями этой лицензии, которая может ссылаться как на New World Encyclopedia и самоотверженные добровольные участники Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен быть указан в соответствии с условиями этой лицензии, которая может ссылаться как на New World Encyclopedia и самоотверженные добровольные участники Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Поташ история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Potash»
Примечание. На использование отдельных изображений могут распространяться некоторые ограничения, которые лицензируются отдельно.
Поташ — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Дворец Потала)
Следующий (Калий)
Поташ
3 Значение термина «поташ» больше, чем одно.
 В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1]
В узком смысле это относится к соли карбоната калия (K 2 CO 3 ). В более широком смысле это общий термин для различных водорастворимых солей калия, которые можно добывать или производить. [1] Содержание
- 1 Этимология
- 2 Различные значения
- 3 Историческая продукция
- 4 Текущее производство
- 5 См. также
- 6 Примечания
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Поташ использовался с древних времен в производстве стекла, керамики и мыла. Сегодня калий (в виде оксида калия) используется в основном как удобрение.
Этимология
Название получено путем объединения английских слов pot и ash , ссылаясь на его открытие в водорастворимой фракции древесной золы. Элемент калий был назван в честь слова поташ.Различные значения
Термин стал несколько двусмысленным из-за замены в удобрениях более дешевых солей калия, таких как хлорид калия (KCl) или оксид калия (K 2 O), которым теперь иногда присваивается одно и то же общее название также применяется. Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Кроме того, гидроксид калия (КОН) обычно называют едкий кали , дополнительный источник путаницы.
Различные химические соединения, содержащие калий, имеют слово поташ в своих традиционных названиях, как указано в таблице ниже.
| Традиционное имя | Химическое название | Химическая формула |
| калийные удобрения | оксид калия | К 2 О |
| едкий кали или калийный щелок | гидроксид калия | КОН |
| карбонат калия, соли винного камня или жемчужная зола | карбонат калия | K 2 CO 3 |
| хлорат калия | хлорат калия | KClO 3 |
| хлористый калий | хлорид калия | KCl |
| нитрат калия или селитры | нитрат калия | KNO 3 |
| сульфат калия | сульфат калия | K 2 SO 4 |
Историческое производство
До двадцатого века поташ был одним из самых важных химических веществ на промышленно развитом Западе. Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
Извлекаемый из золы широколиственных деревьев, он производился в основном в лесных районах Европы, России и Северной Америки. Первый патент США был выдан в 179 г.0 Сэмюэлю Хопкинсу за усовершенствование в производстве «Горшечной золы и жемчужной золы с помощью нового аппарата и процесса».
В конце восемнадцатого и начале девятнадцатого века производство калия давало североамериканским поселенцам способ получить крайне необходимые деньги и кредит, когда они расчищали свои лесные угодья под посевы. Чтобы в полной мере использовать свою землю, необходимо было утилизировать лишнюю древесину, включая пни. Самый простой способ добиться этого — сжечь всю древесину, которая не нужна для топлива или строительства. Зола лиственных пород использовалась для производства щелочи (гидроксида калия), которая, в свою очередь, использовалась для изготовления мыла или вываривалась для производства поташа.
Твердая древесина может образовывать пепел в количестве от 60 до 100 бушелей на акр (от 500 до 900 кубических метров на квадратный километр (м³/км²)). В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
В 1790 году пепел можно было продать по цене от 3,25 до 6,25 долларов за акр (от 800 до 1500 долларов за км²) в сельской местности штата Нью-Йорк — почти по той же цене, что и наем рабочего для расчистки той же территории.
Рафинированный калий пользовался растущим спросом в Европе для использования в производстве стеклянных и керамических изделий. Говорят, что американская лиственная древесина, помимо того, что она более распространена, дает более высокий выход качественного калия, чем европейская древесина. В некоторых местах калийные квитанции стали обычной формой валюты. Некоторые поселенцы считали производство калия весьма прибыльным делом. К сожалению, такой подход к получению быстрых денег увеличил темпы вырубки лесов, что отрицательно сказалось на дикой природе и экосистемах этих районов.
Текущее производство
Сегодня 14 стран производят большую часть мировых запасов калия путем добычи и производства. Основные поставки осуществляются из Саскачевана, Канады, а дополнительные поставки производятся в России, Беларуси, Германии, Израиле и Иордании. Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Среди них Израиль и Иордания используют солнечные испарители на Мертвом море для производства карналлита, из которого производится хлорид калия.
Провинция Удонтхани на северо-востоке Таиланда также признана одной из самых богатых запасов калия в мире и потенциально может стать крупным экспортером этого минерала. Однако добыча полезных ископаемых в этом районе была отложена из-за сопротивления общественности. Многие сельские жители, живущие прямо над предполагаемым рудником, выразили обеспокоенность по поводу неблагоприятных последствий, таких как оседание земли и засоление грунтовых вод и почвы. Эти последствия поставят под угрозу экономическую стабильность местных сообществ, выживание которых в основном зависит от выращивания риса.
См. также
- Керамика
- Карбонат
- Стекло
- Калий
Примечания
- ↑ Калий Информация о полезных ископаемых Геологической службы США . Проверено 9 октября 2007 г.

Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Гарретт, Дональд Э. 1995. Калий: месторождения, переработка, свойства и использование . Лондон: Чепмен и Холл. ISBN 0412990717
- Хайли, Дэвид и др. 2006. Калий Британская геологическая служба . Проверено 9 октября 2007 г. .
- Кислер, М. Пол. 2002. Вторжение янки: они сожгли лес и продали пепел Ирокез: открытие долины кристаллов . Проверено 9 октября 2007 г.
Внешние ссылки
Все ссылки получены 13 июня 2019 г.
- Производство калия в Северной Швеции: история и экологические последствия доиндустриальной эксплуатации лесов
- Первый патент Изобретения и технологии, осень 1990 г. .
Авторы
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.

